Кондуктометрическое титрование. Электрическая проводимость электролитов
Электрическая проводимость электролитов. Удельная электрическая проводимость. Молярная электрическая проводимость
Основной характеристикой проводника электрического тока является его электрическое сопротивление R или обратная ему величина 1/R, называемая электрической проводимостью. Под электропроводностью вещества, в т.ч. и электролита понимают его способность пропускать электрический ток под действием напряжения.
I = U/R (1)
Известно, что сопротивление однородного линейного проводника зависит от его длины l и площади поперечного сечения S по уравнению:
 , (2)
, (2)
где ρ – удельное сопротивление.
Поэтому  , (3)
, (3)
χ = 1/ρ – величина, обратная удельному сопротивлению, наз-ся удельной электрической проводимостью.
 .
.
Удельной электрической проводимостью- это эл/проводность объема раствора, заключенного между двумя параллельными электродами, имеющими площадь по 1м2 и расположенными на расстоянии 1м друг от друга.
Удельная электрическая проводимость раствора электролита определяется количеством ионов и скоростями их миграции. Допустим, что между электродами, расположенными друг от друга на расстоянии l, к которым приложена разность потенциалов U. Находится раствор электролита, содержащий несколько видов ионов. Для ионов i-го вида: концентрация сi, зарядность zi, скорость движения в электрическом поле vi. Через поперечное сечение S раствор, находящягося между электродами, за 1с мигрирует сiviS ионов i-го вида, которые переносят электричества ziF сiviS. Все виды ионов в растворе переносят ∑ ziF сiviS (Кл). Учитывая, что количество электричества, проходящее через проводник за 1с, соответствует силе тока, получаем
|
|
|
I = FS ∑ zi сivi. (4)
Из  и
и 
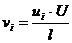 и, подставляя в (4), получим
и, подставляя в (4), получим
I = (FSU)/l ∑ zi сiui (5)
В соответствии с законом Ома
 . (6)
. (6)
Из уравнений (5) и (6) получаем
χ = F ∑ zi сiui. (7)
|
|
|
Для раствора бинарного электролита при концентрации с (моль/л), z+=z-=z и степени диссоциации α имеем
χ = 103 α zF с(u++u-). (8)
Рассмотрим зависимость удельной электропроводности от концентрации.
В разбавленных растворах сильных и слабых электролитов с увеличением конц-ии электропроводность ув-ся, что обусловлено ув-ем числа ионов, переносящих электричество. Когда конц-ия становится достаточно большой, в растворах сильных электролитов существенно начинает влиять взаимное притяжение противоположно заряженных ионов, при этом ум-ся скорость движения ионов и эл/проводность снижается. В растворах слабых электролитов в области концентрированных растворов снижается степень диссоциации, следовательно, число ионов, переносящих электричество (см. рисунок 2).
При повышении температуры электролита возрастают скорость движения и уд. эл/проводность:
χ2 = χ1[ 1+α(Т2-Т1) ]. (9)
где α – температурный коэффициент электрической проводимости.
|
|
|
Молярная электрическая проводимость раствора – это эл/проводность объема V (м3) раствора, заключенного между двумя параллельными электродами, с межэлектродным расстоянием 1м, причем каждый электрод имеет такую площадь, чтобы в этом объеме содержался 1 моль растворенного вещества. Между молярной и удельной эл/проводностями имеется соотношение
 , (10)
, (10)
где λ – молярная электрическая проводимость,Ом-1∙м2/моль; χ – удельная электрическая проводимость, Ом-1∙м-1;V – разведение раствора, м3/моль; с – концентрация, моль/м3.
Если конц-ия р-ра выражена в моль/л, то ур-е (10) записывается в виде
 . (11)
. (11)
Молярная электрическая проводимость как для сильных так и для слабых электролитов растет с ув-ем разбавления, т.е. с понижением конц-ии и достигает некоторого предельного значения λ∞. Эта величина отвечает электрической проводимости бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита и отсутствием сил электростатического взаимодействия между ионами.
|
|
|
Из ур-ий (8) и (11) следует
 . (12)
. (12)
Для слабых электролитов молярная электрическая проводимость бесконечно разбавленного раствора будет выражаться:
 . (13)
. (13)
Произведение zFui∞=λi∞ наз-ся предельной молярной электрической проводимостью или подвижностью иона при бесконечном разбавлении (при бесконечно малой концентрации).
 . (14)
. (14)
Ур-е (4) есть закон независимости движения ионов в разбавленных растворах или его наз-т законом Кольрауша.
Из ур-ий (12) и (13) следует:
 ,
,
где 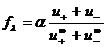 - коэффициент электрической проводимости.
- коэффициент электрической проводимости.
Электрические подвижности ионов в разбавленных растворах и в бесконечно разбавленных близки между собой (fλ=1), поэтому
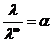 .
.
Для сильных электролитов, диссоциирующих полностью,
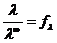 .
.
Рассмотрим зависимость молярной электрической проводимости слабых и сильных электролитов от концентрации.
Молярная электрическая проводимость слабых электролитов с ув-ем разведения или с понижением конц-ии ув-ся, что объясняется ув-ем степени диссоциации электролита.
Изменение молярной электрической проводимости от конц-ии для сильных электролитов объясняется с иных позиций.
Дебаем и Онзагером предложена теория электрической проводимости растворов, представляющая собой развитие основных положений электростатической теории растворов. Согласно их теории сниженение молярной электропроводности сильных электролитов при увеличении конц-ии электролита объясняется торможением движения ионов в электрическом поле из-за их электростатического взаимодействия. При этом учитываются два эффекта, вызывающих взаимное торможение ионов: электрофоретический и релаксационный эффекты.
Электрофоретический эффект заключается в том, что в водной среде все ионы гидратированы и под действием внешнего электрического поля движутся в противоположных направлениях, что создает дополнительное торможение движению иона.
Релаксационный эффект связан с существованием ионной атмосферы. обладающей центральной симметрией. При движении иона в электрическом поле симметрия ионной атмосферы нарушается. Это связано с тем, что перемещение иона сопровождается разрушением ионной атмосферы в одном положении иона и формированием ее в другом, новом. Скорость, с которой происходит восстановление ионной атмосферы в новом месте наз-ся временем релаксации. Для бинарного электролита в достаточно разбавленных растворах время релаксации τ выражается:
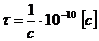 ,
,
где с – конц-ия электролита в г-экв/л.
Н-р, для 0,1 н р-ра NaCI τ=10-9 c, для 0,001 н р-ра τ=10-7 c.
Т.о. молярная электрическая проводимость при данной конц-ии λс всегда меньше электрической проводимости бесконечно разбавленного р-ра, в котором отсутствуют силы межионного взаимодействия:
 ,
,
где  - уменьшение электрической проводимости за счет эффектов электрофоретического и релаксационного торможения.
- уменьшение электрической проводимости за счет эффектов электрофоретического и релаксационного торможения.
Зависимость молярной электрической проводимости от конц-ии для бинарного электролита выражается ур-ем Онзагера:
 ,
,
где А и В – константы, зависящие от природы растворителя и температуры.
Данное ур-е справедливо для разбавленных растворов сильных электролитов. При ув-ии конц-ии в р-рах сильных электролитов усиливаются эффекты сольватации и ассоциации ионов. Ув-е размеров сольватной оболочки сопровождается снижением скорости движения ионов в электрическом поле. Образование ассоциатов приводит к тому, что часть ионов не участвует в переносе электричества. Для расчета электрической проводимости концентрированных р-ров исп-ют полуэмпирические ур-я, н-р ур-е Шидловского:
 ,
,
где D – эмпирический коэффициент.
Зависимость молярной электропроводности от конц-ии для слабых электролитов может быть найдена следующим образом.
Рассмотрим бинарный слабый электролит, константа диссоциации которого определяется ур-ем (н-р гидроокись аммония):
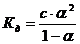 , т.к.
, т.к. 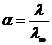 , то
, то
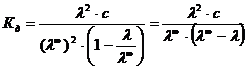 .
.
Это ур-е разведения или з-н разведения Оствальда.
Дата добавления: 2018-02-18; просмотров: 608; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
