Окислительно-восстановительные электроды
Подобные электроды состоят из инертного вещества с электронной проводимостью (Pt), погруженного в раствор, содержащий вещества с различной степенью окисления Red и Ox. Металл в этих реакциях обменивается электронами с участниками окислительно-восстановительной реакции и принимает определенный потенциал при установлении равновесного состояния.
Ox, Red | Pt
Ox + ne↔Red
Fe3+, Fe2+ | Pt
 .
.
Рассмотрим устройство окислительно-восстановительного электрода - хингидронного электрода.
Он представляет собой платиновую пластинку, опущенную в раствор хингидрона – соединение хинона и гидрохинона в эквимолярных количествах С6Н4О2∙С6Н4(ОН)2
Дикетон двухатомный фенол
В воде оно слаборастворимо и в растворе частично распадается на хинон и гидрохинон.
Схема:
С6Н4О2, С6Н4(ОН)2 ,Н+ | Pt
Гидрохинон диссоциирует в растворе по уравнению:
С6Н4(ОН)2 ↔ С6Н4О22- + 2Н+
Образующийся анион переходит в хинон при потере заряда
С6Н4О22-↔С6Н4О2 + 2е
Суммарное уравнение на электроде:
С6Н4О2 + 2Н++ 2е↔ С6Н4(ОН)2
 .
.
Т.к. ах=агх
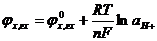 .
.
Хингидронный электрод может быть использован для измерения рН кислых и слабощелочных растворов (до рН8), не содержащих окислителей и восстановителей.
Достоинство: простота устройства и быстрое установление потенциала.
Ионообменные электроды
Ионообменный электрод состоит из ионита и раствора. Потенциал на границе раздела фаз возникает за счет ионообменных процессов между ионитом и раствором. Н-р, ионит содержит ионы L+, способные к обмену с ионами М+, находящимися в растворе:
|
|
|
 .
.
При установлении равновесия в данном обменном процессе на границе ионит-раствор возникает электродный потенциал.
Стеклянный электродпредставляет собой тонкую мембрану из стекла, в которой повышено содержание щелочного металла – Na, Li и др. При потенциалопределяющем процессе на границе металл – стекло ионы щелочного металла, находящегося в стекле, обмениваются с ионами Н+, находящимися в растворе.
 ;
;
 .
.
 ,
,
где К=1/Коб.
Электрохимические цепи
Из обратимых электродов составляют обратимые электрохимические цепи (пары, гальванические элементы). Различают два вида электрохимических цепей - химические и концентрационные.
Химические цепи. Электрическая энергия в данной цепи возникает за счет химической реакции.
Пример:
-Pb|Pb2+||Ag+|Ag+
 ;
;
 .
.
Ур-я потенциалопределяющих р-ций:
Pb↔Pb2++2e;
Ag++e↔Ag.
Суммарная р-ция в цепи:
Pb + 2Ag+↔Pb2++2Ag.
ЭДС данной химической цепи:
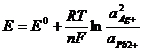 ,
,
где  .
.
Важное теоретическое и практическое значение имеет водородно-кислородная цепь
-Pt,H2|H+,OH-|O2,Pt+
Ур-я электродных процессов и суммарной р-ции в элементе:
|
|
|
2Н2↔4Н++4е
О2+2Н2О+4е↔4ОН-
2Н2+О2+2Н2О↔4Н++4ОН-
или 2Н2+О2↔2Н2О
ЭДС цепи
 ,
,
где РО2 и РН2- относительные парциальные давления кислорода и водорода на электродах.
Если аН2О=1 и учитывая, что аН+∙аОН-=КW
 .
.
Химические цепи имеют большое практическое значение. Разные химические источники тока, такие как гальванические элементы (первичные) и аккумуляторы (вторичные) являются химическими цепями. Н-р, водородно-кислородная цепь является одним из видов топливных гальванических элементов, в которых протекает реакция окисления топлива или продуктов его переработки (водорода, оксида углерода, водяного газа и др.). КПД таких элементов выше (70-80%) по сравнению с КПД тепловых установок (30-40%).
Рассмотрим вторичный источник химического тока свинцовый (кислотный) аккумулятор.
-Pb | H2SO4 | PbO2, Pb+.
Токообразующие реакции на электродах:
Pb+SO42-↔PbSO4+2e;
PbO2+4H++SO42-↔PbSO4+2H2O.
Cуммарная реакция в аккумуляторе:
Pb+ PbO2+2H2SO4↔2PbSO4+2Н2О.
Когда система работает как источник тока, реакция идет слева направо, на электродах образуется PbSO4 . Электроды становятся одинаковыми – электродами II рода SO42-| PbSO4, Pb, ЭДС падает и аккумулятор разряжается. Заряжают его, пропуская ток в обратном направлении. Повторение циклов разрядки и зарядки позволяет использовать аккумулятор длительное время.
|
|
|
Концентрационные цепи.
Это элементы, составленные из двух одинаковых полуэлементов и различающиеся:
1) концентрацией ионов в растворе;
2) концентрацией металла в амальгаме или сплаве;
3) давлением газа, насыщающего инертный электрод.
1) –Cu|Cu2+||Cu2+|Cu+
a1 a2
a1<a2: Если a1>a2:
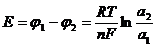 .
.  .
.
2) –Hg, [Cd] | Cd2+| Hg, [Cd]+
a1 a2
a1<a2:
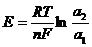 .
.
В амальгамных элементах положительным является электрод, у которого активность металла в амальгаме (сплаве) меньше, т.к. именно на нем осаждается металл из раствора.
3) -Pt, H2| H+| H2, Pt+
P1 P2
a1=a2, P1>P2:
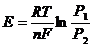 .
.
Дата добавления: 2018-02-18; просмотров: 715; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
