Непрямая электрохимическая детоксикация
Одним из современных эфферентных методов окисления является непрямая электрохимическая детоксикация, которая осуществляется путем внутривенного введения гипохлорита натрия – NaClO, получаемого с помощью электролиза из раствора NaCl [Федоровский Н.М., 1993; Мальцева Л.А., 2000]. Данный метод, основанный на замещении функции цитохрома P-450, моделирует функцию монооксигеназной системы печени, которая значительно снижена при полиорганной дисфункции [Yao S., 1975; Арчаков А.И., 1975; Лопухин Ю.М., 1983]. Кроме того, гипохлорит-анион, являясь естественной антибактериальной субстанцией организма, которая продуцируется при фагоцитозе ферментом активированных нейтрофилов – миелопероксидазой, в физиологической концентрации обладает прямым антибактериальным эффектом [Рябов Г.А., 2000], в связи с чем раствор NaClO успешно применяется для санации брюшной полости при перитоните [Гостищев В.К., 2002]. Являясь идеальным переносчиком активного кислорода, гипохлорит натрия может потенцировать действие других методов детоксикации, и может успешно применяться в комплексном лечении у больных перитонитом [Бояринов Г.А., 1997]. Так, возможности электрохимической детоксикации возрастают при сочетании ее с внутрисосудистым лазерным облучением крови [Романчишен А.Ф., 2001]. Несмотря на многообразие исследований, посвященных данному методу, до настоящего времени в литературе нет единого мнения об оптимальной дозировке, продолжительности курса, механизмах действия и степени эффективности НЭХД [Рудаков С.Ю., 1996; Соколова С.Н., 1998; Федосеев А.В., 2001; Чирков А.Н., 2003].
|
|
|
Согласно нашим данным, устойчивый эффект от применения НЭХД при перитоните достаточно очевиден в основном при стадии энтеральной недостаточности.
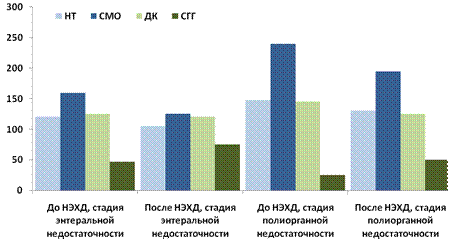
Рис. 11.4. Влияние НЭХД на показатели некротических тел (НТ),
Среднемолекулярных олигопептидов (СМО), диеновых конъюгатов (ДК),
сульфгидрильных групп (СГГ) у больных при перитоните (% к норме)
В частности, установлено, что применение данного метода в раннем послеоперационном периоде при ЭН приводило к нормализации в плазме крови концентрации токсических соединений (некротических тел, среднемолекулярных олигопептидов, диеновых конъюгатов). При этом протеолитическая активность плазмы и сорбционная способность эритроцитов, несмотря на существенное снижение, оставались еще повышенными (протеолитическая активность плазмы в 1,4 раза; сорбционная способность эритроцитов на 15%; р < 0,05) что, по-видимому, имеет компенсаторно-приспособительный характер. При полиорганной дисфункции тенденция к снижению сохранялась, но существенные различия прослеживались не всегда (некротические тела в 1,3 раз, молекулы средней массы - в 2 раза, диеновые конъюгаты - в 1,3 раза, протеолитическая активность плазмы и сорбционная способность эритроцитов - в 1,6 раза, церулоплазмин в 1,8 раза выше норм; сульфгидрильные группы - в 2 раза ниже нормы) (рис. 11.4).
|
|
|
На фоне уменьшения интоксикации отмечалось улучшение показателей центральной гемодинамики и вегетативной нервной системы. У больных с нормокинетическим типом кровообращения данный метод способствует профилактике появления циркуляторно гемодинамических нарушений, а у больных с гиперкинетическим синдромом регрессу последнего при ЭН и ПОН (таблица 11.8). Исходная повышенная симпатическая активность сердечно-сосудистой системы значительно уменьшалась при ЭН с сохраняющейся тенденцией к снижению при ПОН (таблица 11.9).
Таблица 11.8
Влияние НЭХД на показатели центральной гемодинамики
у больных с гиперкинетическим синдромом при перитоните
| Стадии перитонита | Применение НЭХД | МОС, | СОС, мл | ПСС, | Коэффициент | ||||
| МОС - СО | МОС -ПСС | СО - ПСС | |||||||
| ЭН | без НЭХД | 6235,7±264,8 | 60,0±2,1 | 1223,6±63,5 | 0,81 | -0,80 | -0,63 | ||
| НЭХД | 5900,8±190,1 | 55,6±2,7 | 1482,7±88,1* | 0,64 | -0,68 | -0,52 | |||
| ПОН
| без НЭХД | 7000,5±421,1 | 59,6±2,2 | 956,8±60,2 | 0,72 | -0,86 | -0,70 | ||
| НЭХД | 6839,7±159,0 | 59,4±1,7 | 1000,0±58,7 | 0,85 | -0,80 | -0,60 | |||
| *p<0,05; уровень статистической значимости различий в подгруппах | |||||||||
Полученные данные свидетельствуют, что данный метод коррекции нарушений при перитоните должен шире применяться в клинической практике в связи со своей простотой и доступностью.
Таблица 11.9
Влияние НЭХД на уровень вегетативного индекса (ВИ) при перитоните
| Стадии перитонита | До операции | Без НЭХД | НЭХД | |||
| n | ВИ | n | ВИ | n | ВИ | |
| Энтеральная недостаточность | 91 | 27,9±0,9 | 16 | 28,6±2,2 | 18 | 23,5±0,9 |
| Полиорганная недостаточность | 21 | 46,0±2,5** | 9 | 46,2±4,2* | 10 | 44,9±1,5* |
| *p<0,05; **p<0,01 различия с предыдущими стадиями; | ||||||
Оценка влияния сеансов электрохимической детоксикации на уровень токсических соединений промежуточного метаболизма проводилась в эксперименте на 40 животных, которым моделировался мочевой перитонит.
Таблица 11.10. Структура эндогенной интоксикации при
НЭХД и антибиотикотерапии в эксперименте
| Соединения мкг/л | Контроль | Экспериментальные группы | |||||
| Без лечения | НЭХД | АБ-терапия | НЭХД и АБ-терапия | ||||
| Пропанол | 0,163±0,042 | 0,45±0,02 | 0,29±0,009 *** | 0,34±0,015 ** | 0,228±0,007 *** | ||
| Изовалериановый альдегид | 0,285±0,012 | 0,77±0,016 | 0,52±0,014 *** | 0,49±0,018 *** | 0,415±0,005 *** | ||
| Ацетальдегид | 2,9±0,73 | 4,78±0,69 | 4,9±0,28 | 5,5±0,44 | 3,5±0,26 | ||
| Амиловый спирт | 0,42+0,063 | 0,94±0,019 | 0,65±0,021 *** | 0,76±0,032 ** | 0,51±0,011 *** | ||
| Этанол | 8,3±0,37 | 15,7±0,42 | 10,4±0,325 *** | 13,8±0,21 ** | 12,38±0,248 *** | ||
| Этаннитрил | 0,122±0,02 | 0,51±0,025 | 0,33±0,013 *** | 0,4±0,018 ** | 0,35±0,015 *** | ||
| Масляный альдегид | 0,081±0,009 | 0,16±0,006 | 0,096±0,01 *** | 0,11±0,017 ** | 0,108±0,004 *** | ||
| Ацетон | 12,1±3,4 | 999±157,5 | 487±27,37 * | 531±17,59 * | 37,2±3,4 *** | ||
| Уровень статистической значимости по отношению к группе без лечения
*p<0,05; ** p<0,01; *** p<0,001 | |||||||
При оценке полученных данных установлено, что при мочевом перитоните суточной давности имеет место значительное накопление в плазме крови токсических соединений промежуточного метаболизма. (таблица 11.10). В частности, уровень пропанола, изовалерианового альдегида, амилового спирта и масляного альдегида превышал контрольные показатели более, чем в 2-2,7 раза. Наиболее существенные сдвиги отмечены со стороны уровня ацетона, концентрация которого превысила норму более чем в 82 раза. Менее значительные отклонения установлены со стороны ацетальдегида и этанола. Их уровень превысил норму, соответственно, на 64 и 89 %.
Под влиянием антибактериальной терапии концентрация токсических соединений промежуточного метаболизма имела тенденцию к уменьшению. Наиболее отчетливо это прослеживалось со стороны изовалерианового альдегида (снижение в 1,55 раза), масляного альдегида (снижение в 1,45 раза), пропанола (снижение в 1,3 раза) и ацетона (снижение в 1,9 раза). Изменения концентрации в крови остальных соединений также уменьшалась, но менее существенно, за исключением ацетальдегида, уровень которого возрос на 12,5%. Антибактериальная терапия при мочевом перитоните способствует уменьшению уровня эндогенной интоксикации, по-видимому, за счет уменьшения воспалительного компонента, поддерживающего патологический процесс (рис.11.5).

Рис.11.5. Соотношение концентрации метаболитов при экспериментальном
мочевом перитоните и контрольного уровня метаболитов
Применение НЭХД было эффективнее антибактериальной терапии. Уровень токсических соединений промежуточного метаболизма снижался, но степень снижения была различна. Наиболее выраженное изменение отмечено со стороны пропанола (снижение на 14,7%), амилового спирта (снижение на 14,5%), этанола (снижение на 24,6%) и этаннитрила (снижение на 17,5%). Достоверной динамики со стороны остальных соединений не установлено.
Сочетанное применение антибактериальной терапии и НЭХД способствовало пролонгированию и усилению детоксикационного эффекта. При этом отмечалась избирательность их влияния на отдельные токсические соединения. Полученные данные дают основание считать, что сочетанное применение антибактериальной терапии и электрохимической детоксикации сопровождается синергизмом детоксикационного эффекта и является весьма благоприятным моментом.
Наиболее оптимальными возможностями, несомненно, обладает сочетанное применение нескольких методов, способных позитивно и синергично воздействовать на гомеостаз. В этих случаях эффективность от их применения, безусловно, будет наиболее значимой.
В ходе наших исследований проведено углублённое изучение эффективности интраоперационных мероприятий, методов детоксикации терапии в раннем послеоперационном периоде. Объектами изучения были применяемые во время первого оперативного вмешательства тотальная интестинальная декомпрессия и новокаиновая блокада брыжейки тонкой кишки (ББТК), как наиболее распространенные интраоперационные методы борьбы с парезом кишечника, а также применяемые в послеоперационном периоде методы эфферентной детоксикации: НЭХД, гипербарическая оксигенация, ВЛОК и дискретный плазмаферез (ПФ).
Таблица 11.11. Комбинации методов детоксикации у исследованных больных
| Комбинация методов детоксикации | Количество больных | Группа |
| 1. ГБО | 52 | Базовая схема |
| 2. НЭХД | 36 | Базовая схема |
| 3. НЭХД+ГБО | 23 | Расширенная схема |
| 4. ГБО+ВЛОК | 29 | Расширенная схема |
| 5. ГБО+ПФ | 9 | Расширенная схема |
| 6. НЭХД+ВЛОК | 4 | Расширенная схема |
| 7. НЭХД+ПФ | 4 | Расширенная схема |
| 8. НЭХД+ГБО+ВЛОК | 8 | Расширенная схема |
| 9. НЭХД+ГБО+ПФ | 6 | Расширенная схема |
Эфферентную детоксикацию начинали проводить в составе комплексного лечения с первых суток послеоперационного периода вплоть до нормализации общего состояния больного. В соответствии с результатами экспериментального исследования применялись две схемы детоксикационной терапии: в одном случае использовались ГБО или НЭХД как базовые методы детоксикации, в другом – применялась комбинированная детоксикация, в состав которой входили два или более метода: ГБО, НЭХД, ВЛОК или ПФ. Таким образом, базовый вариант детоксикационной терапии был осуществлен у 88 больных, комплексный – в 83 случаях перитонита. При проведении изучаемых методов лечения клинически значимых осложнений зафиксировано не было. Для оценки эффективности указанных лечебных мероприятий больные были распределены по группам таким образом, чтобы тяжесть состояния по шкале APACHE II в сравниваемых группах достоверно не различалась. Влияние той или иной схемы детоксикационной терапии была изучена в группах больных с наличием и отсутствием признаков полиорганной недостаточности. В качестве критериев эффективности проводимых лечебных мероприятий были выбраны параметры, подвергшиеся наибольшим изменениям. При этом каждый из этих показателей характеризовал нарушения в той или иной сфере гомеостаза (таблица 11.11).
Изменения со стороны центральной гемодинамики оценивались с помощью значений СДД, СДЛА, МОС и ОПСС; о клеточной реакции периферической крови свидетельствовали уровни ЛИИ и МФИ; степень эндогенной интоксикации определялась концентрацией СМ в плазме крови. Среднюю тяжесть больных в каждой группе определяли по шкале APACHE II, а уровень полиорганных расстройств - по системе LODS. При этом в каждой изучаемой группе больных оценивали наличие синдрома системной воспалительной реакции и уровень летальности.
В ходе исследования были выделены два принципиальных подхода к схеме детоксикации: в одном случае применялся один метод (ГБО или НЭХД), в другом – использовалась комбинация эфферентных методов детоксикации. Такой подход, в определенной степени, был продиктован данными экспериментального исследования, которые продемонстрировали наибольшую эффективность комбинированного лечения. В результате были сформированы две исследуемые группы пациентов: с базовой схемой детоксикации (применение в комплексном лечении ГБО или НЭХД) и расширенным спектром лечебных мероприятий (комбинированное назначение двух и более методов эфферентной детоксикации). Базовую группу составили 88, а расширенную – 83 больных (таблица 11.12).
Таблица 11.12. Летальность в зависимости от выбранной схемы лечения
| Изучаемая группа | Общая тяжесть, APACHE II | Летальность/количество больных (%) |
| Базовая схема детоксикации | 18,4±0,7 | 16/88 (18,2 %) |
| Расширенная схема детоксикации | 21,6±1,1 | 15/83 (18,1 %) |
| Общие показатели | 19,9±0,7 | 31/171 (18,1 %) |
Проведённая нами стратификация по баллу APACHE II не показала эффективности использованных схем детоксикации. Поэтому были сформированы подгруппы, разделённые по констатации синдрома полиорганной дисфункции (таблица 11.13).
Таблица 11.13
Влияние детоксикации на течение РП в зависимости от наличия СПОД
| Изучаемая группа | Подгруппа | Уровень органных расстройств, LODS | Летальность/количество больных (%) |
| Базовая схема детоксикации | Без СПОД | 5,4±0,2 | 10/71 (14,1 %) |
| СПОД | 9,6±0,6 | 6/17 (35,3 %) | |
| Расширенная схема детоксикации | Без СПОД | 5,7±0,3 | 9/59 (15,2 %) |
| СПОД | 9,8±0,5 | 6/24 (25,0 %) | |
| Общие показатели | Без СПОД | 5,6±0,1 | 19/130 (14,6 %) |
| СПОД | 9,7±0,2 | 12/41 (29,3 %) |
В каждой полученной подгруппе определялся интегральный уровень органных расстройств по шкале LODS и летальность, а также показатели центральной гемодинамики, периферической крови и эндогенной интоксикации до и после проведенного лечения. Исходные показатели определялись в первые сутки послеоперационного периода. Интервал между определением исходных и результирующих параметров гомеостаза составлял в среднем 3-суток. Качественную сторону сравнения показателей представлял t-критерий Стьюдента, количественную – процент изменения исходной величины сравниваемого параметра гомеостаза в каждой изучаемой подгруппе. Достоверность изменений частоты летальных исходов определялась с помощью критерия χ2 Пирсона.
В соответствии с полученными нами данными (таблицы 11.14, 11.15), уровень органных расстройств в подгруппах «без СПОД» достоверно не отличался друг от друга (p>0,05) и составлял 5,4-5,7 балла. В подгруппах «СПОД», с наличием синдрома полиорганной недостаточности, данный показатель также находился приблизительно на одном уровне, без достоверных отличий (9,6 - 9,8 балла). Таким образом, исходная тяжесть полиорганных нарушений была в исследованных подгруппах практически одинаковой, что давало право сравнивать в них процент летальных исходов и другие параметры гомеостаза с высокой степенью репрезентативности.
Таблица 11.14
Эффективность базовой схемы детоксикации у больных с РП без СПОД
| Сфера нарушений | Показатель | До лечения (n=71) | После лечения (n=71) | Изменение (%) |
| Центральная гемодинамика | СДД, мм.рт.ст. | 92,6±1,3* | 96,5±1,4* | 4,2 |
| СДЛА, мм.рт.ст. | 44,3±1,5* | 38,7±1,6* | 12,7 | |
| МОС, мл. | 5605,8±133,3 | 5576,3±163,4 | 0,5 | |
| ОПСС, дин×сек×см-5 | 1497,5±68,4 | 1595,2±78,1 | 6,5 | |
| Реакция периферической крови | ЛИИ, усл. ед. | 4,4±0,2* | 1,6±0,3* | 64,4 |
| МФИ, усл. ед. | 21,8±3,2* | 15,6±2,0* | 28,6 | |
| Органная диcфункция | LODS, баллы | 5,4±0,2* | 0,6±0,1* | 88,8 |
| Эндоинтоксикация | СМО, ед. опт. пл. | 0,527±0,028* | 0,462±0,031* | 12,3 |
| Уровень статистической достоверности * p<0,05 | ||||
При анализе исходов в данных подгруппах было установлено, что при отсутствии СПОД летальность во всех изучаемых подгруппах была примерно на одном уровне (p>0,05) и составляла 14,1% - 15,2%. При этом, минимальное значение показателя принадлежало базовому лечению, а максимальное - расширенному. Это свидетельствовало о практически одинаковой эффективности подходов при лечении перитонита в данную стадию заболевания.
При коррекции СПОД с помощью базовой схемы летальность значительно превышала таковую как при расширенной схеме лечения, так и в общей подгруппе больных, и составляла 35,3% (таблица 11.13). Расширенному варианту лечения принадлежал самый низкий в изучаемых подгруппах уровень летальности - 25%. Применение комбинированной детоксикации в третью стадию перитонита снижало летальность на 29% по сравнению с базовой схемой детоксикации и на 15% по сравнению с общей группой (p<0,05).
Таблица 11.15
Эффективность расширенной схемы детоксикации у больных с РП без СПОД
| Сфера нарушений | Показатель | До лечения n=59 | После лечения n=59 | Изменение, % |
| Центральная гемодинамика | СДД, мм.рт.ст. | 92,7±1,3* | 95,7±1,5* | 3,2 |
| СДЛА, мм.рт.ст. | 46,3±1,8 | 45,8±1,9 | 0,9 | |
| МОС, мл. | 5850,8±143,6* | 5132,5±164,3* | 12,3 | |
| ОПСС, дин×сек×см-5 | 1499,5±86,9* | 2077,8±98,6* | 38,6 | |
| Реакция периферической крови | ЛИИ, усл. ед. | 4,9±0,3* | 2,4±0,3* | 50,2 |
| МФИ, усл. ед. | 23,8±3,1 | 23,0±3,4 | 3,4 | |
| Органная диcфункция | LODS, баллы | 0,550±0,042* | 0,460±0,033* | 16,4 |
| Эндоинтоксикация | СМО, ед. опт. пл. | 5,7±0,3* | 0,3±0,1* | 94,7 |
| Уровень статистической достоверности * p<0,05 | ||||
Таким образом, при изучении исходов лечения при базовом и расширенном подходах детоксикационной терапии мы получили приблизительно одинаковые результаты лечения в первые две стадии перитонита и преимущество комплексного подхода в стадию полиорганных нарушений. В дальнейшем в ходе углублённого исследования проводилось сравнение результатов базовой и расширенной схем детоксикации. Так, в изучаемых подгруппах отчетливые изменения были прослежены со стороны показателей центральной гемодинамики, причем для каждого из вариантов лечения они были различны (таблицы 11.14,11.15).
В подгруппе, где нами проводилась базовая детоксикация у больных без проявления СПОД (таблица 11.14) достоверно повышалось среднее динамическое давление (на 4,2%), а среднее давление в легочной артерии снижалось (на 12,7%), что являлось, как показали предыдущие исследования, положительной тенденцией в течении перитонита. Уровни минутного объема сердца и общего периферического сопротивления сосудов, при этом не имели статистически значимых изменений. При расширении схемы детоксикации у той же категории больных изменения СДД характеризовались как достоверное повышение на 3,2%. Уровень СДЛА не претерпевал статистически значимых изменений. Со стороны МОС и ОПСС в этой подгруппе наблюдалась негативная тенденция, проявляющаяся достоверным снижением МОС на 12,3% при одновременном повышении ОПСС на 38,6% (p<0,05).
Таблица 11.16
Эффективность базовой схемы детоксикации у больных с РП и СПОД
| Сфера нарушений | Показатель | До лечения n=17 | После лечения n=17 | Изменение, % |
| Центральная гемодинамика | СДД, мм.рт.ст. | 88,7±2,0 | 89,5±2,3 | 0,9 |
| СДЛА, мм.рт.ст. | 48,7±1,8* | 39,1±2,1* | 19,8 | |
| МОС, мл. | 5469,9±247,3 | 5455,6±209,4 | 0,4 | |
| ОПСС, дин×сек×см-5 | 1593,4±97,2 | 1505,9±103,5 | 5,7 | |
| Реакция периферической крови | ЛИИ, усл. ед. | 6,2±0,3* | 5,3±0,4* | 14,7 |
| МФИ, усл. ед. | 24,1±3,4 | 23,3±3,6 | 3,4 | |
| Органная диcфункция | LODS, баллы | 0,694±0,048* | 0,544±0,055* | 21,6 |
| Эндоинтоксикация | СМО, ед. опт. пл. | 88,7±2,0 | 89,5±2,3 | 0,9 |
| Уровень статистической достоверности * p<0,05 | ||||
При применении базовой схемы детоксикации пациентам со СПОД уровень СДД достоверно не изменялся, но все же прослеживалась тенденция к нормализации данного показателя. СДЛА снижалось на 19,8%. Статистически значимых изменений со стороны МОС и ОПСС не было. В группе, где использовалась расширенная схема детоксикации, СДД здесь достоверно повышалось на 9,8%, СДЛА имело статистически недостоверную тенденцию к снижению, МОС достоверно уменьшался, а ОПСС возрастало на 38% (таблицы 11.16,11.17).
Таблица 11.17
Эффективность расширенной схемы детоксикации у больных с РП и СПОД
| Сфера нарушений | Показатель | До лечения n=24 | После лечения n=24 | Изменение, % |
| Центральная гемодинамика | СДД, мм.рт.ст. | 91,7±2,5* | 100,7±2,4* | 9,8 |
| СДЛА, мм.рт.ст. | 71,5±1,3 | 71,2±1,6 | 0,4 | |
| МОС, мл. | 5230,3±108,8* | 5010,8±102,6* | 4,2 | |
| ОПСС, дин×сек×см-5 | 1617,5±99,1* | 2231,4±127,3* | 38,0 | |
| Реакция периферической крови | ЛИИ, усл. ед. | 6,1±0,9* | 2,6±0,3* | 57,4 |
| МФИ, усл. ед. | 24,4±3,6* | 15,3±2,8* | 37,3 | |
| Органная диcфункция | LODS, баллы | 0,724±0,037* | 0,519±0,060* | 28,2 |
| Эндоинтоксикация | СМО, ед. опт. пл. | 9,8±0,5* | 2,4±0,2* | 75,5 |
| Уровень статистической достоверности * p<0,05 | ||||
Таким образом, со стороны показателей среднего динамического давления и среднего давления в легочной артерии во всех изученных подгруппах наблюдалась тенденция к нормализации, степень которой была максимальна в группе базового лечения. В группе расширенной детоксикации эти изменения носили менее выраженный характер. Вместе с тем при комбинированной детоксикационной терапии наблюдались негативные изменения со стороны МОС и ОПСС, что, по всей видимости, и нивелировало то положительное влияние, которое оказали данные методы детоксикации на СДД и СДЛА. Присутствие данных негативных сдвигов было коренным отличием этой группы от группы с базовой схемой детоксикации.
Со стороны клеточной реакции периферической крови во всех подгруппах наблюдалась отчетливая направленность к снижению микро-макрофагального индекса, что по результатам предшествующих исследований можно расценивать как положительную тенденцию. Выраженность органной дисфункции, определенная по системе LODS до и после проведения детоксикационных мероприятий свидетельствовала о значительном снижении тяжести полиорганных расстройств во всех исследованных подгруппах. При этом отмечена однозначная тенденция к нормализации высоких показателей LODS в подгруппах без наличия СПОД вне зависимости от применяемой схемы детоксикационной терапии (до 0,3 – 0,6 баллов). При наличии полиорганной дисфункции наибольшая степень нормализации данного показателя (на 75,5%) наблюдалась при комбинированной эфферентной детоксикации, где было отмечено снижение балла LODS с 9,8±0,5 до 2,4±0,2 баллов. Эффективность базовой схемы детоксикации была приблизительно в полтора раза ниже.
Что касается лейкоцитарного индекса интоксикации и концентрации в плазме крови средних молекул, то они, являясь непосредственными критериями элиминации токсических соединений из организма, а, следовательно, мерой эффективности проведенной эфферентной детоксикации, во всех подгруппах имели статистически достоверную тенденцию к снижению. При отсутствии полиорганной дисфункции изменение ЛИИ и СМ было приблизительно на одном уровне. При явлениях СПОД более выраженный детоксикационный эффект был отмечен у комбинированного лечения. Степень нормализации ЛИИ здесь была 57,4% (при базовой детоксикации – 14,7%), а концентрации средних молекул – 28,2% (при базовой детоксикации – 21,6%).
В итоге, существенное снижение уровня летальности в стадию полиорганных нарушений, связанное с применением комбинации методов эфферентной детоксикации, объяснялось более значительным уровнем элиминации токсических соединений и большей степенью нормализации полиорганных расстройств по сравнению с использованием ГБО или НЭХД в качестве «монометода» детоксикации в третьей стадии перитонита. Наличие полиорганных нарушений при перитоните, несомненно, должно служить показанием к применению расширенного спектра методов детоксикации.
На конференции, посвящённой диагностике и лечению сепсиса в Москве (2001) указывалось на недостаточность доказательств эффективности НЭХД, ВЛОК, отдельных видов плазмафереза, а также на преждевременность включения этих методов в протокол лечения больных с перитонитом и сепсисом. По нашим данным, эффект от применения этих методов существует, но степень их эффективности определяется стадиией заболевания и степенью исходных нарушений.
Глава XII
Дата добавления: 2018-02-15; просмотров: 507; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
