Влияние ЭС на показатели катехоламинов в плазме крови при перитоните
| Наименование катехоламинов | адреналин | норадреналин | дофамин | |||
| Норма | 0,15±0,03 | 0,28±0,04 | 0,1±0,03 | |||
| Стадии перитонита | Энтеральная недостаточность | без ЭС | n=18 | 0,09±0,01* | 0,17±0,02 | 0,04±0,01 |
| ЭС | n=12 | 0,13±0,01 | 0,22±0,02 | 0,06±0,01 | ||
| Полиорганная недостаточность | без ЭС | n=10 | 0,08±0,01 | 0,11±0,01* | 0,04±0,01* | |
| ЭС | n=10 | 0,10±0,01** | 0,16±0,02** | 0,07±0,01 | ||
| *различия достоверны, p<0,05 (без ЭС - ЭС); ** различия достоверны p<0,05 (норма - ЭС) | ||||||
Исходная повышенная симпатическая активность (рис.10.4) сердечно-сосудистой системы значительно уменьшалась при применении ЭС в стадии энтеральной недостаточности с сохраняющейся тенденцией к снижению при полиорганной дисфункции.
Энтеросорбция оказывала позитивное влияние на уровень в плазме крови катехоламинов (таблица 10.3), 11-оксикортикостероидов, обмен серотонина и гистамина. В частности, при ЭН наблюдалась нормализация катехоламинов, серотонина и гистамина. При полиорганной недостаточности ЭС способствует существенному повышению катехоламинов с нормализацией только уровня дофамина и значительному снижению уровня серотонина и гистамина. Содержание 11-оксикортикостероидовв плазме крови также достоверно снижается.
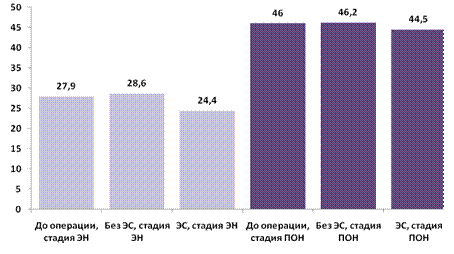
Рис.10.4. Влияние ЭС на вегетативный индекс при перитоните
Представленные данные свидетельствуют, что ЭС должна рассматриваться как обязательный компонент в комплексном лечении перитонита и паралитической кишечной непроходимости.
|
|
|
Методика проведения энтеросорбции однотипна: приготовленные навески энтеросорбентов, (для энтеродеза - 15 г, для полифепана 4 столовые ложки или 5 столовых ложек пасты) разводят в 100 мл воды или 0,9% раствора натрия хлорида и в объеме 200-250 мл вводиться через зонд в просвет кишки шприцем Жане или с помощью кружки Эсмарха, поднятой на высоту 1-1,5м. Возможно заранее приготовленную навеску сорбента развести в составе 400-800 мл изотонического солевого раствора и вводить фракционно. После введения энтеросорбента зонд пережимается на 30-60 минут, а затем открывается на свободный отток или подключается к электроотсосу, что способствует отхождению вместе с химусом образующих комплексов сорбент-токсин. В зависимости от тяжести состояния больного количество сеансов энтеросорбции может быть от 3 до 6 раз в сутки.
Если энтеросорбция применяется сразу после операции, то суточную дозу энтеросорбента разводят в диализирующей смеси и вводят в зонд по описанной методике для кишечного диализа. Аналогичные режимы введения сорбентов применяются при проведении энтеросорбции детоксикационными растворами.
Энтеральная оксигенация
Для улучшения метаболической функции слизистой оболочки тонкой кишки предлагается использовать оксигенированные растворы или чреззондовое введение кислорода [Тимофеев В. Н., 1987]. Целесообразность такого воздействия на слизистую оболочку кишки обусловлено двумя типами клеточного дыхания – апикального и базолатерального, а также тканевой гипоксией кишечника и печени при паралитической кишечной непроходимости, которая приводит к появлению ряда продуктов эндоинтоксикации [Robinson J., 1977]. Была доказана возможность утилизации клетками кислорода через апикальную поверхность энтероцитов в условиях гипоксии кишечной стенки [Уголев А.М., 1983]. Экспериментальные исследования на собаках показали, что после инсуффляции в просвет тонкой кишки 500 см3 кислорода в крови воротной и печеночной вен достоверно увеличивается его напряжение и уменьшается концентрация углекислоты [Усов Д. В., 1981]. В.А. Янков (1982) получил положительный клинический эффект после чреззондового промывания тонкой кишки у больных с кишечной непроходимостью и перитонитом оксигенированными растворами Рингера и Дарроу с добавлением к ним канамицина, прокаина, 10% раствора глюкозы, ионных растворов калия, натрия, хлора. Однако, автор не обнаружил повышения содержания кислорода в крови после проведения такой энтеральной оксигенации. В.Н. Тимофеев (1987) предложил использовать при лечении перитонита и кишечной непроходимости внутрикишечное введение 10% раствора глюкозы в соотношении 1/2 к солевому раствору, оксигенированному под давлением 5 атм. Проведенные автором экспериментальные исследования установили высокую лечебную эффективность раствора, которая подтверждалась улучшением биохимических показателей в виде усиления биоэнергетической активности клеток кишечной стенки.
|
|
|
|
|
|
В литературе имеются сообщения о включении в комплексное лечение перитонита оксигенированных кристаллоидных растворов [Ерюхин И.А., 1999; Белик Б.М., 2000; Чернов В.Н., 1999, 2000].
В нашей клинике имеется опыт лечения 112 больных, которым в послеоперационном периоде проводилась энтерооксигенация (ЭО). Использовался пенный зондовый способ внутрикишечной оксигенации. Пена готовилась на основе гидролизата казеина и яичного белка. Для приготовления одного литра такого кислородного коктейля использовали 200 мл гидролизата казеина и один яичный белок, или просто 300 мл гидролизата казеина.
Методика заключалась в следующем: в медицинский сосуд из-под белковых препаратов емкостью 500 мл с завинчивающейся металлической крышкой через резиновую пробку вводили две воздуховодные иглы. Одна длинная игла опускается до дна сосуда, другая – короткая (1-2 см из-под пробки). Через первую иглу по резиновой или силиконовой трубке поступает кислород из устройства для централизованной подачи кислорода. Образовавшаяся в результате этого пена выбрасывается по второй игле, также через трубку, сразу в шприц, который используется для кишечной оксигенации.
|
|
|
Кислородную пену можно приготовить с помощью обычного сифона для газированной воды, емкостью 1 литр. В данном случае в сифон наливается 200-250 мл вышеописанного раствора, оставшийся воздух в сифоне замещается кислородом при давлении 2,5-3,4 АТА. Для получения более стойкой кислородной эмульсии в сифон необходимо поместить 2-3 пластмассовых шарика и перед набором пены в шприц-сифон встряхнуть.
Оба способа достаточно просты, не требуют дорогостоящей аппаратуры, занимают немного времени и поэтому могут широко применяться.
При проведении ЭО необходимо соблюдать следующие правила:
Ø Кислородная пена должна готовиться сразу перед ЭО.
Ø Введение пены в желудочно-кишечный тракт лучше осуществлять шприцем Жане, что обеспечивает строгое дозирование.
Ø Можно проводить ЭО либо через назогастральный зонд, либо через интубационную трубку. Возможно сочетание этих способов.
Ø Перед ЭО необходимо произвести эвакуацию застойного желудочно-кишечного содержимого, а при необходимости и кишечный диализ.
Ø Сразу одномоментно в желудок или в кишечник вводится столько миллилитров пены, сколько было эвакуировано застойного содержимого. При отсутствии застойных явлений в желудке первая порция кислородной пены составляет 200 мл.
Ø В дальнейшем ЭО производится дробно: после первой порции кислородно-белковой пены последующее введение ее осуществляется через каждые 5-10 мин по 100-200 мл. Последнее зависит от субъективных ощущений больного.
Ø С учетом дробности введения, ЭО осуществляется в течение 40-60 минут в дозе 1000-1500 мл. Возможно выполнение процедуры 1-2 раза в день.
Ø При тотальной интубации тонкой или толстой кишки ЭО также проводится дробно, но порции по 200-300 мл и общее количество пены составляет до 2500 мл.
Ø Оптимальными параметрами проведения является введение 1000-1500 мл кислородной пены во время операции или в раннем послеоперационном периоде 1-2 раза в день. При тяжёлых формах кишечной непроходимости ЭО проводится в течение 3-7 дней после операции в дозах 1500-2000 мл кислородной пены 1-3 раза в день.
Ø Относительным противопоказанием для ЭО мы считаем наличие анастомоза желудочно-кишечного тракта при высоком риске его недостаточности или несостоятельности.
Ø Показанием для отмены энтерооксигенации служит полное восстановление моторики кишечника.
Специально проведенные исследования показали, что применение ЭО вызывает повышение активности в кишечной стенке дыхательных ферментов: цитохромоксидазы (ЦХО), сукцинатдегидрогеназы (СДГ); (рис.10.5). Это способствует улучшению утилизации клеткой кислорода, и в конечном итоге устранению или ослаблению гипоксии. Экспериментальные исследования показали восстановление кислородного режима печени и ее гликогенного резерва. Наиболее отчетливо это прослеживалось в течение 45 минут ЭО. Эти механизмы, по-видимому, являются определяющими в улучшении функционирования моторики желудочно-кишечного тракта.
По данным электроэнтерографии выявлено положительное влияние ЭО уже через 30 минут после начала сеанса (таблица 10.4).
Таким образом, данный метод лечения является достаточно эффективным и рекомендован для применения в хирургических клиниках по причине своей простоты и доступности.
В последние годы появились сообщения о целесообразности внутрикишечного применения при перитоните лекарственных препаратов и лечебных смесей различной патогенетической направленности [Эндер Л.А., 1991; Тарасов В.А., 1991; Луцевич Э.В., 1991;.Курыгин А.А., 1992; Лызиков А.Н., 1993; Буденко В.В, 1991; Игнатьев В.Г., 1994; Михальский В.В., 1997; Лебедев А.Г., 1998; Кабанов А.Н., 1993; Борлаков В.Р., 1999; Чернов В.Н., 2000; Химичев В.Г., 1997; Юсуфов С.Г., 1998; Белик Б.М., 2000; Родаков А.В., 2000; Есипов В.К., 2001; Байчоров Э.Х., 2001; K.Gnmdel K., 1996; Perry M. A., 1986; Smith S. M., 1987; Silk D.B.A., 1984; Seltzer M.H., 1984; Buzby С.P., 1984; Vansant G., 1993; Tetterro C.W.N., 1992].
С целью снижения эндогенной интоксикации при паралитической кишечной непроходимости и перитоните, возникающих вследствие гипоксии кишечной стенки, используют препараты, улучшающие микроциркуляцию (тренталтм, солкосерилтм, никотиновая кислота, реополиглюкинтм); антиоксиданты и антигипоксанты (диметилсульфоксид, токоферола ацетата, эмоксипинтм, дибунолтм, аллопуринолтм, беметилтм, эссенциалетм); препараты с цитопротективным эффектом (гепатосантм, триовиттм, глутаминовая кислота, нормазатм, рыбий жир); окислители (0,27-0,32% раствор перекиси водорода, гипохлорит натрия в концентрации 300-600 мг/л, марганцевокислый калий). Существуют инфузионные полифункциональные солевые растворы, содержащие антигипоксические вещества.

Рис.10.5. Влияние ЭО на активность СДГ и ЦХО в кишечной стенке
в первые сутки после операции по поводу перитонита
Все препараты входят в состав различных схем комплексного лечения кишечной непроходимости и перитонита. Ряд препаратов можно включать в состав диализирующих смесей или непосредственно использовать как солевой раствор для диализа или жидкий энтеросорбент, другие можно использовать после предварительного промывания кишки, третьи – после полноценного проведения кишечного диализа с последующей энтеросорбцией или энтерооксигенацией.
Таблица 10.4.
Показатели моторики тонкой кишки при перитоните
по данным электроэнтерографии
| Периоды исследования | Частота волн, /мин. | Вольтаж волн | ||
| перистальтические | тонические | перистальтические | тонические | |
| До проведения ЭО | 9,8± 0,2 | 0,63± 0,02 | 0,11± 0,003 | 0,16± 0,004 |
| Через 30 мин от начала проведения ЭО | 10,5 ±0,2 | 0,7± 0,02 | 0,12± 0,003 | 0,18± 0,004 |
| После проведения ЭО | 11,9 ±0,3 | 0,78± 0,03 | 0,13± 0,003 | 0,2± 0,005 |
| p (1,2) | <0,05 | <0,05 | <0,05 | <0,05 |
| p (1,3) | <0,001 | <0,015 | <0,001 | <0,001 |
| p (2,3) | <0,05 | <0,05 | <0,05 | <0,05 |
В ряде публикаций указывается о целесообразности комбинирования препаратов. В.Н.Чернов, Б.М.Белик (1996) в своей клинике используют следующую схему: фракционно через 1 час после сеанса энтеросорбции вводят гепатосантм в суточной дозе 2 капсулы (300 мг), триовиттм в суточной дозе 2 капсулы (300 мг), глутаминовую кислоту в суточной дозе 2 г, нормазетм в суточной дозе 30-60 мл, рыбий жир в суточной дозе 50-100 г. Указанные препараты (кроме рыбьего жира) вводят в просвет кишечника в виде однородных взвесей на изотоническом солевом растворе в объеме 400-800 мл. После их введения интестинальный зонд также пережимают на 30-40 минут. Лекарственные смеси вводят в просвет кишки 2 раза в стуки в течение 1-3 послеоперационных суток. У отдельных больных в связи с тяжестью кишечной непроходимости энтеральное введение лекарственных препаратов начинают уже во время операции, сразу после ликвидации кишечной непроходимости, после кишечного диализа и энтеросорбции.
И.А.Ерюхин и В.П.Петров (1999) предложили внутрикишечное введение аллопуринола и бемитила в растворе димексида после опорожнения кишки от содержимого, кишечного диализа или энтеросорбции. К концу первых послеоперационных суток фракционно в объеме 150-200 мл вводят 0,1% аллопуринолтм в 5% растворе димексидатм, а начиная со вторых суток - 1% раствор бемитилатм. В последующие дни введение препаратов осуществляется 3 раза в сутки. Перспективным направлением считается нутритивная поддержка (глава IX), однако оптимизация лечебных мероприятий в этом направлении требует дальнейших углублённых исследований.
Глава XI
Эфферентные методы детоксикации
Принципы активной детоксикации основываются на стимуляции или моделировании физиологических процессов: биологической трансформации, разведении и связывании, элиминации токсичных субстанций [Белокуров Ю.Н., Рыбачков В.В., 2000; Какаулин А.Г., 2002]. В связи с этим, все способы детоксикационной терапии можно разделить на две основные группы: методы, направленные на стимуляцию естественных путей детоксикации (за счет диуреза, легочной вентиляции, потоотделения, диареи); искусственная (эфферентная, направленная) детоксикация, которая проводится интракорпоральными и экстракорпоральными методами [Лобаков А.И., 1994].
Форсированный диурез
Среди методов, приводящих к увеличению скорости элиминации наибольшего эффекта можно ожидать от форсированного диуреза, основанного на одновременном или последовательном введении большого количества жидкости и электролитов для обеспечения стабильности водно-электролитного равновесия. Сильные диуретические препараты приводят к ускоренному выведению мочи и содержащихся в ней токсинов [Уманский М.А., 1979]. Проведение форсированного диуреза возможно лишь при полном сохранении функции почек и достаточно полноценной функции сердечно-сосудистой системы. Следует отметить, что введение больших доз кристаллоидов стало методов детоксикации только после применения сильных диуретических препаратов, как мочевина, маннитол, салуретики. Предпринимаются попытки усовершенствовать метод форсированного диуреза путём введения больших доз солевых растворов в период наиболее высокой концентрации диуретических препаратов в крови. Однако, при этом условии из организма выводятся в основном те токсические вещества, которые в данный момент циркулируют в крови.
Метод форсированного диуреза, даёт возможность усилить водный обмен не только в пределах внеклеточного пространства, но и интенсифицировать обмен воды между внутриклеточным и внеклеточным пространствами. При этом можно добиться усиленного выведения токсинов, фиксированных внутри клеток или на клеточных мембранах, что достигается благодаря использованию растворов с различными коллоидно-осмотическими свойствами [Уманский М.А., Пинчук Л.Б., 1977]. Считается, что при проведении форсированного диуреза с использованием осмотических диуретиков последние уменьшают резорбцию некоторых токсических веществ в дистальном отделе почечных канальцев. Это происходит из-за снижения концентрационного градиента между плазмой и мочой, так как из проксимального отдела поступает моча со значительно меньшей концентрацией экстрагируемого вещества; из-за увеличения объёмной скорости потока по канальцу и из-за уменьшения проницаемости стенки при изменении pH мочи в щелочную сторону (при ощелачивании плазмы). Скорость введения жидкости должна быть оптимальной и соответствовать максимально возможному диурезу: меньшая скорость может привести к относительному обезвоживанию, а большая – к водной перегрузке без увеличения диуреза. Периодическое исследование гематокрита может служить контролем водного баланса [Сухинин П.Л., 1970].
Метод форсированного диуреза может сочетаться с методом искусственной гемодилюции, причём некоторые авторы [Цой Г.В., 1976] предусматривают при её проведении обязательный этап форсированного диуреза для выведения избытка жидкости. Благоприятный эффект гемодилюции обусловлен улучшением реологических свойств крови, увеличением объёма циркулирующей плазмы, что предупреждает микротромбозы капилляров и предохраняет форменные элементы от повреждения, а также приводит к снижению концентрации токсических веществ. Адекватная гемодилюция разрывает патологические круги метаболических расстройств, поддерживающих эндогенную интоксикацию в случаях, когда она обусловлена выраженными циркуляторными нарушениями. Улучшение процессов микроциркуляции является фактором, способствующим более быстрому и полному контакту антибактериальных препаратов с микроорганизмами, фиксированными в капиллярной сети, межклеточном и внутриклеточном пространствах. Традиционные методы форсированного диуреза предусматривают введение на протяжении суток больших доз солевых растворов (7-10 литров) и получение соответствующего количества мочи.
Клинический вариант форсированного диуреза может быть следующим:
Ø Внутривенное введение 5% раствора глюкозы (13-15 мг/кг),
Ø Внутривенное введение физиологического раствора хлористого натрия (6-8 мл/кг),
Ø Внутривенное введение 3% раствора хлористого калия (1-1,5 мл/кг). Темп введения растворов – 80-100 капель в минуту.
Через 40-50 минут вводятся:
Ø Внутривенное введение полиглюкина – 200-400 мл или 10% раствор сывороточного альбумина – 200мл;
Ø Внутривенное введение 10% раствора хлористого натрия – 10-15мл,
Ø Внутривенное введение 20% раствора маннита в дозе 100-150мл.
Ещё через 50-60 минут:
Ø Внутривенное введение лазикстм в дозе 2-4мл,
Ø Внутривенное введение 2,4% раствора эуфиллинатм – 5-10мл.
На протяжении суток цикл дезинтоксикационно-трансфузионной терапии повторяют 2-3 раза в зависимости от состояния больного [Уманский М.А., 1979]. Мочевину вводят в виде 50% раствора на 10% растворе глюкозы из расчёта 1г/кг веса больного в течение 15-20 минут, маннитол - в виде 10%-ного раствора (общая доза 1,5-2 г/кг).
Ограничение эффективности форсированного диуреза связано с невозможностью удаления веществ, которые образовали комплексные соединения с белками плазмы, липидами, форменными элементами крови вследствие функции почечного фильтра. Не выводятся почками крупномолекулярные соединения, попадающие в кровь при разрушении клеточных белков. По мнению ряда авторов, применение в послеоперационном периоде лишь традиционного форсированного диуреза и гемодилюции без эфферентных методов недостаточно. На фоне явлений полиорганной дисфункции эти мероприятия не увеличивают выведение токсических агентов и могут привести к «вымыванию» депонированных в системе микроциркуляции токсинов и индуцировать эндотоксический шок [Ташев Х.Р., 2002].
Эфферентные методы детоксикации, обладающие по сравнению с естественными более мощным элиминационным эффектом, по механизму действия делятся на фильтрационные (гемодиализ, гемо- и ультрагемофильтрация), сорбционные (гемо-, лимфо-, плазмо-, энтеросорбция), окислительные (ГБО, НЭХД, ЭУФОК, ВЛОК) и обменные – непрерывный и дискретный плазмаферез [Лопаткин Н.А., 1989].
На сегодняшний день наибольшей эффективностью обладают фильтрационные методы. Так, гемодиализ полностью заменяет детоксикационную функцию почек, а с помощью метода ультрагемофильтрации путем подбора диализной мембраны можно добиться элиминации практически любого токсина без существенных гемодинамических и метаболических нарушений [Ватазин А.В., 1995]. Гемодиализ и гемофильтрация были рекомендованы на 4-й международной конференции по вопросам эктракорпорального очищения крови в Москве (2004) в качестве стандарта при лечении эндотоксикозов и полиорганной недостаточности. Однако фильтрационные методы имеют и ряд недостатков: необходимость постановки специальных катетеров для забора и возврата крови, специального обучения персонала, достаточного материально-технического обеспечения. Большинству отечественных клиник доступны менее дорогостоящие, но весьма эффективные средства детоксикации: НЭХД, плазмаферез, ВЛОК.
Дата добавления: 2018-02-15; просмотров: 549; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
