Константы диссоциации некоторых слабых кислот и оснований 9 страница
и вычислим рН3 = –lg[H+]3 = –lg(4,6×10-3) = 2,33.
Пример 14. Смешали 250 мл раствора с рН = 3 и 300 мл раствора гидроксида калия концентрацией 0,001 моль/л. Определить рН полученной смеси.
Решение. Обозначим объемы смешиваемых растворов V1 и V2 соответственно. Найдем число молей OH-:

Согласно уравнению диссоциации KOH ® K+ + OH-, 
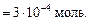
Найдем число молей H+:

Очевидно, что в избытке находятся гидроксил-ионы. Их остаточную концентрацию в полученном растворе найдем по уравнению

Вычислим
рН3 = 14 + lg[OH-]3 = 14 + lg(9,1×10-5) = 9,96.
Пример 15. Найти рН раствора борной кислоты с мольной долей 0,0025 (dр-р = 1,0 г/см3).
Решение. 1. выделим мысленно 1 кг раствора. Запишем
 ,
,
где индекс 1 относится к растворителю, т.е. к воде, а индекс 2 – к растворенному веществу, т.е. к H3BO3. Так как M1 = 18 г/моль, М2 = 61,8 г/моль и
 Þ
Þ  ,
,
то
 .
.
Вычислим

2. Так как плотность раствора 1 г/см3, то его объем соответствует 1 л, и молярная концентрация численно равна количеству вещества борной кислоты, т.е. СМ(Н3ВО3) = 0,138 моль/л.
3. Диссоциация борной кислоты по первой ступени протекает по реакции H3BO3 ® H+ + H2BO3-, для которой константа диссоциации Kd1 = 7,1×10-10. Второй и третьей ступенями диссоциации борной кислоты пренебрегаем.
4. В соответствии с уравнениями (4.17) и (4.13) вычислим

рН = –lg[H+] = –lg(9,9×10-6) = 5.
Пример 16. Сколько граммов бутиламина содержится в 1 л его раствора, имеющего рН = 11,5?
Решение. Гидрат бутиламина диссоциирует как основание по уравнению C4H9NH2×H2O Û C4H9NH3+ + OH-. Константа диссоциации Kd = 4,57×10-4, pKd = 3,340, гидроксильный показатель рОН = 14 – рН = 2,5.
По формуле (4.18) найдем молярную концентрацию бутиламина
lgC М = pKd – 2pOH = 3,34 – 2×2,5 = –1,66;
CМ = 10-1,66 = 0,022 моль/л.
Масса бутиламина, содержащаяся в 1 л раствора, Сг/л = CМ M, где М – молярная масса бутиламина 73 г/моль. Тогда Сг/л =0,022×73 = 1,6 г/л.
Задание IV. Определить pH предложенного раствора сильного электролита (табл.4.2).
Таблица 4.2
| Номер задачи | Электролит | Концентрация раствора | Плотность раствора, г/см3 |
| 215 | Сa(OH)2 | 0,07 % | 1,00 |
| 216 | Ba(OH)2 | 0,5 % | 1,003 |
| 217 | H2SO4 | 0,01 мол. % | 1,0 |
| 218 | Sr(OH)2 | 5×10-4 н. | 1,0 |
| 219 | HCl | 1,36 % | 1,005 |
| 220 | H2SO4 | 1,73 % | 1,012 |
| 221 | KOH | 0,577 % | 1,003 |
| 222 | H2SO4 | 5×10-4 М | 1,0 |
| 223 | KOH | 0,001 н. | 1,0 |
| 224 | HClO4 | 0,25 М | 1,013 |
| 225 | NaOH | 2,5×10-3 М | 1,0 |
| 226 | HCl | 1,0 % | 1,003 |
| 227 | HNO3 | 3 % | 1,01 |
| 228 | Ba(OH)2 | 5 % | 1,04 |
| 229 | HCl | 0,3 % | 1,0 |
| 230 | KOH | 5,8 г/л | 1,004 |
| 231 | H2SO4 | 0,05 г/л | 1,0 |
| 232 | KOH | 0,6 г/л | 1,0 |
| 233 | Ba(OH)2 | 0,1 М | 1,02 |
| 234 | H2SO4 | 0,1 н. | 1,0 |
| 235 | H2SO4 | 0,5 % | 1,0 |
| 236 | NaOH | 0,5 % | 1,0 |
| 237 | HCl | 0,01 н. | 1,0 |
| 238 | Сa(OH)2 | 0,02 н. | 1,0 |
| 239 | KOH | 4 г/л | 1,0 |
| 240 | NaOH | 5 г/л | 1,0 |
| 241 | H2SO4 | 0,005 М | 1,0 |
| 242 | HCl | 0,006 М | 1,0 |
| 243 | LiOH | 0,8 г/л | 1,0 |
| 244 | NaOH | 0,1 г/л | 1,0 |
| 245 | RbOH | 1 % | 1,0 |
| 246 | CsOH | 0,5 % | 1,0 |
| 247 | HCl | 0,02 мол. % | 1,0 |
| 248 | H2SO4 | 0,6 % | 1,003 |
| 249 | HNO3 | 0,7 мол. % | 1,0 |
| 250 | HClO4 | 0,08 мол. % | 1,0 |
| 251 | H2SO4 | 0,3 % | 1,001 |
| Окончание табл.4.2 | |||
| Номер задачи | Электролит | Концентрация раствора | Плотность раствора, г/см3 |
| 252 | HNO3 | 0,05 г/л | 1,0 |
| 253 | HNO3 | 0,6 г/л | 1,0 |
| 254 | H2SO4 | 0,03 н. | 1,0 |
| 255 | Сa(OH)2 | 0,03 % | 1,00 |
| 256 | Sr(OH)2 | 0,3 % | 1,001 |
| 257 | Ba(OH)2 | 0,05 г/л | 1,0 |
| 258 | HCl | 0,2 % | 1,0 |
| 259 | H2SO4 | 0,0012 М | 1,0 |
| 260 | HNO3 | 0,06 г/л | 1,0 |
| 261 | Ba(OH)2 | 0,1 г/л | 1,0 |
| 262 | Sr(OH)2 | 0,02 н. | 1,0 |
| 263 | Сa(OH)2 | 0,09 г/л | 1,0 |
| 264 | CsOH | 0,5 % | 1,002 |
Задание V. Определить pH следующих растворов.
265. Раствор гидроксида бария концентрацией 0,1 моль/л, если к 1 л этого раствора добавили 7,1 г гидроксида натрия.
266. Раствор серной кислоты концентрацией 0,1 моль/л, если к 1 л этого раствора добавили 7,1 г гидроксида бария.
267. Раствор после выщелачивания боксита по следующим данным: масса руды 1 т; ω(Al2O3∙Н2O) = 80 %; V(NaOH) = 3,1 м3; ω(NaOH) = 15 %.
268. 10-процентный раствор соляной кислоты (d = 1,047 г/мл) при условии, что к 20 л этого раствора прибавили 5 м3 воды, содержащей гидроксид кальция концентрацией 0,02 экв/л.
269. Раствор, содержащий 4 г KOH и 5 г NaOH в 1 л воды.
270. Раствор, содержащий 0,005 моль/л серной кислоты и 0,006 моль/л соляной кислоты.
271. Раствор после выщелачивания по реакции Li2O∙Al2O3∙4SiO2 + H2SO4 → Li2SO4 + Al2O3∙4SiO2∙H2O↓, если масса руды 1 т, w(Li2O∙Al2O3∙4SiO2) = 70 %; V(H2SO4) = 4 м3; w(H2SO4) = = 5 %, d = 1,032 г/мл.
272. Раствор после выщелачивания руды, если масса руды 1 т, в руде содержится 6 % Cu4(SO4)(OH)6; w(H2SO4) = 3 %, d = 1,03 г/мл, V(H2SO4) = 3 м3.
273. Раствор, полученный при разбавлении 20 л 10 % соляной кислоты (d = 1,047 г/мл) пятью кубометрами воды.
274. Рассчитать рН раствора азотнокислых стоков, если 10 л 5-процентной азотной кислоты сброшены в резервуар емкостью 5 м3.
275. Раствор соляной кислоты, если к 100 мл этого раствора, содержащего 5 мг HCl, прибавили 5 мг нитрата свинца (II).
276. Раствор объемом 10 м3, содержащий по 50 г серной и дихромовой кислот.
277. Щелочные стоки объемом 5 л, содержащие 2 мэкв щелочи.
278. Раствор дихромовой кислоты, если в нем содержится 2 мг/мл Cr (VI).
Задание VI. Определить pH и степень диссоциации предложенного раствора слабого электролита при температуре 25 °С (табл.4.3.)
Таблица 4.3
| Номер задачи | Электролит | Концентрация раствора | Плотность раствора, г/см3 |
| 279 | NH4OH | 2 % | 0,989 |
| 280 | CH3COOH | 0,12 % | 1,0 |
| 281 | HCOOH | 4,5 % | 1,01 |
| 282 | CH3COOH | 2 % | 1,001 |
| 283 | NH4OH | 2,35 % | 0,988 |
| 284 | C6H5NH3OH | 93,02 г/л | - |
| 285 | N2H5OH | 5 % | 1,01 |
| 286 | C6H5OH | 5 % | 1,02 |
| 287 | HCOOH | 0,5 % | - |
| 288 | CH3COOH | 0,65 % | - |
| 289 | HNO2 | 0,8 % | - |
| 290 | HCN | 2,7 % | 1,01 |
| 291 | C6H5OH | 9,4 г/л | - |
| 292 | NH4OH | 0,1 % | - |
| 293 | HCN | 8 % | 1,04 |
| 294 | HCOOH | 2,3 % | 1,005 |
| 295 | CH3COOH | 1 % | - |
Окончание табл.4.3
| Номер задачи | Электролит | Концентрация раствора | Плотность раствора, г/см3 |
| 296 | NH4OH | 0,34 % | 1,0 |
| 297 | HCOOH | 3 % | 1,007 |
| 298 | H2S | 0,32 н. | - |
| 299 | NH4OH | 0,5 % | 1,0 |
| 300 | H3PO4 | 1 % | 1,005 |
| 301 | C9H7NHOH | 3 г/л | - |
| 302 | Лимонная кислота | 120 г/л | - |
| 303 | Бензойная кислота | 2 % | 1,003 |
| 304 | N2H5OH | 0,5 % | - |
| 305 | HCOOH | 4 % | 1,01 |
| 306 | C6H5NH3OH | 0,56 г/л | - |
| 307 | CH3NH3OH | 24,5 г/л | - |
| 308 | C3H7NH3OH | 23,1 г/л | - |
| 309 | C4H9NH3OH | 13,65 г/л | - |
| 310 | C5H5NHOH | 1 г/л | - |
| 311 | C2H5NH3OH | 0,5 г/л | - |
| 312 | HNO2 | 2 % | 1,01 |
| 313 | Винная кислота | 1 % | 1,02 |
| 314 | H3BO3 | 5 % | 1,03 |
| 315 | HBrO | 0,1 % | 1,0 |
| 316 | H3BO3 | 10 % | 1,04 |
| 317 | C6H5OH | 6,5 г/л | - |
| 318 | H2S | 10 г/л | - |
| 319 | H2CO3 | 8 % | 1,05 |
| 320 | HF | 6 % | 1,03 |
| 321 | C6H5СН2NH3OH | 5 г/л | - |
| 322 | NH2OH×H2O | 6,2 г/л | - |
| 323 | H3BO3 | 1,5 % | 1,01 |
| 324 | (CH3)2NH2OH | 2 г/л | - |
| 325 | (C2H5)2NH2OH | 2,8 г/л | - |
| 326 | (CH3)3NНOH | 3 г/л | - |
| 327 | C2H5ОNH3OH | 1,6 г/л | - |
| 328 | CS(NH2)2×H2O | 20 г/л | - |
Задание VII. По заданному значению pH (табл.4.4) определить концентрацию предложенного раствора электролита при температуре 25 °С и выразить ее всеми возможными способами (считать, что плотность растворов 1 г/см3).
Таблица 4.4
| Номер задачи | Электролит | рН | Номер задачи | Электролит | рН |
| 329 | Сa(OH)2 | 11,0 | 354 | HClO4 | 2,35 |
| 330 | Сa(OH)2 | 11,8 | 355 | Ba(OH)2 | 13,8 |
| 331 | Ba(OH)2 | 12,8 | 356 | H2SO4 | 1,2 |
| 332 | KOH | 13,1 | 357 | HCl | 1,28 |
| 333 | H2SO4 | 1,95 | 358 | HNO3 | 3,1 |
| 334 | NaOH | 12,0 | 359 | KOH | 13,6 |
| 335 | Sr(OH)2 | 10,7 | 360 | HNO3 | 2,03 |
| 336 | H2SO4 | 2,2 | 361 | H2SO4 | 3,2 |
| 337 | HCl | 1,2 | 362 | H2SO4 | 1,5 |
| 338 | HCl | 2,8 | 363 | KOH | 12,03 |
| 339 | H2SO4 | 1,4 | 364 | Сa(OH)2 | 10,9 |
| 340 | LiOH | 12,5 | 365 | Ba(OH)2 | 13,3 |
| 341 | KOH | 13,0 | 366 | Sr(OH)2 | 10,7 |
| 342 | NaOH | 11,4 | 367 | H2SO4 | 1,9 |
| 343 | H2SO4 | 3,0 | 368 | Ba(OH)2 | 11,8 |
| 344 | RbOH | 13,0 | 369 | H2SO4 | 1,49 |
| 345 | KOH | 11,2 | 370 | HCl | 3,26 |
| 346 | CsOH | 12,5 | 371 | NaOH | 12,1 |
| 347 | HClO4 | 1,6 | 372 | H2SO4 | 2,6 |
| 348 | HCl | 1,95 | 373 | HCl | 2,3 |
| 349 | NaOH | 11,5 | 374 | HNO3 | 3,03 |
| 350 | H2SO4 | 1,91 | 375 | Сa(OH)2 | 11,4 |
| 351 | HCl | 1,56 | 376 | Ba(OH)2 | 11,1 |
| 352 | HNO3 | 1,41 | 377 | CsOH | 11,8 |
| 353 | HNO3 | 1,32 | 378 | Sr(OH)2 | 12,3 |
Дата добавления: 2020-12-12; просмотров: 155; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
