Константы диссоциации некоторых слабых кислот и оснований 8 страница
полученное значение i > 1 указывает на наличие диссоциации NaOH. Кажущаяся степень диссоциации

Задание III. Решить задачи.
157. Определить осмотическое давление раствора, содержащего 30 г глицерина в 120 г воды, если плотность этого раствора близка к единице, а температура 27 °С.
158. Определить осмотическое давление раствора хлорида натрия в воде концентрацией 5 %, если плотность раствора 1,04 г/см3, температура 17 °С. Кажущаяся степень диссоциации 95 %.
159. К 100 мл 0,5 М водного раствора сахарозы С12Н22О11 добавлено 300 мл воды. Чему равно осмотическое давление полученного раствора при 25 °С?
160. При 293 K давление насыщенного пара над водой равно 2,34 кПа. Сколько граммов глицерина С3Н5(ОН)3 надо растворить в 180 г воды, чтобы понизить давление пара на 133,3 Па?
161. При растворении 13 г неэлектролита в 400 г диэтилового эфира (С2Н5)2О температура кипения раствора повысилась на 0,453 K. Определить молярную массу растворенного вещества.
162. В 60 г бензола растворено 2,09 г некоторого вещества, содержащего 50,69 % С, 4,23 % Н, 45,08 % О. Установить молекулярную формулу вещества. Чистый бензол кристаллизуется при 5,5 °С.
163. Температура кипения водного раствора сахарозы С12Н22О11 101,4°С. Вычислить молярную концентрацию и массовую долю сахарозы в растворе. При какой температуре этот раствор замерзает?
164. Определить осмотическое давление раствора хлорида бария в воде, если его концентрация 5 %, плотность 1,08 г/см3, температура 7 °С, кажущаяся степень диссоциации 97 %.
165. Определить кажущуюся степень диссоциации хлорида калия в его 0,1 н. водном растворе, если при температуре 27 °С осмотическое давление раствора 4,72×105 Па.
166. Осмотическое давление гипертонического раствора (водный раствор хлорида натрия концентрацией 10 %) при температуре 20 °С составляет 84×105 Па. Найти кажущуюся степень диссоциации соли в этом растворе, если его плотность 1,1 г/см3.
167. Установить концентрацию раствора сульфата натрия в воде и выразить ее всеми способами, если известно, что осмотическое давление раствора при температуре 15 °С составляет 32,5×105 Па, кажущаяся степень диссоциации 91 %.
168. Водный раствор соли хрома (III) имеет осмотическое давление 18,1×105 Па, плотность раствора 1,06 г/см3. Определить концентрацию раствора и выразить ее всеми способами, если соль диссоциирована нацело.
169. Сколько граммов хлорида кальция надо растворить в 1 л воды, чтобы полученный раствор при температуре 27 °С имел осмотическое давление 23,7×105 Па? Кажущаяся степень диссоциации 95 %.
170. Сколько граммов сульфата меди (II) надо растворить в 100 мл воды, чтобы при температуре 7 °С полученный раствор имел осмотическое давление 16×105 Па? Кажущаяся степень диссоциации 87 %.
171. Определить концентрацию хлорид-ионов в растворе хлорида ртути (II), если при температуре 17 °С и концентрации раствора 0,1 моль/л его осмотическое давление 2,62×105 Па.
172. Раствор роданида железа (III) в воде с концентрацией 0,5 моль/л при температуре 27 °С имеет осмотическое давление 15,5×105 Па. Определить концентрацию роданид-ионов в данном растворе.
173. Найти давление паров воды над раствором хлорида натрия концентрацией 5 %, если температура раствора 20 °С, кажущаяся степень диссоциации 98 %,  =2,3×105 Па.
=2,3×105 Па.
174. Определить молярную концентрацию раствора карбамида, если при температуре 35 °С давление паров воды над раствором оказалось на 2 % ниже, чем над индивидуальной водой (  =5,55×105 Па). Карбамид в водных растворах не диссоциирует.
=5,55×105 Па). Карбамид в водных растворах не диссоциирует.
175. Вычислить кажущуюся степень диссоциации сульфата калия в его водном растворе концентрацией 3 %, если относительное понижение давления паров воды над раствором составляет 9,23×10-3Па.
176. Рассчитать давление паров воды над 0,5-процентным раствором хлорида бария при 15 °С, если кажущаяся степень диссоциации 96 %, 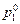 = 1,683×105 Па.
= 1,683×105 Па.
177. Определить концентрацию сульфата цинка в водном растворе, если относительное понижение давления пара над этим раствором 0,1 %, и соль диссоциирована нацело.
178. Какова концентрация хлорида алюминия в растворе, если относительное понижение давления пара над раствором 0,16 %, степень диссоциации соли 100 %?
179. Осмотическое давление раствора хлорида натрия при температуре 20 °С составляет 8,4×105 па. Определить давление паров воды над этим раствором, если плотность раствора 1,05 г/см3, кажущаяся степень диссоциации соли 92 %,  =2,31×103 Па.
=2,31×103 Па.
180. Раствор хлорида калия в воде имеет осмотическое давление 9,44×105 Па. Определить давление паров воды над этим раствором, если его температура 27 °С, плотность раствора 1,07 г/см3, кажущаяся степень диссоциации соли 92 %,  =3,5×105Па.
=3,5×105Па.
181. Определить давление паров воды над раствором глицерина С3Н5(ОН)3, если в 100 г воды растворено 20 г глицерина, плотность раствора 1,1 г/см3, 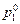 =1,95×105 Па.
=1,95×105 Па.
182. Определить концентрацию раствора сульфата натрия в воде, если при температуре 22 °С давление паров воды над этим раствором 2,61×103 Па, кажущаяся степень диссоциации 95,7 %,  =2,62×103 Па.
=2,62×103 Па.
183. При какой температуре закипит водный раствор хлорида меди (II) концентрацией 2 %, если кажущаяся степень диссоциации 97 %?
184. Найти температуру кипения раствора сульфата натрия в воде, если при 27 °С раствор этой соли имеет осмотическое давление 7,16×105 Па, плотность 1,06 г/см3. Кажущаяся степень диссоциации 96 %.
185. Какой должна быть концентрация раствора хлорида цинка в воде, чтобы этот раствор закипал при температуре 100,52 °С? Соль диссоциирована на 100 %. Выразить концентрацию раствора (плотность 1,04 г/см3) всеми способами.
186. Определить кажущуюся степень диссоциации нитрата натрия, если этот раствор кипит при температуре 100,1 °С, а в 100 г воды растворено 0,85 г соли.
187. Раствор хлорида алюминия в воде концентрацией 0,2 моль/кг кипит при температуре 100,406 °С. Найти осмотическое давление этого раствора при температуре кипения, если его плотность 1,06 г/см3.
188. В 100 г воды содержится 0,58 г хлорида натрия. При какой температуре закипит этот раствор, если кажущаяся степень диссоциации 96 %?
189. Какова кажущаяся степень диссоциации бромида калия в растворе концентрацией 2 %, если он закипает при 100,17 °С.
190. Определить эбуллиоскопическую постоянную этилового спирта, если известно, что раствор, содержащий 0,506 г йодноватой кислоты и 31,8 г этанола, кипит при температуре 78,464 °С. В данных условиях кислота диссоциирована на 32,6 %, а температура кипения чистого этанола 78,3 °С.
191. Вычислить относительное понижение давления водяного пара над раствором хлорида кобальта (II), если при кажущейся степени диссоциации 93 % раствор кипит при температуре 100,30 °С.
192. Определить, сколько граммов глицерина надо добавить к 100 г воды, чтобы получившийся раствор не замерзал до температуры –3,2 °С.
193. При какой температуре начнется кристаллизация воды из раствора хлорида калия концентрацией 3 %, если кажущаяся степень диссоциации 89 %?
194. Определить кажущуюся степень диссоциации сульфата магния в его 0,1 н. растворе плотностью 1,02 г/см3, если этот раствор начинает кристаллизоваться при температуре –0,153 °С.
195. При какой температуре начнет кристаллизоваться раствор сульфата железа (II) концентрацией 2 %, если его температура кипения 100,136 °С?
196. При какой температуре закипит раствор глицерина в воде, если он кристаллизуется при температуре –1,5 °С?
197. Кажущаяся степень диссоциации некоторой соли, диссоциирующей на три иона, составляет 97 %. Определить, при какой температуре начнет кристаллизоваться раствор этой соли в воде, если он закипает при температуре 100,2 °С.
198. Относительное понижение давления паров воды над раствором сульфата калия концентрацией 3 % составляет 9,23×10-3. Определить, при какой температуре начнется кристаллизация воды из этого раствора.
199. Раствор хлорида калия в воде концентрацией 0,8 % и плотностью 1,02 г/см3 при температуре 27 °С имеет осмотическое давление 5,13×105 Па. Определить, при какой температуре начнется кристаллизация этого раствора.
200. Температура кристаллизации бензола +5,5 °С, а раствора, содержащего 0,2242 г камфары в 30,55 г бензола, +5,254 °С. Определить молярную массу камфары, если константа кристаллизации бензола 5,16 K×кг/моль.
201. Раствор некоторого органического вещества в этиловом спирте закипает при температуре 78,41 °С. Определить его молярную массу, если для приготовления раствора было взято 2 г этого вещества, 48 г этилового спирта, температура кипения которого 78,3 °С, Kэб = 1,19 К×кг/моль.
202. Сколько граммов хлористого натрия надо добавить к 100 г воды, чтобы получившийся раствор не замерзал до температуры –1,8 °С? Считать, что соль диссоциировала на 100 %.
203. Сколько сахара С12Н22О11 надо растворить в 200 г воды, чтобы полученный раствор кипел при температуре 100,3 °С?
204. Сколько граммов хлорида бария, диссоциирующего нацело, надо растворить в 1 л воды, чтобы получившийся раствор замерзал при температуре –3,2 °С?
205. Осмотическое давление раствора глицерина в воде при температуре 7 °С составляет 5,3×105 Па. Определить при какой температуре закипит этот раствор, если его плотность 1,02 г/см3.
206. Определить степень диссоциации бензойной кислоты С6Н5СООН, если раствор ее в бензоле кристаллизуется при температуре 5,32 °С. Температура кристаллизации индивидуального бензола 5,5 °С, Kкр = 5,16 К×кг/моль, а для приготовления раствора взято 62,5 г бензола и 0,26 г бензойной кислоты.
207. Определить молярную массу бензойной кислоты, если известно, что ее раствор в бензоле кристаллизуется при температуре 5,18 °С. Для бензола Ткрист = 5,5 °С, Kкр = 5,16 К×кг×моль, а для приготовления раствора взято 100 г бензола и 0,757 г бензойной кислоты. Считать, что в растворе кислота практически не диссоциирована.
208. При какой температуре закипит раствор иодида калия в воде, если для его приготовления взято 300 мл воды и 1,33 г соли, кажущаяся степень диссоциации 98 %?
209. Относительное понижение давления паров воды над раствором некоторой соли составляет 1 %. Определить, при какой температуре закипит этот раствор.
210. Относительное понижение давления паров над раствором некоторого сильного электролита в воде составляет 1,5 %. Определить, при какой температуре начнется кристаллизация этого раствора.
211. Раствор, в 100 мл которого находится 2,3 г вещества, обладает при 298 К осмотическим давлением, равным 618,5 кПа. Определить молярную массу вещества.
212. В 1 мл раствора содержится 1018 молекул растворенного неэлектролита. Вычислить осмотическое давление раствора при 298 К.
213. В каком отношении должны находиться массы воды и этилового спирта, чтобы при их смешении получить раствор, замерзающий при -20 °С?
214. При 25 °С осмотическое давление некоторого водного раствора 1,24 МПа. Вычислить осмотическое давление раствора при 0 °С.
4.3. Водородный показатель
Для характеристики кислотно-основных свойств растворов используют водородный показатель рН, равный отрицательному значению десятичного логарифма концентрации ионов водорода. Аналогично рассчитывают гидроксильный показатель рОН, равный отрицательному значению десятичного логарифма концентрации ионов гидроксила:
 . (4.13)
. (4.13)
Концентрации ионов водорода и гидроксила связаны между собой равновесием диссоциации воды:
Н2О Û Н+ + ОН-.
Константу равновесия называют ионным произведением воды. При 298 К константа равновесия
 .
.
Прологарифмировав это уравнение, получим
рН + рОН = 14.
В чистой воде (нейтральная среда) рН = рОН = 7. В кислой среде рН < 7, в щелочной среде рН > 7.
Расчет рН в растворах сильных кислот и оснований. Для сильных кислот и щелочей, полностью диссоциированных на ионы,
[Н+] = zCк и [ОН-] = zCщ,
где Ск и Сщ - моляльные концентрации кислоты и щелочи соответственно; z - основность кислоты или кислотность основания.
Разбавление раствора сильного электролита учитывают в кислой и щелочной среде соответственно по уравнениям
рН2 = рН1 + lgn,
рН2 = рН1 – lgn,
где индекс 1 относится к исходному раствору (до разбавления), индекс 2 – к конечному раствору (после разбавления).
В среде, близкой к нейтральной, необходимо принять во внимание диссоциацию воды, в результате которой образуются ионы Н+иОН-.
 (4.14)
(4.14)
 .
.
При смешивании растворов сильных кислот и оснований возможны два варианта:
· если смешивают два кислых или два щелочных раствора, т.е. рН1 < 7 и рН2 < 7 или рН2 > 7ирН2 > 7, то
 ; (4.15)
; (4.15)
 .
.
· если смешивают кислый и щелочной растворы, т.е. рН1 < 7 и рН2 > 7, то конечную концентрацию раствора рассчитывают по веществу, взятому в избытке. При избытке кислоты

при избытке щелочи
 .
.
Расчет рН в растворах слабых кислот и оснований. Диссоциация многих электролитов протекает не полностью. Отношение числа диссоциированных молей к общему числу молей электролита в растворе называют степенью диссоциации. Для его количественного описания используют константу равновесия, называемую константой диссоциации. Для одноосновной кислоты, диссоциирующей по уравнению, НАn Û Н+ + Аn-, где Аn – кислотный остаток, константа диссоциации
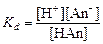 . (4.16)
. (4.16)
Так как [An–] = [H+] и [НAn] = C, то
 ;
;
(4.17)
 ,
,
где С – концентрация слабой кислоты, моль/л.
Для растворов слабых оснований
 , (4.18)
, (4.18)
где С – концентрация слабого основания, моль/л.
По значению константы диссоциации можно рассчитать степень диссоциации слабого электролита:
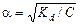 .
.
Многоосновные кислоты диссоциируют ступенчато, например: Н2S Û НS- + Н+ (1-я ступень); НS- Û S2- + Н+ (2-я ступень).
При расчетах рН обычно учитывают только первую ступень диссоциации, пренебрегая второй и третьей ступенями. Таким образом, уравнения (4.16) и (4.18) справедливы и для многоосновных кислот при использовании первой константы диссоциации Kd1.
Константы диссоциации некоторых слабых кислот и оснований даны в прил.1.
Пример 10. Вычислить рН раствора серной кислоты концентрацией 0,3 % (d = 1,0 г/см3).
Решение. 1. Перейдем к моляльной концентрации серной кислоты. Для этого выделим мысленно 100 г раствора, тогда масса серной кислоты составит 0,3 г, а масса воды – 99,7 г. По уравнению (4.4) вычислим моляльную концентрацию:
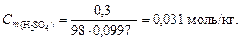
2. Согласно уравнению диссоциации H2SO4 ® 2H+ + SO42-, из 1 моль серной кислоты образуется 2 моль H+, следовательно, 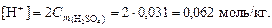
3. По уравнению (4.13) вычислим рН = –lg[H+] = –lg0,062 = = 1,21.
Пример 11. Вычислить рН раствора гидроксида бария концентрацией 0,0068 экв/л.
Решение. 1. По уравнению диссоциации Ba(OH)2 ® Ba2+ + + 2 OH- из 1 моль гидроксида бария образуется 2 моль гидроксил-ионов:
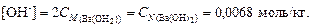
2. По уравнению (4.13) найдем рOН = –lg[OH-] = –lg0,0068 = = 2,17 и вычислим рН = 14 - рОН = 14 – 2,17 = 11,83.
Пример 12. Определить рН, если раствор одноосновной кислоты с рН = 5,5 разбавлен в 100 раз.
Решение. По уравнению (4.14) найдем концентрацию ионов водорода в конечном растворе

и вычислим
рН2 = –lg[H+]2 = –lg1,15×10-7 = 6,9.
Пример 13. Определить значение рН при смешении 10 л раствора с рН1 = 2 и 17 л раствора с рН2 = 4.
Решение. По уравнению (4.15) найдем концентрацию ионов водорода в конечном растворе

Дата добавления: 2020-12-12; просмотров: 327; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
