Константы диссоциации некоторых слабых кислот и оснований 6 страница
· Массовая доля или процентное содержание – соотношение масс растворенного вещества mв и раствора mр-р, выраженное в долях или процентах:
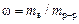 . (4.1)
. (4.1)
· Концентрация, выраженная в граммах на литр, показывает, какая масса растворенного вещества mв, выраженная в граммах, содержится в единице объема раствора Vр-р:
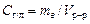 (4.2)
(4.2)
· Молярная концентрация, или молярность, – число молей растворенного вещества nв в 1 дм3 (1 л) раствора:
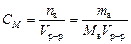 . (4.3)
. (4.3)
· Моляльная концентрация, или моляльность, – число молей растворенного вещества, приходящееся на 1 кг растворителя:
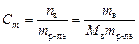 . (4.4)
. (4.4)
· Мольная доля или мольные проценты – число молей компонента (растворителя или растворенного вещества), содержащееся в одном моле раствора:
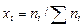 . (4.5)
. (4.5)
· Нормальная концентрация, или нормальность, – количество эквивалентов nэв растворенного вещества, содержащееся в 1 л раствора:
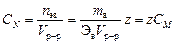 , (4.6)
, (4.6)
где z – количество обменных эквивалентов растворенного вещества, содержащееся в 1 моль вещества.
Для кислот z соответствует основности кислоты, т.е. числу атомов водорода в составе кислоты, обмениваемых в данной реакции на металл или нейтрализуемых основанием.
Для оснований z соответствует кислотности основания, т.е. числу гидроксильных групп в составе основания, обмениваемых на кислотный остаток или нейтрализуемых кислотой.
|
|
|
Для солей z рассчитывают как произведение числа атомов и степени окисления металла в составе соли.
Для окислителей и восстановителей в окислительно-восстановительных реакциях z – изменение их степени окисления в ходе реакции.
Пример 1.Раствор серной кислоты в воде с концентрацией 16 % (по массе) имеет плотность d = 1,109 г/см3. Выразить концентрацию этого раствора всеми возможными способами.
Решение. 1. Выделим мысленно 1 кг раствора и установим его объем:
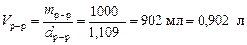 .
.
2. Определим массу растворенного вещества (H2SO4) по формуле (4.1):
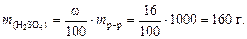
3. По формуле (4.2) рассчитаем концентрацию раствора серной кислоты
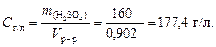
4. Найдем число молей серной кислоты:
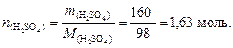
5. По формуле (4.3) вычислим молярную концентрацию раствора серной кислоты:
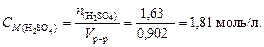
6. Найдем массу растворителя (Н2О):
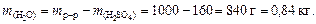
7. По формуле (4.4) вычислим моляльную концентрацию раствора серной кислоты:
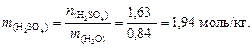
8. Найдем число молей воды:
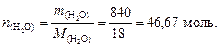
9. По формуле (4.5) вычислим мольную долю серной кислоты:
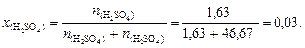
10. По формуле (4.6) определим нормальную концентрацию раствора серной кислоты (для серной кислоты количество обменных эквивалентов в 1 моль вещества z = 2):
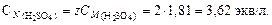
Пример 2. Какой объем раствора серной кислоты концентрацией 10 % (d = 1,066 г/см3) требуется для приготовления 200 мл 1 н. раствора?
|
|
|
Решение. 1. найдем массу серной кислоты, содержащейся в 200 мл 1 н. раствора. Для этого вычислим молярную концентрацию раствора по формуле (4.3): 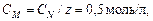 а также количество вещества серной кислоты
а также количество вещества серной кислоты 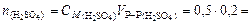
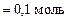 и ее массу
и ее массу 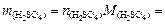
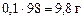 .
.
2. Подставим найденную массу серной кислоты в уравнение (4.1) и вычислим объем 10-процентного раствора:
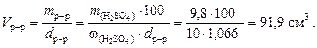
Пример 3. Какой объем воды следует добавить к 500 мл раствора, содержащего 40 г сульфата никеля, чтобы понизить его концентрацию до 0,05 моль/л?
Решение. По уравнению (4.3) вычислим объем 0,05 М раствора:
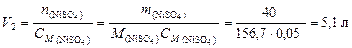
и объем воды:
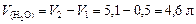 .
.
Пример 4. Найти молярную концентрацию раствора карбоната натрия, полученную при смешивании 600 мл 2,15-процентного раствора (d = 1,02 /см3) и 200 мл 8,82-процентного раствора (d = 1,09 г/см3).
Решение. Количество вещества карбоната натрия в каждом из смешиваемых растворов соответственно
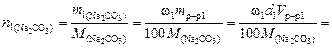
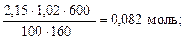
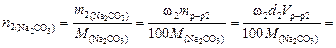
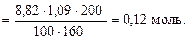
Молярная концентрация полученного раствора
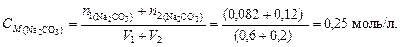
Пример 5. Какой объем раствора серной кислоты концентрацией 0,42 моль/л потребуется для нейтрализации 20 мл раствора гидроксида калия концентрацией 6 % (d = 1,053 г/см3)?
Решение 1. Составим уравнение реакции:
2KOH + H2SO4 ® K2SO4 + 2H2O.
2. С учетом уравнения (4.1) найдем количество вещества KOH
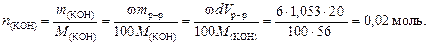
3. По уравнению реакции на 2 моль KOH приходится 1 моль Н2SO4, следовательно, для реакции с 0,02 моль гидроксида калия требуется 0,01 моль серной кислоты.
|
|
|
4. По уравнению (4.3) найдем объем раствора серной кислоты:
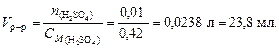
Задание I. Выразить концентрацию заданного в табл.4.1 раствора всеми возможными способами.
Таблица 4.1
| Задача | Вещество | Концентрация раствора | Плотность раствора, г/см3 |
| 1 | H2SO4 | 15 % | 1,1 |
| 2 | H3PO4 | 2,79 моль/л | 1,115 |
| 3 | BaCl2 | 1,69 моль/л | 1,28 |
| 4 | FeSO4 | 0,3 экв/л | 1,02 |
| 5 | AlCl3 | 0,55 % | 1,007 |
| 6 | CaCl2 | 22 % | 1,203 |
| 7 | Na2CO3 | 0,39 моль/л | 1,019 |
| 8 | HCl | 0,4 мол. % | 1,002 |
| 9 | KOH | 3 мол. % | 1,073 |
| 10 | NaOH | 13 % | 1,142 |
| 11 | Al2(SO4)3 | 0,15 экв/л | 1,009 |
| 12 | KMnO4 | 0,25 экв/л | 1,027 |
| 13 | K2Cr2O7 | 0,18 моль/кг | 1,033 |
| 14 | CrCl3 | 0,6 экв/л | 1,022 |
| 15 | CdCl2 | 0,5 моль/л | 1,08 |
| 16 | MnCl2 | 10 % | 1,086 |
| 17 | Hg(NO3)2 | 0,25 моль/л | 1,174 |
| 18 | ZnSO4 | 1,374 экв/л | 1,107 |
| 19 | KOH | 34 % | 1,336 |
| 20 | MgSO4 | 20 % | 1,219 |
| 21 | H2SO4 | 1,56 моль/л | 1,095 |
| 22 | H3PO4 | 7,3 мол. % | 1,181 |
| 23 | NaBr | 5,8 мол. % | 1,21 |
| 24 | NaCl | 7,1 мол. % | 1,147 |
| 25 | HCl | 17,4 мол. % | 1,149 |
| 26 | H2SO4 | 3,4 мол. % | 1,109 |
| 27 | KOH | 6,3 мол. % | 1,147 |
| 28 | H2SO4 | 5,9 мол. % | 1,18 |
| 29 | KOH | 8,107 экв/л | 1,336 |
| 30 | Pb(NO3)2 | 30 % | 1,328 |
| 31 | H3PO4 | 30 % | 1,181 |
| 32 | NaBr | 26 % | 1,21 |
| 33 | NaCl | 15 % | 1,109 |
| 34 | КОН | 560 г/л | 1,411 |
| 35 | H3PO4 | 855 г/л | 1,426 |
Окончание табл.4.1
| Задача | Вещество | Концентрация раствора | Плотность раствора, г/см3 |
| 36 | H3PO4 | 3 мол. % | 1,08 |
| 37 | HNO3 | 10,4 экв/л | 1,31 |
| 38 | H2SO4 | 40 % | 1,303 |
| 39 | ZnSO4 | 87 г/л | 1,084 |
| 40 | H2SO4 | 30 % | 1,218 |
| 41 | КОН | 0,12 моль/кг | 1,0 |
| 42 | HNO3 | 10,4 н. | 1,31 |
| 43 | NH4OH | 9 % | 0,961 |
| 44 | NaCl | 4,5% | 1,03 |
| 45 | CuSO4 | 1,037 моль/кг | 1,206 |
| 46 | FeCl3 | 1,9 моль/л | 1,234 |
| 47 | NH4OH | 10 % | 0,957 |
| 48 | H2SO4 | 20 % | 1,139 |
| 49 | H3PO4 | 24 % | 1,14 |
| 50 | BaCl2 | 10 % | 1,092 |
|
|
|
Задание II. Решить задачи.
51. Какой объем 88-процентного раствора серной кислоты плотностью 1,8 г/см3 надо взять, чтобы приготовить 2 л этой же кислоты концентрацией 2,36 моль/л?
52. Какое количество миллилитров 12 н. раствора едкого кали (КОН) надо взять, чтобы приготовить 500 мл 15-процентного раствора едкого кали плотностью 1,14 г/см3?
53. Какое количество воды надо добавить к 200 мл 52-процентного раствора едкого натра плотностью 1,35 г/см3, чтобы получить раствор с концентрацией 2,78 моль/л?
54. Раствор серной кислоты концентрацией 3 моль/л имеет плотность 1,18 г/см3. Какое количество воды надо добавить к 118 г этого раствора, чтобы получить раствор с концентрацией 12 %?
55. Сколько воды надо добавить к 125 мл 26-процентного раствора соляной кислоты плотностью 1,13 г/см3, чтобы получить раствор с концентрацией 14,5 %?
56. Какое количество воды надо добавить к 150 г раствора хлорида бария в воде (концентрация 2 экв/л, плотность 1,2 г/см3), чтобы получить раствор с концентрацией 8 %?
57. Какое количество миллилитров раствора фосфорной кислоты, мольная доля которого 0,01 (плотность раствора 1,025 г/см3), надо взять, чтобы получить 200 г раствора с концентрацией 2,6 %?
58. Сколько миллилитров 2,25 М раствора хлорида калия надо взять, чтобы приготовить 1,5 л 6-процентного раствора плотностью 1,04 г/см3?
59. Какой объем раствора соляной кислоты (концентрация 38 %, плотность 1,189 г/см3) потребуется для приготовления 250 мл 0,08 н. раствора?
60. Сколько миллилитров раствора серной кислоты (концентрация 96 %, плотность 1,84 г/см3) потребуется для приготовления 2 л 0,25 н. раствора?
61. Сколько граммов едкого кали надо взять для приготовления 2 л раствора концентрацией 10 % и плотностью 1,09 г/см3?
62. Какой объем раствора серной кислоты (концентрация 98 %, плотность 1,837 г/см3) надо взять для приготовления 500 мл 0,1 н. раствора?
63. Какой объем 3 н. раствора фосфорной кислоты надо взять для приготовления 1 л 0,5 М раствора?
64. Как приготовить 500 мл 0,5 н. раствора соды из 2 н. ее раствора?
65. Сколько миллилитров воды надо прибавить к 300 мл раствора едкого кали, (концентрация 25 %, плотность 1,236 г/см3), чтобы получить 8-процентный раствор?
66. Какой объем азотной кислоты (концентрация 56 %, плотность 1,345 г/см3) потребуется для приготовления 1 л 0,1 М раствора?
67. Сколько миллилитров воды надо прибавить к 100 мл раствора серной кислоты (концентрация 48 %, плотность 1,376 г/см3), чтобы получить 0,5 н. раствор?
68. До какого объема надо разбавить 200 мл 1 н. раствора хлорида натрия, чтобы получить раствор концентрацией 4,5 % и плотностью 1,029 г/см3?
69. Сколько граммов сульфата натрия надо прибавить к 1 л раствора (концентрация 10 %, плотность 1,09 г/см3), чтобы получить 15-процентный раствор?
70. Сколько воды надо прибавить к 200 мл раствора азотной кислоты (концентрация 32 %, плотность 1,193 г/см3), чтобы получить 10-процентный раствор?
71. Сколько раствора соляной кислоты (концентрация 36 %, плотность 1,179 г/см3) потребуется для приготовления 1 л 0,5 н. раствора?
72. Сколько воды надо добавить к 50 мл 2 н. раствора, чтобы получить 0,25 н. раствор?
73. Сколько граммов хлорида аммония надо добавить к 5 л 2,1 М раствора плотностью 1,054 г/см3, чтобы получить 20-процентный раствор?
74. Сколько граммов едкого натра надо взять для приготовления 2 л раствора концентрацией 10 % и плотностью 1,080 г/см3?
75. Как приготовить 1 л 1 н. раствора KOH из 49-процентного раствора той же щелочи плотностью 1,5 г/см3?
76. Имеется раствор серной кислоты (концентрация 80 %, плотность 1,732 г/см3). Как из него приготовить 2 л 6 М раствора H2SO4?
77. Сколько серной кислоты (концентрация 60 %, плотность 1,503 г/см3) надо взять для приготовления 10 л 0,1 н. ее раствора?
78. Сколько воды надо испарить, чтобы из 10 л 0,25 М раствора ортофосфорной кислоты получить 6 М раствор?
79. В лаборатории имеется 20 кг 12-процентного раствора поташа K2CO3. Сколько килограммов технического поташа, содержащего 8 % посторонних примесей, надо взять для повышения концентрации имеющегося раствора до 20 %?
80. Какой объем раствора карбоната натрия (концентрация 10 %, плотность 1,105 г/см3) требуется для приготовления 5 л 2-процентного раствора плотностью 1,02 г/см3?
81. Сколько граммов хлористого аммония потребуется для приготовления 600 мл 0,5 М раствора?
82. Какую массу нитрата свинца (II) надо взять для приготовления 300 мл 0,2 н. раствора?
83. Сколько граммов медного купороса (пентагидрата сульфата меди (II)) надо взять для приготовления 1 л 2 н. раствора?
84. Какой процентной концентрации получится соляная кислота, если к 100 мл раствора HCl (концентрация 36 %, плотность 1,179 г/см3) прибавить 200 мл воды?
85. Сколько граммов азотной кислоты содержится в 1 л 36-процентного раствора плотностью 1,221 г/см3?
86. Какой процентной концентрации получится раствор, если к 500 мл 30-процентного раствора КОН плотностью 1,288 г/см3 прибавить 500 мл воды?
87. Какой объем аммиака следует растворить в воде при 25 °С и 120 кПа для получения 2 л 10-процентного раствора гидроксида аммония, плотностью 0,96 г/см3?
88. Какая масса сульфита натрия потребуется для приготовления 5 л 8-процентного раствора плотностью 1,075 г/см3?
89. Сколько воды надо прибавить к 50 мл 2 М раствора ортофосфорной кислоты, чтобы получить 0,25 н. раствор?
90. Какой объем воды потребуется для растворения 67,2 л хлороводорода, приведенного к нормальным условиям, для получения 9-процентного раствора плотностью 1,04 г/мл?
91. Сколько граммов десятиводного сульфата натрия нужно растворить в 800 мл воды для получения раствора с концентрацией по безводному сульфату натрия 10 %?
92. Какая масса хлорида калия потребуется для приготовления 200 мл раствора с концентрацией 1,455 моль/л?
93. Необходимо приготовить 100 г раствора хлорида бария с концентрацией 5 %. Какая масса дигидрата хлорида бария потребуется для этого?
94. Какой объем раствора серной кислоты (концентрация 30 %, плотность 1,12 г/см3) потребуется для приготовления 2 л раствора концентрацией 0,4 н.?
Дата добавления: 2020-12-12; просмотров: 92; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
