Константы диссоциации некоторых слабых кислот и оснований 2 страница
Задание II. Назвать соединения.
| 135. (CdOH)3PO4. | 158. BiCl3. |
| 136. (CuOH)2CO3. | 159. Ca(BiO3)2. |
| 137. (MgOH)2CO3. | 160. Ca(ClO)2. |
| 138. (NH4)2C2O4. | 161. Ca(ClO3)2. |
| 139. (NH4)2Cr2O7. | 162. Ca(HCO3)2. |
| 140. Na2Cr2O7. | 163. Ca2P2O7. |
| 141. (NH4)2SnO3. | 164. CaOHCl. |
| 142. (NH4)2SO4. | 165. Ca(H2PO4)2. |
| 143. (ZnOH)2CrO4. | 166. CaCrO4. |
| 144. [Cr(OH)2]2SO4. | 167. CaC2O4. |
| 145. [Cr(OH)2]3PO4. | 168. CaTe. |
| 146. Al(OH)3. | 169. CdI2. |
| 147. AlOHSO4. | 170. Cd(HS)2. |
| 148. Al(OH)2NO3. | 171. CH3COOH. |
| 149. AlBr3. | 172. Co(NO3)3. |
| 150. BaCrO4. | 173. CoBr2. |
| 151. BaCr2O7. | 174. CoI2. |
| 152. Ba(HSO3)2. | 175. CoTe. |
| 153. Ba(IO3)2. | 176. Cr(H2PO4)3. |
| 154. Ba(NO3)2. | 177. CrCl3. |
| 155. Ba3(PO4)2. | 178. CrOHSO4. |
| 156. BaSO3. | 179. CuCl2. |
| 157. BaSO4. | 180. OF2. |
| 181. Fe(ClO2)2. | 219. Na2CrO4. |
| 182. Fe(CrO2)2. | 220. KHTe. |
| 183. Fe(HCO3)3. | 221. K2MnO4. |
| 184. Fe2(SO4)3. | 222. K2H2P2O7. |
| 185. FeCl3. | 223. KMnO4. |
| 186. FeOHSO4. | 224. KNbO3. |
| 187. [Fe(OH)2]2SO4. | 225. KNO2. |
| 188. H2CrO4. | 226. Li2SeO4. |
| 189. H2CSO2. | 227. LiClO4. |
| 190. H2O. | 228. LiHSO4. |
| 191. H2Se. | 229. Mg(IO)2. |
| 192. H2SnO3. | 230. MgMnO4. |
| 193. H2SO3. | 231. Mn(HSO4)2. |
| 194. H2SO4. | 232. Na2BeO2. |
| 195. H2S2O3. | 233. Na2S2O3. |
| 196. H2S2O8. | 234. NaH2SbO4. |
| 197. H2WO4. | 235. NaAlO2. |
| 198. H3PO3. | 236. NaAlSiO4. |
| 199. HClO. | 237. Na3BO3. |
| 200. HClO3. | 238. NaCl. |
| 201. HClO4. | 239. Na2CrO4. |
| 202. HF. | 240. NaHS. |
| 203. HgSO4. | 241. NaMnO4. |
| 204. Hg2Cl2. | 242. Pb(SO4)2. |
| 205. HIO3. | 243. Pb3O4. |
| 206. HNO2. | 244. Pb(OH)CH3COO. |
| 207. H3PO3. | 245. Pb(OH)I. |
| 208. HPO3. | 246. PbS. |
| 209. K2CO3. | 247. SbI3. |
| 210. K2CrO4. | 248. Sn(NO3)4. |
| 211. K2Cr2O7. | 249. SnCl2. |
| 212. K3AsO4. | 250. Sr(BiO3)2. |
| 213. K3BO3. | 251. CrOH(NO3)2. |
| 214. KAsO3. | 252. SbONO3. |
| 215. KClO2. | 253. ZrOCl2. |
| 216. KCN. | 254. UO2(NO3)2. |
| 217. KCNS. | 255. NaUO2(CH3COO)3. |
| 218. KCrO2. |
Задание III. Написать в молекулярной и ионно-молекулярной формах уравнения реакций.
256. Нитрат свинца (II) + иодид калия.
257. Сульфид калия + серная кислота.
|
|
|
258. Карбонат калия + соляная кислота.
259. сульфат меди (II) + гидроксид натрия.
260. карбонат кальция + соляная кислота.
261. сульфит натрия + серная кислота.
262. бромид алюминия + нитрат серебра.
263. сульфид натрия + серная кислота.
264. сульфид железа (II) + соляная кислота.
265. формиат калия + азотная кислота.
266. хлорид аммония + гидроксид кальция.
267. соляная кислота + гидроксид бария.
268. плавиковая кислота + гидроксид калия.
269. гидроксид железа (III) + азотная кислота.
270. уксусная кислота + гидроксид аммония.
271. азотистая кислота + гидроксид аммония.
272. сероводород + гидроксид аммония.
273. гидрокарбонат натрия + соляная кислота.
274. хлорид железа (III) + гидроксид калия.
275. ацетат свинца + сульфат натрия.
276. гидросульфат калия + серная кислота.
277. нитрат цинка + избыток гидроксида натрия.
278. гидроксид кальция + оксид углерода (IV).
279. нитрат бария + сульфат натрия.
280. хлорид бария + сульфат алюминия.
281. нитрат свинца + сульфат железа (III).
282. сульфат хрома (III) + гидроксид аммония.
283. карбонат натрия + ортофосфорная кислота.
284. Нитрат дигидроксовисмута + азотная кислота.
285. Хлорид гидроксомагния + соляная кислота.
Задание IV. Cоставить молекулярные уравнения реакций, которым соответствуют ионно-молекулярные уравнения.
|
|
|
| 286. H+ + OH- ® H2O. | 291. SO32- + 2 H+ ® SO2 + H2O. |
| 287. Pb2+ + S2- ® PbS¯. | 292. Pb2+ + CrO42- ® PbCrO4¯. |
| 288. ClO- + H+ ® HClO. | 293. HCO3- + OH- ® CO32- + H2O. |
| 289. CO32- + 2H+ ® CO2 + H2O. | 294. ZnOH+ + H+ ® Zn2+ + H2O. |
| 290. CH3COOH + OH- ® CH3COO- + H2O. | 295. Mg2+ + CO32- ® MgCO3¯. |
| 296. Cu2+ + S2- ® CuS¯. | 306. HCO3- + H+ ® H2O + CO2. |
| 297. SiO32- + 2 H+ ® H2SiO3. | 307. Cu2+ + 2OH- ® Cu(OH)2¯. |
| 298. CaCO3 + 2H+ ® Ca2+ + H2O. | 308. Pb2+ + 2 I- ® PbI2¯. |
| 299. Al(OH)3 + OH- ® [Al(OH)4]-. | 309. Sr2+ + SO42- ® SrSO4¯. |
| 300. Pb2+ + 2 I- ® PbI2¯. | 310. Sr2+ + CO32- ® SrCO3¯. |
| 301. Fe(OH)3 + 3H+ ® Fe3+ + 3H2O. | 311. 2Ag+ + SO42- ® Ag2SO4¯. |
| 302. Cd2+ + 2OH- ® Cd(OH)2¯. | 312. Ba2+ + CO32- ® BaCO3¯. |
| 303. H+ + NO2- ® HNO2. | 313. Cd2+ + 2 OH- ® Cd(OH)2¯. |
| 304. Zn2+ + H2S ® ZnS¯ + 2 H+. | 314. CuOH+ + H+® Cu2+ + H2O. |
| 305. Ag+ + Cl- ® AgCl¯. | 315. NH4+ + OH- ® NH4OH. |
Задание V. Закончить и уравнять реакцию.
| 316. AgNO3 + H2S ® … | 340. CdCl2 + H2S ® … |
| 317. AgNO3 + K2Cr2O7 ® … | 341. CH3COOAg + H2S ® … |
| 318. AgNO3 + K2CrO4 ® … | 342. CH3COOH + Ba(OH)2 ® ... |
| 319. Al(OH)3 + H2SO4 ® … | 343. CH3COOH + NH4OH ® |
| 320. Al2(SO4)3 + AgNO3 ® … | 344. CH3COOK + H2SO4 ® … |
| 321. AlBr3 + AgNO3 ® … | 345. HCOOK + H2SO4 ® … |
| 322. AlI3 + AgNO3 ® … | 346. CH3COOPb + Na2CrO4 ® … |
| 323. Ba(NO3)2 + Cr2(SO4)3 ® … | 347. CH3COOPb + Na2SO4 ® … |
| 324. Ba(NO3)2 + K2CrO4 ® … | 348. Cr2(SO4)3 + NaOH ® … |
| 325. Ba(NO3)2 + Na2SO4 ® … | 349. Cr2(SO4)3 + NH4OH ® … |
| 326. Ba(OH)2 + CO2 ® … | 350. Cu(NO3)2 + Ba(OH)2 ® … |
| 327. BaCl2 + Al2(SO4)3 ® ... | 351. Cu(NO3)2 + H2S ® … |
| 328. BaCl2 + Na3PO4 ® … | 352. Cu(NO3)2 + Na2S ® … |
| 329. BaCl2 + CH3COOAg ® ... | 353. CuSO4 + NaOH ® … |
| 330. Bi(OH)(NO3)2 + HNO3 ® … | 354. CuSO4 + NH4OH ® … |
| 331. Ca(NO3)2 + H2C2O4 ® … | 355. CuSO4 + Ba(OH)2 ® … |
| 332. Ca(NO3)2 + Na2SO4 ® … | 356. Fe(OH)3 + H2SO4 ® … |
| 333. Ca(NO3)2 + Na3PO4 ® … | 357. Fe2(SO4)3 + NaOH ® … |
| 334. Ca(OH)2 + CO2 ® … | 358. FeCl3 + KOH ® … |
| 335. CaCl2 + H2SO4 ® … | 359. FeOHCl2 + HCl ® ... |
| 336. CaCO3 + CH3COOH ® … | 360. FeS + HCl ® … |
| 337. CaCO3 + HCl ® … | 361. H2S + NH4OH ® ... |
| 338. CaCO3 + CO2 + H2O ® ... | 362. HCOOK + HNO3 ® ... |
| 339. Cd(NO3)2 + Na2S ® … | 363. HF + KOH ® … |
| 364. Hg(NO3)2 + H2S ® ... | 385. Na2HPO4 + NaOH ® … |
| 365. HNO2 + NH4OH ® … | 386. NaHSO4 + NaOH ® … |
| 366. K2CO3 + H3PO4 ® … | 387. NaHSO4 + Ba(NO3)2 ® ... |
| 367. K2CO3 + HCl ® … | 388. NaOH + H2SO3 ® … |
| 368. KHSO3 + H2SO4 ® ... | 389. NaOH + H2SO4 ® … |
| 369. KOH + HCN ® … | 390. NH4Cl + Ca(OH)2 ® ... |
| 370. KOH + H3PO4 ® … | 391. NH4Cl + NaOH ® … |
| 371. Mg(NO3)2 + (NH4)2C2O4 ® ... | 392. NH4Cl + Sr(OH)2 ® … |
| 372. MgCO3 + HCl ® … | 393. NH4Cl + Ba(OH)2 ® … |
| 373. MgOHCl + HCl ® . | 394. Ni(NO3)2 + KOH ® … |
| 374. MnCl2 + NH4OH ® … | 395. NiSO4 + (NH4)2S ® … |
| 375. Na2S + H2SO4 ® … | 396. Pb(NO3)2 + Fe2(SO4)3 ® … |
| 376. Na2S + NiSO4 ® … | 397. Pb(NO3)2 + K2CrO4 ® … |
| 377. Na2S + CdSO4 ® … | 398. Pb(NO3)2 + KI ® … |
| 378. Na2SiO3 + H2SO4 ® … | 399. Pb(NO3)2 + Na2S ® ... |
| 379. Na2SO4 + BaCl2 ® … | 400. Pb(NO3)2 + NaCl ® … |
| 380. Na2SO4 + H2SO4 ® … | 401. Sr(NO3)2 + H2SO4 ® ... |
| 381. Na2SO4 + Pb(NO3)2 ® ... | 402. Zn(NO3)2 + KOH ® … |
| 382. Na2SO4 + BaCl2 ® … | 403. Zn(OH)2 + H2SO4 ® … |
| 383. NaHCO3 + HCl ® … | 404. Zn(OH)2 + NaOH(избыток) ® ... |
| 384. NaHCO3 + NaOH ® ... | 405. Zn(OH)2 + NaOH ® … |
|
|
|
2. Строение атома
Атом любого элемента состоит из положительно заряженного ядра и отрицательно заряженных электронов, в целом атом – система электронейтральная. Заряд ядра равен порядковому номеру элемента в таблице Д.И.Менделеева. Состояние электрона в атоме описывается при помощи набора четырех квантовых чисел: главного n, орбитального l, магнитного ml и спинового ms. Определенные значения трех квантовых чисел (n, l,ml) описывают состояние электрона, называемое атомной орбиталью (АО).
|
|
|
Главное квантовое число n определяет энергию АО и номер энергетического уровня, на котором находится электрон, и может принимать целочисленные значения от единицы до бесконечности.
Орбитальное квантовое число l определяет форму АО и энергетический подуровень, оно может принимать значения от нуля до n-1. Исторически атомным орбиталям со значениями l, равным 0, 1, 2, 3 присвоены буквенные обозначения s-, p-, d-, f-. В графических схемах электронного строения атомов каждая орбиталь обозначается символом .
 Магнитное квантовое число ml определяет пространственную ориентацию АО и отчасти ее форму, оно может принимать значения от –l до +l.
Магнитное квантовое число ml определяет пространственную ориентацию АО и отчасти ее форму, оно может принимать значения от –l до +l.
Спиновое квантовое число ms характеризует собственный момент импульса и связанный с ним магнитный момент и может принимать значения ±1/2.
Последовательность распределения электронов в атоме по мере увеличения значений l и n выражается электронными или электронно-графическими формулами.
При заполнении АО действует принцип Паули, из которого следует, что в атоме не может быть двух электронов, характеризующихся одинаковым набором значений четырех квантовых чисел. Состояние электронов в атоме должно отличаться значением хотя бы одного квантового числа.
Заполнение энергетических подуровней подчиняется прави лу Хунда, согласно которому электроны в основном состоянии в атоме располагаются так, чтобы модуль суммарного спина всех электронов подуровня был максимальным. Например, четыре валентных p-электрона атома кислорода размещаются в квантовых ячейках следующим образом:
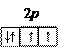

Последовательность заполнения энергетических уровней и подуровней в атомах выражается правилом Клечковкого: порядок заполнения определяется возрастанием суммы n+l, а при одинаковом ее значении первым заполняется подуровень с меньшим значением n в этой сумме. Например,
Дата добавления: 2020-12-12; просмотров: 119; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
