Понятие о потенциале покоя и потенциала действия в живой клетке
Потенциал покоя:
Мембранный потенциал, возникающий между внутренней и наружной сторонами клеточной мембраны, находящейся в невозбужденном состоянии: -(70-80) мВ

Потенциал действия: Разность между потенциалом покоя и зарядом мембраны в возбужденном состоянии (амплитуда колебания мембранного потенциала) (120-140мВ)В результате активной работы калий-натриевого насоса наступает реполяризация – клетка возвращается в состояние покоя
ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ
1. Предмет химической кинетики.
Химическая кинетика – раздел физической химии, в котором изучаются механизмы химических реакций, скорость их протекания и влияние на нее различных факторов (концентрация реагирующих веществ; температура; давление; свет; катализаторы)
2. Гомогенные и гетерогенные химические реакции, примеры.
Гомогенные реакции:
· характеризуются отсутствием поверхности раздела между реагентами, их взаимодействие протекает по всему объему системы;
· вещества в одном агрегатном состоянии
2NO+O2=2NO2
H2SO4+2KOH=K2SO4+2H2O
Гетерогенные реакции:
· Есть поверхность раздела
· Разные агрегатные состояния
CaO(тв) + CO2(г) = CaCO3(тв)
Zn(т) + 2HCl(р) = ZnCl2(тв) + H2(г)
3. Понятие о средней и истинной скорости химической реакции (математические выражения для гомогенной реакции)
Средняя скорость - это отношение уменьшения концентрации исходного вещества или увеличение концентрации продукта к промежутку времени, в течении которого произошло это изменение (скорость-величина всегда положительная)
|
|
|
V = ±  =
= 
Истинная скорость - бесконечно малое изменение концентрации веществв за бесконечно малый промежуток времени, т.е. производная по времени
V=± dC/dt
Математическое выражение для гомогенной реакции V= ∆C/∆t моль/ л*сек.
4. Изменение скорости необратимой реакции во времени
?Скорость необратимой химической реакции – это изменение количества вещества какого-либо участника реакции в единицу времени в единице реакционного пространства.Скорость обратимой химической реакции равна разности скоростей прямой и обратной реакций. После достижения равновесия она, очевидно, равна нулю.?

A + B = C + D
Кинетическая кривая, отражающая изменение концентрации какого-либо вещества во времени (в ходе реакции кривая имеет разный вид для реагента и продукта реакции)
· Ни истинная, ни средняя скорости реакции не используются в качестве ее кинетических характеристик вследствие их изменчивости во времени
· Такой величиной является константа скорости
5. В чем особенности кинетики гетерогенных реакций?
Химические реакции, протекающие на границе раздела фаз, называют гетерогенными. Гетерогенными системами являются смеси твердых веществ, газ + твердое вещество, жидкость + твердое вещество .Гетерогенные процессы широко распространены в природе и часто используются на практике. Примерами могут служить процессы растворения, кристаллизации, испарения, горение твердого топлива, окисления металлов, реакции, идущие на поверхности твердых катализаторов.
|
|
|
S(ТВ)+О2(Г)=SO2(Г)
Особенности гетерогенных систем: Zn(тв)+ 2 HCl = ZnCl2 + H2
V= ± ∆C/(∆t*S); S- площадь поверхности взаимодействия. Единицы измерения – моль/м^2*c
6. Факторы, влияющие на скорость химической реакции
А) Природа реагирующих веществ – реакции между веществами с неполярной ковалентной связью протекают значительно медленнее, чем реакции с участием веществ с ионной и сильно полярной ковалентной связью.
Б) Агрегатное состояние реагирующих веществ и степень их дисперсности – для гетерогенных систем чем больше поверхность соприкосновения, тем быстрее реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ – путем их растворения.
В) Среда, в которой протекает реакция – при химических реакция в растворах большое влияние на ее скорость оказывает природа растворителя. Растворитель не может рассматриваться только как инертная среда, во многих случаях растворитель играет роль активного участника реакции. Закономерности влияния растворителя на скорость химической реакции определяется прежде всего энергией сольватации (взаимодействие частиц растворенного вещества с молекулами растворителя) и диэлектрической проницаемостью (величина, характеризующая полярность растворителя)
|
|
|
Г) Концентрация реагирующих веществ – чем выше концентрация, тем больше частиц находится в единице объема, тем выше вероятность соударений между молекулами реагирующих веществ и вероятность эффективных соударений между ними.
Д) Температура – чем она выше, тем больше скорость
Е) Присутствие катализаторов или ингибиторов
7. ЗДМ. Математическое выражение
Скорость химической реакции при постоянной температуре прямопропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам, стоящих перед формулой данного вещества в уравнении реакции.
аА + bB = cC + dD
V = K [A]a[B]b
2NO + H2 = N2O + H2O
V = K C2NO*CH2
8. Константа скорости реакции, ее физический смысл. От каких факторов она зависит?
|
|
|
Константа равна скорости реакции при концентрации реагирующих веществ, равных единице. Определяется природой реагирующих веществ и зависит от тех же факторов, что и скорость химической реакции, кроме концентрации
9. Применение ЗДМ к гетерогенным реакциям
Математическое выражение ЗДМ строго справедливо для газов или жидкостей (гомогенные системы) и не распространяется на реакции с участием твердых веществ (гетерогенные системы)
? Зависимость скорости гетерогенной химической реакции от поверхностной концентрации веществ в реакции определяется законом действующих масс. Так, реакция горения угля протекает тем быстрее, чем интенсивнее подается к углю кислород. В случае гетерогенных реакций в уравнение закона действующих масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе. Концентрация вещества, находящегося в твердой фазе, обычно представляет собой постоянную величину и поэтому входит в константу скорости. Например, для гетерогенной реакции горения угля С(к) + О2(г)= СО2(г)кинетическое выражение уравнения скорости реакции по закону действующих масс запишется так k – константа скорости реакции; кон.-яО2–поверхностная концентрация кислорода, моль/м2 ?
10. Реакции простые и сложные, примеры. Понятие о лимитирующей стадии.
· Простые (элементарные) протекают в одну стадию
I2 = 2I
H+ + OH- = H2O
· Сложные протекают в несколько стадий, каждая из которых является простой реакцией
Na2S2O3 + H2SO4 = Na2SO4 + S + SO2 + H2O
1) S2O3 + 2H = H2S2O3 - быстро
2) H2S2O3 = S + H2SO3 - медленно
3) H2SO3 = SO2 + H2O – быстро
Если скорости отдельных стадий сильно различаются, то скорость реакции в целом и ее порядок определяются скоростью и порядком самой медленной – лимитирующей стадией реакции
11. Понятие о молекулярности реакции. Примеры моно-, ди-, тримолекулярных реакций.
Молекулярность – число молекул, участвующих в элементарном акте химического взаимодействия.
А) мономолекулярные – реакции, в элементарном акте которых химическому превращению подвергается 1 молекула
I2 = I + I
N2O4 = 2NO2
Б) бимолекулярные – реакции, у которых в элементарном акте сталкиваются 2 молекулы
CO + Cl2 = COCl2
В) тримолекулярные – сталкиваются 3 молекулы
2NO + H2 = N2O + H2O
· Одновременное столкновение 3х молекул случается довольно редко
· Реакций большей молекулярности практически не бывает
· Сложные реакции протекают в несколько стадий, в каждой из которых взаимодействие осуществляется при столкновении 2, реже 3 молекул
12. Понятие о порядке реакции. Приведите примеры, когда молекулярность и порядок реакции совпадают и когда не совпадают.
Порядок равен сумме показателей степени концентраций в кинетическом уравнении (не всегда бывает целочисленным). η
?1 порядок: СН3СООСН3 = СО2 + СН3-СН3?
2 порядок: CO + Cl2 = СОСl2; 2N2O = 2N2 + O2
3 порядок: 2NO + O2 = 2NO2; 2CO + O2 = 2CO2
Формальная классификация реакций по порядку допускает возможность реакций нулевого порядка, скорость которых постоянна во времени при постоянной температуре и не зависит от концентрации реагента.
2NH3 = N2 + 3H2
Скорость реакций дробных порядков: 2SbH3 = 2Sb + 3H2
V1 = K1[SbH3]0.6
Для простых по механизму реакций понятие молекулярности и порядка совпадают. Но часто порядок реакции не соответствует ее молекулярности (большинство реакций является совокупностью последовательно или параллельно протекающих элементарных реакций). В некоторых случаях несовпадение вызвано большим избытком одного реагентов. В многостадийной реакции промежуточные превращения осуществляются с несопоставимой скоростью.
Примеры: η ниже кажущейся молекулярности , потому что количество одного из реагентов является средой и в ходе химического превращения остается практически постоянным.
С12Н22О11 + Н2О = С6Н12О6 + С6Н12О6
V1 = K1 [C12H22O11][H2O]
[H2O] = const = K1’; K = K1’*K2”
V1 = K1[C12H22O11]; η = 1
13. В каких случаях скорость реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам?
??При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Для реакции aA + bB → mM + nN математическое выражение закона действующих масс имеет вид :v = k • CAa • CBb, где v - скорость реакции; k - коэффициент пропорциональности, называемый константой скорости химической реакции (при CA = CB = 1 моль/л k численно равна v); CA и CB - концентрации реагентов A и B; a и b - стехиометрические коэффициенты в уравнении реакции. Константа скорости химической реакции k определяется природой реагирующих веществ и зависит от температуры, от присутствия катализатора, но не зависит от концентрации веществ, участвующих в реакции. Закон действующих масс справедлив только для наиболее простых по своему механизму взаимодействий, протекающих в газах или в разбавленных растворах.??
Когда V = K при С по 1 моль/л
14. Уравнение кинетики реакции первого порядка, его физический смысл.
К =  ln
ln 
Физический смысл: теоретическая зависимость позволяет заранее рассчитать концентрацию реагента в любой момент времени, если известна константа скорости и ее начальная концентрация. Имеется возможность прогнозировать протекание реакции во времени.
15. Понятие о периоде полупревращения. Математическое выражение периода полупревращения для реакции первого порядка.
Определяет момент уменьшения начальной концентрации реагирующих веществ вдвое
.t1/2 = ln2/K
16. Объясните влияние температуры на скорость химической реакции.
При повышении или уменьшении температуры, скорость химических реакций существенно изменяется. С точки зрения закона действующих масс, это изменение скорости обусловлено температурной зависимостью константы скорости. В интервале 273-320 К температурная зависимость имеет нормальный характер. С увеличением температуры скорость возрастает, с уменьшение – падает.
Исключение составляют некоторые реакции 3 порядка. Зависимость скорости (константы скорости) от температуры выражают правилом Вант-Гоффа
17. Правило Вант-Гоффа, определяющее зависимость скорости реакции от температуры, его математическое выражение.
При увеличении температуры на 100, скорость реакции возрастает в 2-4 раза
VT2 = VT1 *  T2-T1/10
T2-T1/10
18. Что называется температурным коэффициентом скорости реакции? Какие значения он может принимать?
VT2 = VT1 *  T2-T1/10
T2-T1/10
.γ – температурный коэффициент скорости реакции, показывающий, во сколько раз увеличивается скорость реакции при увеличении температуры на каждые 100
Для обычных реакций: γ = 2-4. Для ферментативных реакций он может достигать значений 7-9
19. Влияние температуры на скорость биологических процессов.
? Жизнь биологических объектов может существовать в пределах интервала температур от 173 до 373 К. для биологических процессов большое значение имеет не только известный уровень температуры, но и вполне определенный температурный интервал. Скорость химических процессов обычно увеличивается с ростом температуры, и это увеличение практически ничем не лимитируется, в то время как биологические процессы имеют температурные границы, за которыми наступает резкое уменьшение их скорости и даже полное прекращение - смерть. В известной степени тепло повышает жизнедеятельность и ускоряет жизненные процессы, благотворно влияя на рост и размножение организмов. Но если температура превысит определенный предел, эти процессы быстро подавляются. На биологической кривой можно установить три характерные точки: минимальная температура (около 273 К), оптимальная и максимальная. В интервале от минимума до максимума температур интенсивность биологического процесса растет, и здесь наблюдается подчинение правилу Вант-Гоффа.?
VT2 = VT1 *  T2-T1/10
T2-T1/10
Для обычных реакций: γ = 2-4. Для ферментативных реакций он может достигать значений 7-9
Именно поэтому колебания температуры тела человека в пределах даже 10 сильно сказываются на его самочувствие.
20. Сущность теории активации Аррениуса. Способы активации молекул. Понятие об энергии активации.
· Не каждое столкновение приводит к акту химического взаимодействия
· К химическому взаимодействию приводят только те столкновения, в которых участвуют частицы, обладающие энергией, необходимой для данного взаимодействия (энергией активации)
· При соударении частицы должны быть определенным образом ориентированы относительно друг друга.
Энергия активации (Еа) – минимальная энергия взаимодействующих частиц, достаточная для того, чтобы все частицы вступили в химическую реакцию (кДж/моль)
-Характеризует энергетический барьер, преодоление которого реагирующими частицами приводит к образованию коечных веществ
-Зависит от природы реагирующих веществ и пути протекания реакций и не зависит от температуры.
Один из способов активации молекул - повышение температуры: при этом число активных молекул возрастает в геометрической прогрессии, благодаря чему резко увеличивается скорость реакции. Скорость реакции непосредственно зависит от энергии активации. Если энергия активации мала, то реакция идет с большой скоростью(реакции между ионами идут практически мгновенно). Если энергия активации велика, то реакция идет медленно. В этом случае для активизации применяют нагревание, облучение, катализаторы. Под действием катализаторов у частиц(молекул) реагентов ослабляются связи между атомами и они делаются более реакционно способными. В этом случае в присутствии катализатора требуется меньшая энергия активации и скорость реакции увеличивается.?
21. Энергетический профиль химической реакции

Энергия активации реакции характеризует энергетический барьер, преодоление которого реагирующими частицами приводит к образованию конечных веществ. Энергия активации необходима для возникновения непрочного переходного комплекса [А—В], который не является химическим соединением в подлинном смысле этого слова, так как в нем происходит перераспределение химических связей между взаимодействующими атомами. Такой промежуточный комплекс неустойчив вследствие его высокой энергии и может быстро распадаться, образуя продукты реакции D и F.
22. Чем определяется величина энергии активации конкретной реакции? Влияние величины энергии активации на скорость реакции.
1)минимальная энергия в/д частиц, достаточная для того, чтобы все частицы вступили в химическую реакцию.
2)характеризует энергетический барьер, преодоление которого реаг.частицами приводит к образованию конечных в-в.
За величину энергии активации приближенно принимают превышение средней энергии активированного комплекса над средним уровнем энергии исходных веществ. Она зависит от природы реагирующих (исходных) веществ и характеризует изменение скорости реакции от температуры. Чем больше энергия активации, тем быстрее увеличивается с ростом температуры скорость реакции.
Высокая энергия активации делает многие реакции химически невозможными, которые с точки зрения ТД могли бы проходить. Скорость реакции непосредственно зависит от энергии активации.Если энергия активации мала,то реакция идет с большой скоростью(реакции между ионами идут практически мгновенно). Если энергия активации велика,то реакция
идет медленно.
23. Связь энергии активации с константой скорости реакции. Уравнение Аррениуса.
К = А * еЕа/RT
А – предэкспоненциальный коэффициент, учитывающий частоту столкновений частиц, ориентированных определенным образом.
,е – основание натурального логарифма
Чем больше энергия активации, тем меньше будут константа и скорость реакции, т.к. в системе будет меньшее число активных частиц.
При увеличении температуры реакции за счет увеличения энергии системы, резко возрастает число активных частиц и этим объясняется значительное повышение скорости реакции.
-Опытным путем доказано, что реакции с Еа меньше 50 кДж/моль при 298 К идут с высокой скоростью, если реакция имеет Еа больше 100 кДж/моль, то ее скорость неизмеримо мала.
24. Экспериментальное определение энергии активации
· Уравнение Аррениуса можно представить в логарифмированной форме:
lnК = lnА -Еа/RT от
· При графическом изображении этого уравнения в виде зависимости lnК от T-1 получается прямая линия, которая отсекает на оси ординат отрезок, равный lnA, а из тангенса угла наклона которой можно определить величину Еа
25. Значение энергии активации для упорядоченного протекания химических процессов
· Высокая Еа делает практически невозможными многие реакции, которые, с точки зрения термодинамики, могли бы происходить.
· Эта химическая хаотизация невероятна из-за существования энергии активации - характернейшей черты любых химических превращений.
· Молекула любого вещества потому и существует, что изменения ее состояния связаны с преодолением энергетического барьера, т. е. с энергией активации на пути ее превращений.
? Источники активации реагирующих веществ могут быть различными:
- термическая активация в результате подвода теплоты из окружающей среды;
- действие различного рода излучений (свет, проникающая радиация);
- действие быстрых частиц, возникающих при ядерном распаде или в электрическом разряде.
При подводе энергии к системе происходит перераспределение этой энергии между частицами и увеличивается доля активных частиц, имеющих необходимую энергию для данного взаимодействия.
26. Понятие об активированном (промежуточном) комплексе. Значение этого понятия для энергетической характеристики реакции.
Неустойчивый переходный комплекс, который не является химическим соединением, т.к. в нем происходит перераспределение химических связей между взаимодействующими атомами. Такой промежуточный комплекс неустойчив вследствие его высокой энергии и может быстро распадаться, образуя продукты реакции.
27. Понятие о последовательных и параллельных реакциях. Примеры.
Последовательные:
· Проходят в несколько следующих друг за другом реакций промежуточных стадий.
А→В→С→D
· Реакции гидролиза эфиров и полисахаридов, термический крекинг углеводородов
(С6Н10О5) + nH2O(H+) = nC6H12O6
!еще одна реакция с метилацетатом!
Параллельные:
· Одни и те же исходные вещества, реагируя одновременно, образуют разные продукты
Реакция нитрования фенола азотной кислотой с образованием орто- и паранитрофенолов (напишете сами)
28. Понятие о сопряженных и цепных реакциях. Примеры
Сопряженные:
Реакции, каждая из которых происходит только при условии протекания другой реакции, причем обе реакции имеют общий промежуточный продукт. Такой продукт может играть роль катализатора или ингибитора для химических превращений (автокатализа или автоингибирования).
Реакции окисления глюкозы, синтез АТФ, ацетилирование ?KOASH?
Цепные: Характерны 3 стадии
1) Зарождение цепи: происходит образование промежуточных активных частиц под воздействием света, радиоактивного излучения или температуры.
2) Развитие цепи: каждая активная частица, вступая во взаимодействие с молекулами реагентов, способствует появлению новых активных частиц.
3) Обрыв цепи: окончательное расходование активных частиц за счет их столкновения друг с другом.
H2+Cl2 = 2HCl - 1
Cl2 = Cl* + Cl* - 1
Cl* + H2 = HCl + H* - 2
H* + Cl2 = HCl + Cl* - 2
H* + Cl* = HCl – 3
29. Фотохимические реакции, их особенности. Примеры
Это реакции, происходящие под действием света (фотосинтез, зрительный процесс)
Большинство реакций – многостадийные процессы, идеальной стадией которых является образование фотовозбужденных молекул в результате поглощения квантов света.
А + hv(ашню) = А*
А* + В* = х1 + х2 – 1 реакция
Х1 + В = С
Х2 + В = D (конечные продукты)
30. Дайте определения понятиям: катализ, катализатор, ингибитор, промоторы, каталитические яды. Приведите примеры.
Катализ – селективное изменение скорости химической реакции веществом, которое участвует в реакции, но количество и состав которого не изменяются к моменту образования конечных продуктов.
Катализатор – вещество, участвующее в реакции и увеличивающее ее скорость, но остающееся химически неизменным в результате реакции (ферменты)
Ингибитор – вещество, снижающее скорость реакции, препятствуя обычному течению химической реакции, вступает во взаимодействие с каким-либо промежуточным веществом, удаляя его из реакционной смеси (гидрохинон, соединения технеция)
Промотор – вещество, усиливающее эффективность действия катализатора (оксиды калия/аммония)
Каталитические яды – вещества, вызывающие «отравления» катализатора, т.е. снижающие его каталитическую активность или полностью прекращающие каталитическое действие (Н2О, СО, СО2, сероводород и др)
31. Гомогенный и гетерогенный катализ. Примеры.
Гомогенный катализ - катализатор и реакционная смесь находятся в одной фазе. В гомогенных каталитических реакциях скорость пропорциональна количеству катализатора, хотя его количество в системе невелико. Гомогенный катализ в растворах и биосредах может вызываться ионами водорода (кислотный катализ) и гидроксида (основной катализ). К таким реакциям относится омыление сложных эфиров и амидов. Окислительно-восстановительные реакции обычно катализируются катионами тех d-металлов, для которых характерна переменная степень окисления, например, Fe2+ и Fe3+, Cu+ и Cu2+.
Примеры:
· Процесс окисления SO2 в SO3 при помощи газообразных ? азота.
· Окисление сложных эфиров.
· Гидролиз дисахаридов при участии небольших количеств сильных кислот или щелочей.
Гетерогенный катализ - катализатор обычно твердый, а реакция протекает на его поверхности.
При гетерогенном катализе скорость реакции сильно зависит от площади и состояния поверхности катализатора, так как реакция происходит не на всей поверхности, а только на ее активных центрах.
Примеры:
· Синтез спиртов из смеси окиси углерода с водородом в присутствии твердого катализатора
· Процессы дегидрирования, дегидратации в присутствии окиси металлов
· Разложение Н2О2 в присутствии платины
32. Основные свойства катализаторов. Факторы, влияющие на катализ.
Свойства:
· В присутствии катализатора изменяется механизм реакции, и она направляется по пути с меньшими значениями энергии активации каждой стадии, что и приводит к возрастанию скорости реакции
· Могут способствовать определенной ориентации молекул в пространстве, удобной для данного химического взаимодействия, и влиять на энтропию переходного состояния, способствуя ее возрастанию
Факторы:
· Свойства поверхности – процессы гетерогенного катализа протекают непосредственно на поверхности катализатора (величина удельной поверхности)
· При гомогенном катализе скорость процесса пропорциональна концентрации катализатора.
33. Явление автокатализа (пример). Как изменяется во времени скорость автокаталитической реакции.
Автокатализ — самоускорение р-ции, обусловленное накоплением конечного или промежуточного продукта, обладающим каталитическим действием на данную реакцию.
2MnO4− + 5C2O42− + 16H+ = 2Mn2+ + 10CO2 + 8H2O
Катализатором этой реакции являются ионы Mn2+. При комнатной температуре эта реакция вначале протекает медленно, но по мере накопления в растворе продукта-катализатора, она ускоряется.
34. Объяснение механизма катализа с точки зрения теории образования промежуточных соединений. Энергетический профиль кинетической реакции.
Влияние катализатора на скорость химической реакции в основном заключается в его участии в этой реакции и изменении ее механизма. Катализатор (Кат) образует с реагентами промежуточные, реакционноспособные соединения, которые в дальнейшем превращаются в продукты реакции и свободный катализатор:
| A+kat – [A…kat] [A…kat] + B – D+ kat A+B=D |

Таким образом, в присутствии катализатора изменяется механизм реакции, и она направляется по пути с меньшими значениями энергии активации каждой стадии 
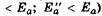 , что и приводит к возрастанию скорости реакции. Кроме того, катализатор может способствовать определенной ориентации молекул в пространстве, удобной для данного химического взаимодействия, и влиять на энтропию переходного состояния, способствуя ее возрастанию.?
, что и приводит к возрастанию скорости реакции. Кроме того, катализатор может способствовать определенной ориентации молекул в пространстве, удобной для данного химического взаимодействия, и влиять на энтропию переходного состояния, способствуя ее возрастанию.?
35. Сущность адсорбционной теории катализа
· Скорость химического процесса возрастает при адсорбции молекул реагирующих веществ на частицах катализатора (активные центры)
· С увеличением концентрации реагирующих веществ увеличивается возможность их результативных столкновений
· Уменьшение энергии активации вследствие образования поверхностных промежуточных соединений
Термодинамика разбавленных растворов
1. Охарактеризуйте понятия: раствор, компоненты раствора.
Раствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения её свойств.
Обычно компоненты раствора разделяют на растворитель и растворенное вещество. Как правило, растворителем считают компонент, присутствующий в растворе в преобладающем количестве либо компонент кристаллизующийся первым при охлаждении раствора; если одним из компонентов раствора является жидкое в чистом виде вещество, а остальными – твердые вещества либо газы, то растворителем считают жидкость. С термодинамической точки зрения это деление компонентов раствора не имеет смысла и носит поэтому условный характер.
2. Охарактеризуйте свойства воды как растворителя.
Самым распространенным растворителем на нашей планете является вода. У животных и растительных организмов содержание воды составляет обычно более 50%, а в ряде случаев достигает 90-95% = 78,5). В результате многие ионные соединения диссоциируют и отличаются высокой растворимостью в воде. Другой класс веществ, хорошо растворимых в воде, составляют полярные органические соединения (спирты, альдегиды, кетоны). Их растворимость обусловлена образованием водородных связей с молекулами воды. Вода хорошо растворяет многие ионные и полярные соединения. Такое свойство воды связано с ее высокой диэлектрической проницаемостью (
Важны и другие аномальные свойства воды: высокое поверхностное натяжение, низкая вязкость, высокие температуры плавления и кипения, более высокая плотность в жидком состоянии, чем в твердом.
Вследствие высокой полярности вода вызывает гидролиз веществ (эфиров, амидов и др.). Так как вода составляет основную часть внутренней среды организма, то она обеспечивает процессы всасывания, передвижения питательных веществ и продуктов обмена в организме.
Важнейшие биологические жидкости – кровь, лимфа, моча, слюна, пот являются растворами солей, белков, углеводов, липидов в воде. Биохимические процессы в живых организмах протекает в водных растворах.
В жидких средах организма поддерживается постоянство рН, концентрации солей и органических веществ, постоянство осмотического давления. Такое постоянство называется гомеостазом. Приведенные примеры показывают, что учение о растворах представляет особый интерес для медиков.
3. Влияние на растворимость природы компонентов. Полярные и неполярные растворители.
различают полярные растворителии неполярные растворители
ПР: вода, спирт – полярные растворители у полярных растворителей полярные молекулы
полярные растворители сильно поляризуются и имеют высокую диэлектрическую проницаемость в полярных растворителях хорошо растворяются в-ва ионной структуры с ионными связями и
молекулярной структуры с полярными ковалентными связями
внеполярных растворителях хорошо растворяются в-ва молекулярной структуры с неполярными ковалентными..
-природа в-ва
водном растворителе разные в-в а растворяютсяпо-разному
некоторые в-ва имеют низкую растворимость ПР: твердые в-ва с прочной атомной кристаллической решеткой практически нерастворимы
в-ва с ионной и полярной ковалентной связью хорошо растворяются в полярных растворителях в-ва с неполярной ковалентной связью плохо растворяются в полярных растворителях ПР:
одна из причин высокой растворимости в-в– образование связей между частицами в-ва и растворителя ПР: при растворении спирта в воде образуются водородные связи между молекулами воды и спирта
ПР: при растворении AgCl в водном раствореNH3 образуются комплексы[Ag(NH3)4]+
-температура и давление, присутствие в растворе других в-в..
если растворение – равновесное состояние, то влияние внешних факторов оценивается по принципу Ле-Шателье
внешние факторы – температура, давление, присутствие других в-в..
график зависимости растворимости от температуры – кривая растворимости..
растворимость твердых в-вв жидкостях
факторы, влияющие на растворимость твердых в-вв жидкостях:
-природа растворителя..
-природа твердого в-ва..
-температура и давление если растворение – равновесное состояние, то влияние внешних факторов оценивается по принципу Ле-Шателье
если растворение эндотермический процесс – при нагревании растворимость твердых в-вв жидкостях увеличивается если растворение экзотермический процесс –
при нагревании растворимость твердых в-вв жидкостях уменьшается объем системы при растворении твердых тел в жидкостях не меняется – повышение давления не влияет на растворимость твердых в-в в жидкостях
-присутствие в растворе других в-в..
4. Растворение жидкостей в жидкостях. Критическая температура растворения
факторы, влияющие на растворимость жидкостей в жидкостях:
-природа растворителя..
-природа жидкости
некоторые жидкости имеют неограниченную растворимость ПР: спирт в воде
некоторые жидкости имеют ограниченную растворимость ПР: раствор анилина в гексане двухслойный – верхний насыщенный р-р анилина в гексане,
нижний насыщенный р-р гексана в анилине если при нагревании растворимость увеличивается,
то ограничение растворимости связано с высокой эндотермичностью растворения таких жидкостей при температуре выше критической температуры растворения растворимость становится неограниченной ПР: раствор анилина в гексане если при охлаждении растворимость увеличивается,
то ограничение растворимости связано с высокой экзотермичностью растворения таких жидкостей при температуре ниже критической температуры растворения растворимость становится неограниченной ПР: раствор диэтиламина в воде некоторые жидкости не растворяются в другой жидкости ПР: бензол не растворяется в воде
если в-во растворяется в обеих жидкостях, а жидкости взаимно не растворяются (не смешиваются), то распределение в-ва между двумя несмешивающимися жидкостями рассчитывается по формуле Нернста-Шилова
5. Распределение вещества между двумя несмешивающимися жидкостями. Закон Нернста-Шилова.
*закон Нернста-Шилова для растворов неэлектролитов соотношение концентрации в-ва, растворенного в двух несмешивающихся жидкостях, постоянно при данной температуре
|
| |||
|
K- коэффициент распределения вещества между несмешивающимся жидкостями | |||
| С’ и С” – равновесные концентрации распределяющегося вещества в соприкосающихся фазах | |||
зависит от природы компонентов, от температуры важно, что если несмешивающиеся жидкости типа «масло-вода»,то
чем лучше в-ворастворяется в масле и чем больше его коэффициент распределения, тем лучше оно проникает ч/з липидный слой клеточных мембран путем диффузии
распределение в-вмежду двумя несмешивающимися жидкостями применяется при экстракциив-в
6. Понятие об экстракции, ее применение.
Экстракция – процесс извлечения вещества, растворенного в одном растворители другим растворителем ( экстрагентом), который не смешивается с первым и лучше растворяет извлекаемое вещество. При дробной экстракции объем экстрагента делят на n равных частей и экстрагируют. Экстрагируют одной частью и удаляют органическую фазу, затем новую порции экстрагента и тд
Основные цели экстракции:
1. получение чистого растворителя (очистка)
2. концентрирование целевого компонента в аналитических и технологических целях. Экстракцию широко применяют в фармации для извлечения из растительного сырья эфирных масел, алколоидов и других физиологически активных веществ. Экстракция бывает однократной и. дробной. При однократной - экстрагент добавляется в один прием, при дробной - добавление экстрагента проводится порциями в несколько приемов, причем, чем больше число последовательных стадий извлечения, тем больше полнота извлечения при одном и том же количестве взятого экстрагента. В современном химико-токсикологическом анализе метод экстракции широко используется для изолирования токсических веществиз объектов биологического происхождения, для очистки вытяжек из биологического материала от примесей, для выделения токсическихвеществиз предварительно очищенных вытяжек. Этот метод применяется для обнаружения токсическихвеществпри помощи некоторых качественных реакций, для количественного определения этихвеществэкстракционно-фотометрическими методами, дляконцентрированияисследуемыхвеществ, находящихся в сильно разбавленныхрастворах, и для ряда других целей.
7. Тепловые эффекты процессов растворения газов, жидких и твердых тел.
Раствором называют гомогенную систему, состоящую из двух или большего числа компонентов. При переходе вещества в раствор происходит разрыв межмолекулярных и ионных связей кристаллической решетки твердого вещества и переход его в раствор в виде отдельных молекул или ионов, которые равномерно распределяются среди молекул растворителя.
Для разрушения кристаллической решетки вещества необходимо затратить большую энергию. Эта энергия освобождается в результате гидратации (сольватации) ионов и молекул, т. е. химического взаимодействия растворяемого вещества с водой (или вообще с растворителем).
Значит, растворимость вещества зависит от разности величин энергии гидратации (сольватации) и энергии кристаллической решетки вещества.
Энергия растворения ∆Нраст - энергия, поглощающаяся (или выделяющаяся) при растворении 1 моль вещества в таком объеме растворителя, дальнейшее прибавление которого не вызывает изменения теплового эффекта.
Общий тепловой эффект растворения зависит от тепловых эффектов:
· а) разрушения кристаллической решетки (процесс всегда идет с затратой энергии ∆Н1>0);
· б) диффузии растворенного вещества в растворителе (затрата энергии ∆Н2>0);
· в) сольватации (гидратации) (выделение теплоты, ∆Н3<0, так как между растворителем и растворенным веществом образуются непрочные химические связи, что всегда сопровождается выделением энергии).
Общий тепловой эффект растворения ∆Нp будет равен сумме названных тепловых эффектов
Энергия растворения определяется по формуле 1.1:
∆Нpacт =∆Нкp. р. + ∆Нc, (1.1)
где ∆Нраст - энергия растворения вещества, кДж/моль;
∆Нc - энергия взаимодействия растворителя с растворяемым
веществом (энергия сольватации), кДж/моль;
∆Нкp.р. - энергия разрушения кристаллической решетки,
кДж/моль.
Если энергия разрушения кристаллической решетки больше энергии сольватации, то процесс растворения будет эндотермическим процессом, поскольку энергия, затраченная на разрушение кристаллической структуры, не будет скомпенсирована энергией, выделяющейся при сольватации.
Если энергия разрушения кристаллической решетки меньше энергии сольватации, то процесс растворения будет экзотермическим процессом, поскольку энергия затраченная на разрушение кристаллической структуры полностью скомпенсирована энергией, выделяющейся при сольватации. Следовательно, в зависимости от соотношения между энергией разрушения кристаллической решетки растворенного вещества и энергией взаимодействия растворенного вещества с растворителем (сольватация) энергия растворения может быть как положительной, так и отрицательной величиной.
Так, при растворении в воде хлорида натрия температура практически не изменяется, при растворении нитрата калия или аммония температура резко снижается, а при растворении гидроксида калия или серной кислоты температура раствора резко повышается.
Растворение твердых веществ в воде чаще бывает процессом эндотермическим, так как во многих случаях при гидратации выделяется теплоты меньше, чем тратится на разрушение кристаллической решетки.
Энергию кристаллической решетки можно рассчитать теоретически. Однако для теоретического расчета энергии сольватации до сих пор нет надежных методов.
Существуют некоторые закономерности, которые связывают растворимость веществ с их составом.
Для солей одного и того же аниона с разными катионами (или наоборот) растворимость будет наименьшей в том случае, когда соль образована ионами одинакового заряда и примерно одинакового размера, т.к. в этом случае энергия ионной кристаллической решетки максимальна.
Например, растворимость сульфатов элементов второй группы периодической системы уменьшается по подгруппе сверху вниз (от магния к барию). Это объясняется тем, что ионы бария и сульфата по размерам больше всего подходят друг к другу. В то время как катионы кальция и магния намного меньше анионов SO42-.
Растворимость гидроксидов этих элементов, наоборот, увеличивается от магнию к бария, потому что радиусы катионов магния и анионов гидроксида практически одинаковые,
а катионы бария по размеру очень отличаются от небольших анионов гидроксила.
Однако бывают исключения, например, для оксалатов и карбонатов кальция, стронция, бария и др.
Энергию растворения можно рассчитать:
1) используя изменение температуры при растворении.
Количество энергии, выделяющейся при нагревании или охлаждении тела рассчитывается по уравнению (1.2):
, (1.2)
где ∆Нраств. – энергия растворения вещества, кДж/моль;
сА - удельная теплоемкость вещества А, Дж/(г∙К);
m1 - масса вещества А, г;
∆Т – изменение температуры, град.
8. Термодинамика процесса растворения. Энтропийный и энтальпийный факторы процессов растворения твердых, жидких и газообразных веществ в жидкостях
в-восамопроизвольно растворяется, если энергия Гиббса системы «растворяемое вещество-раствор»уменьшается
G = (H - T S) <0,
где H - энтальпийный фактор,T S - энтропийный фактор
растворение продолжается до образования насыщенного раствора, когда G = 0 и H = T S
при растворении твердых в-в
S > 0,T S > 0,Н > 0(эндотермический процесс) илиН < 0(экзотермический процесс)
-энтропия системы увеличивается S > 0, энтропийный фактор увеличиваетсяT S > 0увеличение энтропии системы - движущая сила растворения твердыхв-в
с ростом температуры рост энтропийного фактора усиливается и растворимость твердых в-вувеличивается
-энтальпия системы зависит от соотношения энергии:
энергии, затраченной на разрушение межмолекулярных связей растворителя, энергии, затраченной на разрушение структуры растворяемого в-ва,энергии, выделяющейся при образованиигидратов-сольватов
изменение энтальпии равно сумме изменения энтальпии за счет разрушения структуры растворяемого в-ваи
изменения энтальпии за счет образования гидратов-сольватов..
H =Hкр + Hгидр
энтальпийный фактор определяет тепловой эффект растворения
| если Hкр > Hгидр, то | энтальпия системы уменьшается | Н < 0 | – идет экзотермический процесс |
| ПР: для KOH Н =-55,65КДж/моль | |||
| если Hкр < Hгидр, то | энтальпия системы увеличивается Н > 0 | – идет эндотермический процесс | |
| ПР: | |||
| при растворении жидких | в-в | ||
| S > 0,T S > 0,Н < 0(экзотермический процесс) или | Н > 0(эндотермический процесс) | ||
-энтропия системы увеличивается S > 0, энтропийный фактор увеличиваетсяT S > 0увеличение энтропии системы - движущая сила растворения жидких в-в
с ростом температуры рост энтропийного фактора усиливается и растворимость жидких в-вувеличивается
-энтальпия системы зависит от соотношения энергии:
энергии, затраченной на разрушение межмолекулярных связей растворителя, энергии, затраченной на разрушение структуры растворяемого в-ва,энергии, выделяющейся при образованиигидратов-сольватов
изменение энтальпии равно сумме изменения энтальпии за счет разрушения структуры растворяемого в-ваи изменения энтальпии за счет образованиягидратов-сольватов..
| H =Hкр + Hгидр | |||
| энтальпийный фактор определяет тепловой эффект растворения | |||
| жидкости – | в-вас молекулярной структурой и низкой энергией на разрушение структуры растворяемогов-ва | ||
| как правило, Hкр > Hгидр и энтальпия системы уменьшается | Н < 0 | – идет экзотермический процесс | |
| уменьшение | энтальпии системы - движущая сила растворения жидких | в-в | |
при растворении газов в жидкостях
S < 0,T S < 0,Н < 0(экзотермический процесс)
- энтропия системы уменьшается S < 0, энтропийный фактор уменьшаетсяT S < 0
с ростом температуры растворимость газов в жидкостях уменьшается
-энтальпия системы зависит от соотношения энергии:
энергии, затраченной на разрушение межмолекулярных связей растворителя, энергии, затраченной на разрушение структуры растворяемого в-ва,энергии, выделяющейся при образованиигидратов-сольватов
изменение энтальпии равно сумме изменения энтальпии за счет разрушения структуры растворяемого в-ваи
изменения энтальпии за счет образования гидратов-сольватов..
H =Hкр + Hгидр
энтальпийный фактор определяет тепловой эффект растворения газы – в-вас нулевой энергией на разрушение структуры растворяемогов-ва
| Hкр = 0 | H = Hгидр энтальпия | системы уменьшается Н < 0 – идет | экзотермический процесс | ||
| уменьшение энтальпии | системы | - движущая сила растворения газов | в | жидкостях | |
| с ростом температуры | растворимость газов в жидкостях уменьшается | ||||
Энтропийный фактор, характеризующий изменение энтропии системы при переходе из начального в конечное состояние

отражает стремление системы перейти от более упорядоченного состояния к менее упорядоченному, т.е., от менее вероятного к более вероятному.
Энтальпийный фактор, характеризующий тенденцию перехода системы из более высокого энергетического состояния к менее высокому, выражается изменением энтальпии системы при переходе из одного состояния к другому:

Суммарный вклад обоих факторов отражается в выражении изменения изобарно-изотермического потенциала:
9. Влияние температуры на растворимость веществ
При растворении газов в воде вследствие гидратации молекул растворяемого газа выделяется теплота. Поэтому в соответствии с принципом Ле Шателье при повышении температуры растворимость газов понижается.
Температура различным образом влияет на растворимость твердых веществ в воде. В большинстве случаев растворимость твердых веществ возрастает с повышением температуры. Например, растворимость нитрата натрия NaNO3 и нитрата калия КNO3 при нагревании увеличивается (процесс растворения протекает с поглощением теплоты). Растворимость NaCl при увеличении температуры возрастает незначительно, что связано с почти нулевым тепловым эффектом растворения поваренной соли. Растворимость гашеной извести в воде с повышением температуры уменьшается, поскольку энтальпия гидратации преобладает над величиной ΔН разрушения кристаллической решетки этого соединения, т.е. процесс растворения Ca(OH)2 экзотермичен.
В большинстве случаев взаимная растворимость жидкостей также возрастает с повышением температуры.
10. Влияние различных факторов на растворимость газов и жидкостей
факторы, влияющие на растворимость газов в жидкостях:
-природа растворителя..
-природа газа если у газа полярные молекулы, то они лучше растворяются в полярных растворителях
если газы реагируют с растворителем, то их растворимость увеличивается
ПР: NH3 + H2O NH4OH аммиачная вода или нашатырный спирт(=10%)
если молекулы газов в растворе распадаются на ионы, то их растворимость увеличивается ПР: HCl + Н2О соляная кислота(max=38%)
-температура и давление если насыщенный р-р– равновесное состояние, то влияние внешних факторов оценивается по принципуЛе-Шателье
растворение газов в жидкостях экзотермический процесс - при нагревании растворимость газов в жидкостях уменьшается
только растворение инертных газов в некоторых органических растворителях эндотермический процесс объем системы при растворении газов в жидкостях уменьшается –
11. Законы Генри и Дальтона
Закон Генри:растворимость газа прямопропорциональна давлению над жидкостью. Наибольшее значение этот закон имеет для газов
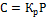
С – молярная концентрация ( растворимость)
Р – давление газа над жидкостью
 – константа Генри
– константа Генри
Следствия из закона Генри:
- Объем растворимого газа не зависит от внешнего воздействия
- Отношение концентрации газа в жидкости к его концентрации в газовой фазе есть величина постоянная
Закон Дальтона утверждает, что общее давление всех газов вместе взятых равно сумме парциальных давлений каждого газа в отдельности
12. Закон Сеченова. Механизм влияния электролитов на растворимость газов.
Закон Сеченова: растворимость газов в присутствии электролитов уменьшается.
Механизм влияния электролитов на растворимость газов: ионы электролитов гидратируются молекулами растворителя
при этом число свободных молекул растворителя уменьшается, и растворимость газов уменьшается
13. Физико-химические основы развития кессонной болезни.
Одним из значений поверхностного явления является развитие кессонной болезни (нарушение кровообращения, за счет затромбовывания пузырьками.
Сущность кессонной болезни заключается в том, что при повышении внешнего давления растворимость газов в крови многократно увеличивается. При резком снижении давления растворимость газов уменьшается и газ в виде пузырьков выделяется в сосудах , развивается закупорка сосудов.
при понижении давления растворимость газов в жидкостях уменьшается ПР: водолазы под водой дышат воздухом под высоким давлением..
при подъеме на поверхность водолазы дышат воздухом под обычным давлением на глубине в крови растворено больше газов, чем на поверхности
при быстром подъеме водолазов на поверхность в крови образуются пузырьки газов, которые не могут оставаться в крови из-заснижения растворимости
газовые пузырьки в крови закупоривают мелкие сосуды(эмболия) и нарушают кровоснабжение тканей так развивается кессонная болезнь
14. Сущность гипербарической оксигенации, ее применение.
при повышении давления растворимость газов в жидкостях увеличивается
ПР: при недостаточном кровоснабжении(болезни и травмы сосудов), болезни крови.. ткани недополучают O2 развивается гипоксия тканей, которая может закончиться гибелью клеток если больной будет дышать воздухом под высоким давлением,
то растворение кислорода в крови увеличится.., и ткани получат больше кислорода так действует гипербарическая оксигенация, применяемая для лечения гипоксии тканей
Гипербарическая оксигенация – лечение кислородом под высоким давлением в специальной камере.
Ни для кого ни секрет, что кислород является важным фактором для обеспечения жизнедеятельности организма.
Сущность гипербарической оксигенации заключается в следующем: в одноместные удобные барокамеры подается кислород под давлением, выше атмосферного. Для каждого пациента индивидуально назначается дозировка кислорода. Так процедура переноситься комфортно и легко, не причинная дискомфорта пациенту. Обычно сеанс длиться около 50 минут, для полного курса необходимо 8 – 10 сеансов.
Гипербарическая оксигенация применяется при огромном спектре заболеваний в связи с тем, что повышение содержания кислорода в тканях благотворно влияет на состояние здоровья, мобилизует защитные функции организма. Такая терапия может применяться в качестве основной, а также в качестве дополнительного лечения.
ГБО является важным способом лечения при следующих нарушениях:
Воздушной и жировой эмболии
Газовой гангрене
При острых отравлениях
Тромбозе
15. Понятие идеального раствора.
идеальный – раствор, в котором не происходит взаимодействия молекулв-ваи молекул растворителя, при образовании идеального раствора не изменяется объемр-ра,нет тепловых эффектов особенность идеального раствора –
давление насыщенного пара любого компонента раствора пропорционально концентрации компонента в растворе насыщенный – пар, который находится в равновесии с жидкостью в закрытой системежидкость газ:
сколько пара образуется при испарении жидкости, столько пара конденсируется, превращаясь в жидкость давление насыщенного пара жидкости при данной температуре постоянно для данной жидкости при повышении температуры давление насыщенного пара жидкости увеличивается к свойствам идеального раствора приближен разбавленный р-р неэлектролита
16. Что называется диффузией? Чем обусловлен этот процесс?
Диффузия – взаимное проникновение молекул-атомов-ионами веществ между молекулами- атомами- ионами других веществ.
-В результате теплового(броуновского) движения молекул-атомов-ионов
-В направлении увеличения энтропии системы
Диффузия наблюдается у газов- жидкостей- твердых тел в растворах за счет диффузии происходит выравнивание концентрации веществ:
Вещество из области высокой концентрации перемещается в область низкой концентрации.
Концентрационный градиент
при диффузии вещество из области высокой концентрации перемещается в область низкой концентрации разность концентраций С двух точек, отнесенная к расстоянию х между ними, есть концентрационный градиент
С / х = grad С
Процесс обусловлен хаотическим тепловым движением молекул (атомов) в одно- или многокомпонентных газовых либо конденсирированных средах.
17. Закон Фика для скорости диффузии. Математическое выражение, анализ уравнения.
Закон Фика:
где dm – изменение количества вещества (масса вещества, переносимого путем диффузии); dx dc – градиент концентраций в направлении x; dS – площадь поперечного сечения, через которое диффундирует вещество; dτ – продолжительность диффузии; D – коэффициент диффузии (коэффициент пропорциональности).
анализ уравнения:
скорость диффузии тем больше – чем больше коэффициент диффузии-градиент концентрации-площадь мембраны
18. Математическое выражение коэффициента диффузии. Анализ уравнения.
Коэффициент диффузии численно равен количеству вещества, пере- носимого путем диффузии в направлении x при градиенте концентрации dx dc = 1, через сечение в 1 единицу площади за 1 единицу времени. Коэф- фициент диффузии имеет размерность м2 /c. Концентрация в уравнениях (1) и (2) измеряется в кг/м3 или моль/м3 . Знак (–) в уравнении (1) позволяет выразить массу вещества, переносимого путем диффузии, в виде положи- тельного числа, так как градиент концентраций – это величина отрица- тельная (движение веществ осуществляется в направлении уменьшения концентрации). Коэффициент диффузии может быть рассчитан по уравнению Стокса- Эйнштейна:
R – универсальная газовая постоянная (8,314 Дж/(моль·К)); Т – температура; NA – число Авогадро; η – коэффициент динамической вязкости среды, в которой происходит диффузия; r – радиус диффундирующих частиц.
Таким образом, коэффициент диффузии зависит от природы диффундирующего вещества (размера частиц), от природы среды, в которой осуществляется диффузия (вязкости среды) и от температуры. Коэффициент диффузии увеличивается с ростом температуры и снижается с увеличением размера диффундирующих частиц и с повышением вязкости среды.
анализ уравнения:
-чем больше температура, тем больше коэффициент диффузии
-чем меньше вязкость среды, тем больше коэффициент диффузии
-чем меньше радиус частиц в-ва,тем больше коэффициент диффузии
радиус частиц в-ваувеличивается с ростом молярной массы
поэтому чем больше молярная масса в-ва,тем меньше коэффициент диффузии
19. Значение диффузии в биологических процессах.и
В организме диффузия происходит через мембраны. В легких диффундирую кислород и углекислый газ. Энергетический обмен и скорость всех биологических процессов связаны с диффузией, так как продукты пищеварения диффундируют к стенкам кишечника – в кровь – в клетки. В тоже время происходит обратная диффузия продуктов метаболизма: из клеток – в кровь – в выделительную систему. Диффузия в живых системах зависит от свойств ткани. значение диффузии в биологических процессах:
-скорость обмена в-взависит как от скорости реакций обменав-в,так от скорости движения реагирующихв-вдвижение реагирующих веществ в клетках и межклеточномв-веобусловлено диффузией скорость движения реагирующих веществ в клетках и межклеточномв-веопределяется скоростью диффузии
-питательные вещества и продукты обмена в межклеточном в-веи в клетках перемещаются путем диффузии
-диффузия лежит в основе пассивного транспорта веществ через клеточные мембраны
различают простую диффузию, ограниченную диффузию, облегченную диффузию облегченная диффузияслужит для транспорта крупных ионов и молекул или молекул жиронерастворимыхв-вдля нихиз-забольшого размера транспорт ч/з клеточные поры невозможен путь транспорта – ч/з мембранубелками-переносчиками(транслоказами)
на внешней стороне мембраны вещество и транслоказы образуют комплексное соединение SX комплексное соединение SX жирорастворимо и диффундирует в липидах мембраны
на внутренней стороне мембраны комплексное соединение SX распадается, и в-вопопадает внутрь клетки ПР: транспорт углеводов и аминокислот
20. Сущность пассивного транспорта веществ, облегченной диффузии, активного транспорта.
В живых организмах различают три вида переноса веществ:
- Пассивная диффузия – характерна для низкомолекулярных веществ ( О2, СО2)
- Облегченная диффузия. Многие вещества не могут свободно проходить через клеточные мембраны, в этом случае они связываются с белками, приобретают способность растворяться в мембранах и проходят через нее (диффузия углеводов)
- Активный транспорт – перенос вещества из области меньшей концентрации в область большей концентрации, против градиента концентрации. Требует определенных энергетических затрат, за счет молекул АТФ
21. Перечислите коллигативные свойства растворов. Чем они обусловлены?
Растворы имеют ряд свойств, которые зависят от количества растворенных частиц, но не зависят от их размеров и заряда. Именно поэтому, такие свойства называются коллигативными.
К ним относятся:
- Осмотическое давление
- Осмос
- Понижение давления насыщенного пара растворителя над раствором
- Повышение температуры кипения растворов по сравнению с чистым растворителем
- Понижение температуры замерзания растворов по сравнению с чистым растворителем.
Обусловлены только самопроизвольным движение молекул, то есть они определяются не химическим составом, а числом кинетических единиц – молекул в единице объема или массы
22. Понятие о насыщенном паре. Охарактеризуйте состояние системы.
Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называется насыщенным.
Данимическое равновесия – число молекул, покидающих жидкость в единицу времени, равно числу молекул, возвращающихся в жидкость.
Описать состояние ненасыщенной пары можно используя законы идеального газа, а состояние насыщенного пара - по уравнению Клапейрона-Менделеева при низких температурах и малых концентраций:
рН = ρн ∙ RT / μ
По мере увеличения температуры жидкости интенсивность испарения увеличивается. Испарение происходит при любой температуре. Особым видом испарения является процесс кипения.
23. Закон Рауля относительно понижения давления насыщенного пара. Математическое выражение, анализ уравнения.
Относительное понижение давления насыщенного пара растворителя над раствором рано мольной доле растворенного вещества.

24. Объясните снижение давления насыщенного пара растворителя над раствором.
Понижение давления пара над раствором находит свое отражение на диаграмме состояния. Рассмотрим диаграмму состояния воды и раствора нелетучего компонента (рис.16). Согласно закону Рауля при любой температуре давление водяного пара над водным раствором ниже, чем над водой. Поэтому кривая фазового перехода от жидкого состояния к пару для раствора расположена ниже, чем для чистой воды. Аналогично изменяется положение кривой плавления. Обе кривые для раствора будут располагаться тем дальше от соответствующих кривых воды, чем больше концентрация раствора.
Давление насыщенного пара растворителя над раствором (Р) всегда меньше, чем над чистым растворителем (Ро). Это связано с тем, что поверхность раствора частично занята сольватированными молекулами растворенного вещества, благодаря чему уменьшается поверхностная концентрация молекул самого растворителя, а, следовательно, и скорость его испарения.
Понижение давления пара раствора — разность между давлением пара растворителя (р0) и давлением пара раствора
Понижение давления пара раствора прямо пропорционально мольной доле растворенного вещества в растворе или пропорционально отношению числа молей растворенного вещества к общему числу молей, содержащихся в растворе:
где n— число молей растворенного вещества; п0 — число молей растворителя.
ΔР, отнесенная к P0, называется относительным понижением давления пара растворителя
25. Закон Рауля относительно повышения температуры кипения и понижения температуры замерзания растворов. Математическое выражение.
Следствия из закона Рауля:
· Растворы кипят при более высокой температуры, чем чистый растворитель
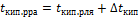 , где
, где 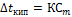
· Растворы замерзают при более низких температурах, чем чистый растворитель
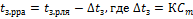
26. Объясните повышение температуры кипения растворов.
Кипение представляет собой фазовый переход, при котором происходит превращение жидкости в пар. Температурой кипения жидкости называют ту температуру, при которой давление насыщенного пара над данной жидкостью равна внешнему. При этой температуре и соответствующем ей давлении насыщенного пара устанавливается равновесие между жидкой и газообразной фазами: скорость испарения равна скорости обратного процесса – конденсации и обе эти фазы могут сосуществовать в течение длительного времени.
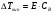 , где
, где
Е – коэффициент пропорциональности, численно равный повышению температуры кипения раствора, содержащего 1 моль растворенного вещества в 1000г растворителя, при условии, что раствор этой концентрации обладает свойствами идеального. Такое повышение температуры кипения называется молярным или эбуллиоскопической постоянной.
Величина Е зависит только от свойств растворителя и может быть найдена либо опытным путем, либо рассчитана по термодинамическому соотношению
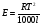 , где
, где
Т – температура кипения чистого растворителя по аб. шкале
l – удельная теплота испарения растворителя
R – универсальная газовая постоянная
Св – концентрация раствора, выражаемая обычно в молях растворенного вещества на 1000 г растворителя.
Если Мв – молярная масса растворенного вещества, mв – его масса (в г), а mА – масса растворителя в граммах, то Св будет определяться следующим соотношением

27. Объясните понижение температуры замерзания растворов.
Понижение давления пара над растворами приводит к тому, что они кипят и замерзают при температурах, отличающихся от соответствующих температур для чистых растворителей. Известно, что жидкость закипает, когда давление ее насыщенного пара становится равным внешнему давлению, а кристаллизация жидкости начинается в тот момент, когда давление ее насыщенных паров становится равным давлению над твердой фазой, в которую она переходит. Поэтому растворы кипят при более высоких температурах (tК р-ля), а замерзают при более низких температурах (tЗ р-ля), чем чистые растворители (tЗ р-ля)
28. Физический смысл эбулиоскопической и криоскопической констант. Расчет молекулярной массы вещества по температурам кипения и замерзания растворов.
Законы Рауля можно использовать для определения молекулярных масс (Мр-го) растворенных веществ:
ΔtК = Е ∙ См = Е ∙ 
отсюда
Мр-го = 
и аналогично по понижению температуры замерзания
М = 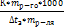
Физический смысл эбуллиоскопической константы: численно равна повышению температуры кипения раствора с концентрацией 1 моль/1000 г растворителя.
Физический смысл криоскопической постоянной: численно равна понижению температуры замерзания раствора с концентрацией 1 моль/1000 г растворителя.
29. Понятие об осмосе. Движущая сила процесса.
Осмос - это процесс самопроизвольной односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону с большей концентрацией растворенного вещества из объема с меньшей концентрацией растворенного вещества.
Движущей силой осмоса является стремление к выравниванию концентрации растворенного вещества по обе стороны мембраны.( является разность химических потенциалов растворителя и раствора)
30. Понятие о полупроницаемых мембранах, их виды.
Полупроницаемой мембраной называется плёнка, пропускающая молекулы растворителя и не пропускающая молекулы растворённого вещества.
Полупроницаемые мембраны бывают пористыми и непористыми. Через непористые мембраны растворитель и растворенные вещества проникают под действием градиента концентрации в результате молекулярной диффузии. Поэтому эти мембраны называют диффузионными. Они представляют собой квазигомогенные гели. Скорость диффузии компонентов через эти мембраны зависит от энергии активации при взаимодействии частиц компонентов с материалом мембран.
Диффузионные мембраны применяются для разделения компонентов с близкими свойствами, но с молекулами различных размеров.
Диффузионные мембраны обычно применяют для разделения газовых и жидких смесей методом испарения через мембрану.
Для проведения процессов обратного осмоса и ультрафильтрации применяют пористые мембраны, изготовляемые в основном из полимерных материалов. Полимерные мембраны могут быть анизотропными и изотропными.
Мембрана с анизотропной структурой состоит из тонкого поверхностного слоя на микропористой «подложке». Разделение происходит на поверхностном активном слое, и практически весь перепад давления приходится на этот слой.
Изотропные мембраны образуются при облучении тонких полимерных пленок заряженными частицами с последующим травлением химическими реагентами. Выпускают изотропные мембраны на основе поликарбонатных пленок.
В промышленности применяют следующие полимерные мембраны: целлюлозные, на основе эфиров целлюлозы, акрилонитриловые, нейлоновые, поливинилхлоридные, изготовленные на основании поликарбонатов и полисульфонов.
31. Осмотическое давление. Закон Вант-Гоффа. Анализ уравнеия.
Осмотическое давление - это минимальное гидроскопическое давление, которое нужно приложить к раствору, чтобы осмос прекратился.
Закон Вант-Гоффа: осмотическое давление растворов неэлектролитов равно тому газовому давлению, которое бы произвольно растворило растворенное вещество, будучи в газообразном состоянии и занимая тот же объем, что и весь раствор 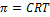
анализ уравнения:
-при равных концентрациях и температуре р-рыразныхв-всоздают одинаковое осмотическое давление
-для осмотического давления важно число частиц, размеры частиц значения не имеют
32. Понятие об осмомолярности и осмомоляльности. Осмометрия.
Осмомолярность – количество всех осмотически активных частиц, находящихся в 1 л рра
Осмомоляльность - количество всех осмотически активных частиц, находящихся в 1 кг рля
Осмометрия– совокупность методов и технических приемов измерения величины осмотического давления, осмометрию применяют для определения молекулярной массы биополимеры, при исследовании водно-солевого баланса.
33. Понятие об изотонических растворах. Осмотическое давление крови человека. Физиологический раствор.
Изотонические растворы – это растворы, которые имеют одинаковое осмотическое давление.
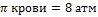
Физиологические растворы – это растворы изотонической плазмы крови.
0,9 % NaCl
0,3%C6H12O6
34. Понятие о гипотонических и гипертонических растворах. Применение гипертоничеких растворов.
Если осмотическое давление раствора выше, чем у сравниваемого, то говорят, что этот раствор гипертонический. В медицине используют 10 и 20 % растворы NaCl, как солевые примочки, для лечения гнойной ангины. Применяют молевые слабительные и концентрированные растворы для лечения глаукомы.
Если осмотическое давление ниже, чем у сравниваемого, то его называют гипотоническим. Гемолиз – лизис эритроцитов (разрыв клеточной мембраны эритроцитов) гипотонические растворы применяются для лечения обезвоживания организм
35. Биологическая роль осмоса. Тургор, плазмолиз, лизис.
осмос определяет высокое содержание воды в внутриклеточном и межклеточном веществе вода же в клетках и межклеточном веществе – необходимое условие нормального обмена веществ
-осмотическое давление внутриклеточных р-ров определяет упругость или тургор клеток и тканей
-биологические жидкости создают осмотическое давление за счет растворенных в них в-в осмотическое давление удерживает р-тель в р-ре и «засасывает» р-тель из менее концентрированного р-ра гидравлическое давление р-ра действует в противоположном направлении осмотическое давление р-ра за счет растворенных белков называется онкотическим давлением
онкотическое давление р-ров, насыщенных белками, соизмеримо с их гидравлическим давлением онкотическое и гидравлическое давление биологических жидкостей в организме сбалансировано при болезнях этот баланс нарушается ПР: если при болезни уменьшается содержание белков в крови,
то вода уходит из крови в межклеточное в-во тканей – ткани отекают, возникают отеки
-клетки в гипертоническом р-ре теряют внутриклеточную воду и сморщиваются – происходит плазмолиз
клеток
-клетки в гипотоническом р-ре набухают до разрыва клеточной оболочки – происходит лизис клеток
-при запорах применяют
36. Физико-химические основы действия солевых слабительных.
ПР: глауберова сольNa2SO4*10H2O
действие солевых слабительных основано на образовании в просвете кишечника р-раконцентрированных солей, которые сами плохо всасываются, а за счет высокого осмотического давления активно поглощают воду из ..
в итоге, объем каловых масс увеличивается, и активизируется перистальтика кишечника
В результате гипертонических р-ровэтих солей в просвете кишечника устремляется большое ко-во воды через слизестую оболочку. или
Солевые слабительные из-за плохой диффузии через кишеч ную стенку препятствуют всасыванию воды, а также пищи и жид кости, выделяющейся с секретом пищеварительных желез. Гипер тонические растворы солей способствуют диффузии воды в просвет кишечника, а также стимулируют желудочную и кишечную секрецию. Жидкость, скапливаясь в кишечнике, механически раздражает рецепторы слизистой оболочки, усиливает перис тальтику, давая послабляющий эффект. Слабительное действие сульфатов в какой-то степени обусловлено образованием в ки шечнике сероводорода, а действие солей магния - образованием магнезиальных мыл. Солевые слабительные действуют на всем протяжении кишечника.
37. Онкотическое давление. Его биологическое значение.
осмотическое давление р-ра за счет растворенных белков называется онкотическим давлением онкотическое давление р-ров, насыщенных белками, соизмеримо с их гидравлическим давлением онкотическое и гидравлическое давление биологических жидкостей в организме сбалансировано при болезнях этот баланс нарушается ПР: если при болезни уменьшается содержание белков в крови,
то вода уходит из крови в межклеточное в-во тканей – ткани отекают, возникают отеки
38. Сущность Эффекта Доннана( распределение электролитов между клеткой и средой), биологические значение.
эффект Гиббса-Доннана- неравномерное распределение электролитов между клеткой и межклеточнымв-вом
-межклеточное в-вои цитоплазма клетки - растворы электролитов, при этом в цитоплазме есть белки в видеанионов, и белков, практически, нет в межклеточномв-ве
-эти растворы разделены полупроницаемой клеточной мембраной
-мембрана проницаема для ионов Сl- и непроницаема для белков
-межклеточное в-вои цитоплазма клетки - электронейтраленые растворы
-подвижные анионы Сl- уравновешивают заряд катионов в клетке и в межклеточномв-ве
например, равновесие зарядов в межклеточном в-веи цитоплазме клетки описывается уравнениями
+] = [Сl -e][К+i] = [Сl -i]+[Prot-]
в клетке заряд недиффундирующих белков-анионовдолжен быть уравновешен большей концентрацией катионов К+ и меньшей концентрацией анионов Сl-
биологическое значение доннановского равновесия:
в результате неравномерного распределения ионов К+ и Сl- возникает мембранный потенциал.
В живых тканях всегда наряду с растворами белков и их солей, присутствуют также ионы обычных электролитов (NaCI, KCI, CaСI2, Na2HPO4, NaHCO3).
Присутствие в организме солей белков, отделенных клеточной мембраной от растворов электролитов, приводит к перераспределению электролитов и соответственно влияет на осмотическое давление по обе стороны мембраны. Перераспределение электролитов подчиняется уравнению мембранного равновесия, выведенного Доннаном.
где: х – количество ионов, прошедших через мембрану внутрь клетки; С(Н) – количество ионов электролита снаружи мембраны; С(В) – количество ионов электролита внутри клетки.
В присутствии полиэлектролитов всегда наблюдается явление перераспределения ионов через мембрану (эффект Доннана), что будет сказываться на осмотическом давлении, величине биопотенциалов. Поэтому, в живом организме эффект Доннана является одной из причин сложных процессов изменения осмотического давления, изменения мембранного потенциала, ввиду перераспределения электролитов в присутствии полиэлектролитов - белков.
39. Как и почему отличаются коллигативные свойства растворов электролитов и неэлектролитов.
Раствор неэлектролита состоит из растворителя и растворенного вещества в виде недиссоциированных молекул. Коллигативными свойствами раствора неэлектролита являются свойства, которые зависят от концентрации и практически не зависят от природы неэлектролита. К таким свойствам относятся:
Относительное понижение давления насыщенного пара растворителя над раствором (Iзакон Рауля)
Понижение температуры замерзания (IIзакон Рауля)
Повышение температуры кипения (IIзакон Рауля)
Осмотическое давление раствора (закон Вант-Гоффа)
III. Коллигативные свойства растворов электролитов.
Раствор электролита состоит из растворителя и растворенного вещества (электролита), которое частично или полностью диссоциирует на ионы. В растворе число частиц в результате диссоциации увеличивается. Коллигативные свойства растворов электролитов описываются уравнениями с поправочным множителем – изотоническим коэффициентом ( i), учитывающим процесс диссоциации
Температура кипения р-ровэлектролитов выше расчетной для эквимолярного раствора неэлектролитов температура замерзанияр-ровэлектролитов ниже расчетной осмотическое давлениер-ровэлектролитов выше расчетного
причина в большем количестве активных частиц в-вавр-реэлектролита за счет образования ионов.
40. Изотонический коэффициент, физический смысл.
для расчетов свойств растворов электролитов вводится коэффициент Вант-Гоффаилиизотонический коэффициент, которыйравен отношению параметров р-ра электролита и параметров эквимолярного раствора неэлектролита
| эл | T | Tзамерз эл | |||||
| I== | = | кип эл | = | ||||
| неэл | Tкип неэл | Tзамерз неэл | |||||
Физический смысл изотонического коэффициента состоит в том, что он учитывает увеличение количества частиц в растворе электролита по сравнению с раствором неэлектролита той же концентрации
41. Уравнение для расчета коллигативных свойств электролитов.
1) Осмотическое давление (з.Вант-Гоффа):  =СмRT
=СмRT
2) давление насыщенного пара растворителя над раствором (Закон Рауля): P=a*P0
3) температура кипения раствора (1следствие из закона Рауля): tкип= Е*Сm
4) температура кристаллизации раствора (2 следствие из закона Рауля)tзам=k*С
42. Зависимость изотонического коэффициента от разбавления раствора.
изотонический коэффициент увеличивается при разбавлении р-раэлектролитаизотонический коэффициент максимальный при max разбавлениир-ра
при этом изотонический коэффициент равен числу ионов, на которые диссоциирует 1 молекула электролита ПР: для NaCl максимальный изотонический коэффициент равен 2
коэффициент Вант-Гоффа рассчитывают по формуле
где N – число молекул электролита или число молекул эквимолярного раствора неэлектролита,n – число молекул, распавшихся на ионы,
m – число ионов, образующихся из одной молекулы электролита,mn – число ионов
(N - n) + mn – число молекул и ионов в растворе электролита,
- степень электролитической диссоциации, которая равна = n / N анализ уравнения:
чем больше число ионов, образующихся из одной молекулы электролита, тем больше коэффициент чем больше степень электролитической диссоциации, тем больше коэффициент
в связи с тем, что природа в-в-концентрация-температура-посторонниеионы влияют на степень диссоциации,
| эти факторы влияют на изотонический коэффициент | |||||||||
| изотонический коэффициент определяют опытным путем по уравнению | |||||||||
|
| |||||||||
|
| |||||||||
|
| |||||||||
| изотонический коэффициент используют | |||||||||
| - для расчета степени электролитической диссоциации по уравнению | |||||||||
| - для расчёта коллигативных свойств электролитов | |||||||||
|
| |||||||||
растворы электролитов изотоничны при равной концентрации молекул-ионов и равной температуре
43. Сильные и слабые электролиты. Степень диссоциации. Какие факторы и как влияют на степень диссоциации.
Различают «сильные электролиты» и «слабые электролиты»:
(для 0,1М растворов)«сильные» >0,3(30%), «слабые» <0,03(3%), «средние»=0,3-0,03(3-30%)ПР: «сильные» – соли(!малорастворимые соли)
щелочи Са(ОН)2 многие неорганические кислоты
«слабые» - почти все органические кислоты многие неорганические кислоты многие основания + NH4OH, H2O
Активность электролитической диссоциации характеризуется степенью электролитической диссоциации,
степень электролитической диссоциации рассчитывается по формуле
 = n / N,
= n / N,
где n - число диссоциированных молекул,
N - общее число молекул экспериментальное определение степени диссоциации,
Зависимость степени диссоциации от различных факторов
на степень электролитической диссоциации влияют:
-природа растворителя чем полярнее молекулы р-теляи больше его диэлектрическая проницаемость, тем сильнее диссоциация
-природа в-вачем полярнее молекулыв-ва,тем сильнее диссоциация
-концентрация раствора (для слабых электролитов)
при снижении концентрации раствора степень электролитической диссоциации увеличивается
-температура (
при нагревании степень электролитической диссоциации увеличивается
44. Экспериментальное определение степени диссоциации. Расчет степени по изотоническому коэффициенту.
Активность электролитической диссоциации характеризуется степенью электролитической диссоциации,
степень электролитической диссоциации рассчитывается по формуле
 = n / N,
= n / N,
где n - число диссоциированных молекул,N - общее число молекул экспериментальное определение степени диссоциации,
расчёт степени диссоциации по изотоническому коэффициенту
45. Константа диссоциации. Какие факторы влияют на константу диссоциации? Выведите константу диссоциации хлорноватистой кислоты.
слабые электролиты диссоциируют неполностью
при электролитической диссоциации слабых электролитов устанавливается хим.равновесие
хим.равновесие – состояние системы реагирующих в-в, где скорости «прямой» и «обратной» реакций равны
при электролитической диссоциации слабых электролитов справедлив закон действующих масс
| при Т=const скорость хим.реакции пропорциональна произведению молярных концентраций реагирующих в-в, | ||||||
| взятых в степенях равных коэффициентам в-вв уравнении хим.реакции | ||||||
| ПР: СН СООН H+ + СН СОО- | ||||||
| 3 | 3 | |||||
| 1=k1С(СН3СООН) | 2=k2С(H+) С(СН3СОО-) | k1[СН3СООН]= k2[H+] [СН3СОО-] | ||||
| 1= 2 | k1С(СН3СООН) = k2С(H+) С(СН3СОО-) | |||||
| K | k1 |
| [CH3COO-][H] | , где K – константа равновесия реакции диссоциации или константа | ||
| k2 | [CH3COOH] | |||||
диссоциации
ПР: константа диссоциации хлорноватистой кислоты..
константа диссоциации слабых электролитов зависит от природы р-теля, электролита,
температуры:
-чем полярнее р-тельи активнее диссоциация, тем больше константа диссоциации
-чем сильнее электролит и активнее диссоциация, тем больше константа диссоциации
-чем выше температура и активнее диссоциация, тем больше константа диссоциации
соотношение констант диссоциации в многоступенчатом процессе рассчитывают по формуле
К = К1 К2 К3, причем К1 >К2 >К3
ПР: константы диссоциации фосфорной кислоты для всех ступеней процесса..
слабые электролиты диссоциируют неполностью факторы, влияющие на степень диссоциации слабых электролитов
- при разведении р-растепень диссоциации слабых электролитов увеличивается *закон Освальда для слабых электролитов
| K | С 2 | , если <<1, то |
|
| К | ||
| 1 |
| С | |||||
ПР: на примере уксусной кислоты..
- при добавлении в р-рслабого электролита сильных электролитов с общими ионами - константа диссоциации уменьшается,
сильных электролитов, не имеющих общие ионы,- константа диссоциации зависит от ионной силы р-ра
при растворении малорастворимых солей и малорастворимых оснований их молекулы распадаются на ионы в насыщенном р-ре таких электролитов устанавливается равновесие междув-вомв осадке и ионами в растворе ПР:AgClтв Ag+ + Cl-
константа такого равновесия имеет вид (в общем случае нужно учитывать коэффициенты равновесной реакции)
46. Выведите математическое выражение закона разведения Оствальда на примере уксусной кислоты. Формулировка закона.


Пусть исходная концентрация – с, степень диссоциации-  .
.
K= c*  /c-c*
/c-c*  ; k=c
; k=c  2/1-
2/1-  ( величиной 1- альфа можно пренебречь, т.к. уксусная кислота слабый электролит альфа<3 и дробь в целои фактчески не изменяется. ; k=c
( величиной 1- альфа можно пренебречь, т.к. уксусная кислота слабый электролит альфа<3 и дробь в целои фактчески не изменяется. ; k=c  2 -
2 - 
47. Ступенчатая диссоциация вещества. Напишите выражение констант диссоциации фосфорной кислоты для всех ступеней процесса. Объясните соотношения констант диссоции в многоступенчатом процессе.
многоосновные кислоты диссоциируют ступенчато
ПР: H2SO4 H+ + HSO4- 1
HSO4- H+ + SO42- 2< 1
снижение степени диссоциации определяется
-накоплением ионов и смещением динамического равновесия,
-большими затратами энергии на отрыв H+от ионаHSO4-,чем затраты энергии на отрывH+отH2SO4 многокислотные основания диссоциируют ступенчато..
48. Сущность теории сильных электролитов.
сильные электролиты диссоциируют полностью
образующиеся ионы окружаются сольватной(гидратной) оболочкой из полярных молекул растворителя(воды)
*Дебай-Гюккель
ионы в растворах электролитов взаимодействуют между собой образующиеся ионы окружаются оболочкой из ионов электролита противоположного знака
в итоге, р-р сильного электролита представляет собой сложную систему ионов, окруженных оболочками противоионов оболочки тормозят движение ионов в электрическом поле при пропускании тока ч/з р-р электролита
степень электролитической диссоциации, рассчитанная по электропроводности р-ра, оказывается ниже реальной такая расчетная степень диссоциации есть "кажущаяся степень диссоциации"
49. Объясните, почему для растворов сильных электролитов применяют понятие «кажущейся степени диссоциации».
В растворах сильных электролитов в результате увеличения конц. Ионов велики силы меж ионного в/д. Каждый ион окружен сферой из противоионов, ионы не свободны друг от друга.
Ионы растворов электролитов в/д друг с другом и накладывают отпечаток на ряд свойств растворов сил.электролитов. При наложении электрического поля происходит происходит торможение движения ионов за счет наличия противоионов в ра-ре. Межионное в/д влияет не только на скорость движения ионов, но и на коллигативные св-ва р-ров мил.электролитов. созжается впечатление, что р-р электролитов диссоциирует не полностью. Поэтому вводят понятие кажущейся степени диссоциации.
50. Понятие об активности ионов. Коэффициент активности.
Активность –рассчетная ТД функция. Равна моляльная концентрация умножить на коэффициент активности. Она показывает отклонение свойств данного компонента в реальном растворе от его свойств в идеальном растворе той же концентрации. Активность – условная или эффективная концентрация того или иного иона в соответствии с которой он проявляет себя в химических реакциях. Коэффициент активности ( f ) показывает во сколько раз эффективная концентрация иона отличается от реальной концентрации ионов в растворе.
F меньше 1, но может стремиться к 1(при разбавлении). Однако при очень большой концентрации f может быть = 1.
51. Ионная сила раствора. Покажите расчет на конкретном примере.
Ионная сила- коллигативная характеристика межионного взаимодействия. Это полусумма моляльной концентрации каждого иона, умноженной на квадрат его заряда. I=Ʃ Cm*Z2
CaCl2óCa+2Cl моляльная концентрация ионов кальция=0.02, а ионов хлора = 0.04
I=1/2*0.02*22+0.04*(-1)2
52. Предельный закон Дебая-Хюккеля для коэффициента активности, математическое выражение.
для разбавленных растворов электролитовесли ионная сила р-ров одинаковая, то для ионов одинакового заряда коэффициенты активности равны независимо от их химической природы а
нализ уравнения:
при максимальном разведении коэффициент активности равен единице при увеличении концентрации электролитов коэффициент активности уменьшается
при очень высокой концентрации р-ровэлектролитов коэффициент активности увеличивается
(не хватает молекул растворителя на образование сольватных оболочек)
свойства растворов электролитов
коллигативные – «общие» свойства коллигативные - свойства растворов электролитов «общие» для всех растворов
коллигативные свойства не зависят от природы электролита коллигативные - свойства растворов электролитов, если эти растворы рассматривать как идеальные
при этом при вычислении одного коллигативного параметра определяются другие параметры ПР: давление насыщенного пара,
температура кипения и температура замерзания, осмотическое давление
53. Общая, активная и потенциальная кислотность. Методы определения каждого вида кислотности.
Кислотность растворов слабых кислот состоит з трех видов кислотности: 
Активная кислотность измеряется активностью(концентрацией) свободных ионов водорода в растворе.
Потенциальная кислотность измеряется кол-вом ионов водорода, связанных в молекулах кислоты, т.е. представляет собой «запас» недиссоциированных молекул кислоты.
Общая кислотность( аналитическая, титруемая) равна сумме активной и потенциальной кислотностей, которая определяется общей концентрацией кислоты.
Дата добавления: 2020-04-25; просмотров: 1081; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

