Электроды 1 и 2 рода примеры.
1 рода- эл-ды обратимые относительно или К или А(цинковый, медный, газовые)Представляют собой Ме опущенный в р-р собственной соли.
2 рода- эл-ды обратимые относительно и К и А.(каломельный) Электродный потенциал зависит от конц К и А(хлорсеребрянный) Представляют собой трехфазную сис , в которой Ме покрыт труднорастворимой солью и погружен в рр,содежащий А этой соли.
Устройство и сущность работы хлорсеребрянного эл-да. Уравнение Нернста для потенциала хлорсеребрянного электрода.
Эл-д 2 рода состоит из Ме нерастворимой соли этогго Ме и 2 хорошо растворимого электролита с тем же Анионом
Ме /МеА/ А-
Ag /AgCl /Cl-
Ag<-> 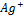 + e AgCl+e<->
+ e AgCl+e<->  + Cl-
+ Cl-
Реакция причина возникновения природного потенциала
Уравнение Нернста для этого процесса: 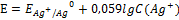
Т.к. ПР AgCl = 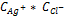 --à
--à 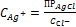
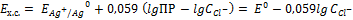
Потенциал зависит от активности ионов Cl .
Т.е. электрод обратим относительно анионов.
Если взять насыщенный р-р KCl, то концентрация ионов Cl будет постоянной.
В таком случае потенциал хлорсеребряного электрода=0,197В.
Хлорсеребряный электрод из-за постоянства электродного потенциала используют в качестве электрода сравнения в место стандартного водородного электрода (он удобен в изготовлении).

Понятие о окислительно-восстановительных (редокс-системах) электродах и потенциалах.
-эл-ды в которых материал электрода в окислительно-восстановительном процессе не участвует , он является только переносчиком електронов. Представляют собой систему, содержащую окислительную и восстановительную формы одного и того же ве-ва. В его р-р опущен инертный металлический электрод(Pt.Au) который является или поставщиком электронов или их переносчиком.
|
|
|
Если в системе преодладают окис.формы- процесс восстановления “+” : 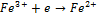
Если преобладают вос.формы- процесс окисления “-”: 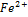 ->
-> 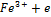
Уравнение Ненста-Петерса: 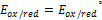 +
+ 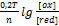
n- кол-во электронов,которые передаются от одной формы к другой.
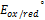 - потенциал окислительно-восстановительной системы, в которой соотношение окислительной и восстановительной форм равно 1.
- потенциал окислительно-восстановительной системы, в которой соотношение окислительной и восстановительной форм равно 1.
1 вида: OX+ze Red
2 вида: OX+ze+m 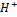 Red
Red
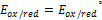 +
+ 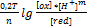
40. Механизм возникновения редокс – потeнциала.
-эл-ды в которых материал электрода в окислительно-восстановительном процессе не участвует , он является только переносчиком. Представляют собой систему, содержащую окислительную и восстановительную формы одного и того же вева. В его р-р опущен инертный металлический электрод(Pt.Au) который является или поставщиком электронов или их переносчиком
2 вида редокс систем: 1) без участия ионов водорода: Fe+3/Fe+2
| Pt |
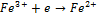 направление реакции зависит от того с чем соединяется платина. Если в начальный момент преобладает присоединение электронов, то на Pt возникает “+” заряд обусловленный недостатком электронов, и наоборот.
направление реакции зависит от того с чем соединяется платина. Если в начальный момент преобладает присоединение электронов, то на Pt возникает “+” заряд обусловленный недостатком электронов, и наоборот. |
|
|
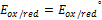 +
+ 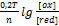
2)2й тип редокс системы с участием ионов водорода:
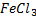
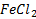
|
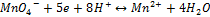
ox red
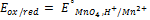 +
+ 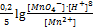
В данном случае – это потенциал системы, когда концентрация ox формы равна концентрации red формы, кроме иона 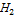 =1. Pt
=1. Pt
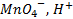
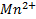
|
Дата добавления: 2020-04-25; просмотров: 955; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
