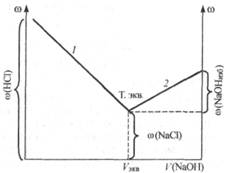
Кондуктометрическое титрование сильной кислоты сильным основанием. Поясните кривую титрования.
Титрование сильной кислоты сильным основанием, например раствора НСl раствором NaOH. При титровании протекает реакция:
Как видно из уравнения, до точки эквивалентности идет эквивалентное замещение ионов Н+ на менее подвижные катионы Na+(u°(H+) > u°(Na+)), в результате чего электрическая проводимость раствора уменьшается (  (NaCl) <
(NaCl) <  (HCl)). За точкой эквивалентности электрическая проводимость возрастает , что связано, во-первых, с увеличением количества ионов за счет избытка титранта (NaOH), во-вторых, с участием в переносе заряда высокоподвижных ионов ОН-. Абсцисса точки на кривой титрования, отвечающая резкому изменению электрической проводимости, соответствует эквивалентному объему щелочи (Vэкв), идущему на титрование раствора анализируемой кислоты.
(HCl)). За точкой эквивалентности электрическая проводимость возрастает , что связано, во-первых, с увеличением количества ионов за счет избытка титранта (NaOH), во-вторых, с участием в переносе заряда высокоподвижных ионов ОН-. Абсцисса точки на кривой титрования, отвечающая резкому изменению электрической проводимости, соответствует эквивалентному объему щелочи (Vэкв), идущему на титрование раствора анализируемой кислоты.
26. Кондуктометрическое титрование слабой кислоты сильным основанием. Поясните кривую титрования.
Титрование слабой кислоты (СН3СООН) раствором силь
ного основания (NaOH)
В данном случае до точки эквивалентности электрическая проводимость возрастает , так как по мере титрования молекулы слабодиссоциирующей кислоты замещаются эквивалентным количеством соли - сильного электролита (  (СН3СООNа) > >
(СН3СООNа) > > 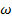 (СН3СООН)).
(СН3СООН)).
За точкой эквивалентности проводимость продолжает возрастать, но более резко, что объясняется появлением избытка сильного основания NaOH.
Понятие о мембранном и диффузионном потенциалах
|
|
|
Диффузионный потенциал- разность потенциалов, возникающая на границе раздела между 2 неодинаковыми по составу или конц р-рами.
Мембранный потенциал- Потенциал, возникающий на мембране с избирательной проницаемостью(пропускающей только ионы одного знака) разделяющий два раствора различного состава .
Механизм возникновения ДЭС н границе раздела Ме- вода. Знак заряда металлической поверхности
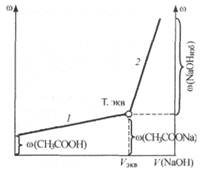
При соприкосновении разнородных фаз, содержащих разнородные частицы, происходит переход через поверхность раздела из одной фазыв другую. И на границе раздела фаз возникает два противоположно заряженных слоя частиц. У одной фазы – положительно заряженные частицы, у другой – отрицательно заряженные частицы. В результате возникает двойной электрический слой.
ДЭС- упорядоченое расположение противоположно заряженных частиц на границе раздела фаз. Устанавливается подвижное равновесие( скорость растворения= скорости осаждения)
1 случай: Ме погружен в воду .Если взять Ме средней активности Zn и погрузить в воду . поверхностные катионы zn взаимодействуют с мол воды (ион дипольное взаимодействие) в результате часть ионов Zn переходит в жидкую фазу и полностью гидратируется .Некоторые ионы возвращаются в кристаллическую решётку, теряя гидратную оболочку. На их место выходят новые ионы и на их месте восстанавливается равновесие. В результате поверхность Me приобретает “–“ заряд за счет избыточных электронов, а пригроничный слой рра заряжается “+” за счет электростатически притягивающихся катионов. Такое разделение зарядов называется – двойной электрический слой. Малоактивные Me также частично растворяются в воде.поверхность их – заряжена,но велечина отриц заряда значительно меньше .
|
|
|
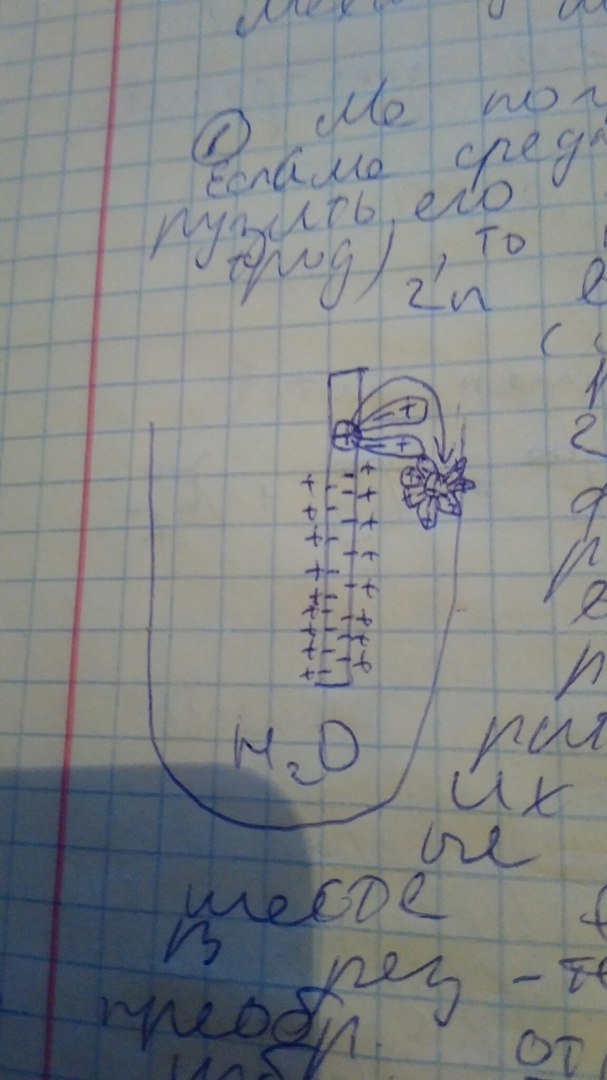 Zn
Zn 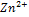 + 2e
+ 2e
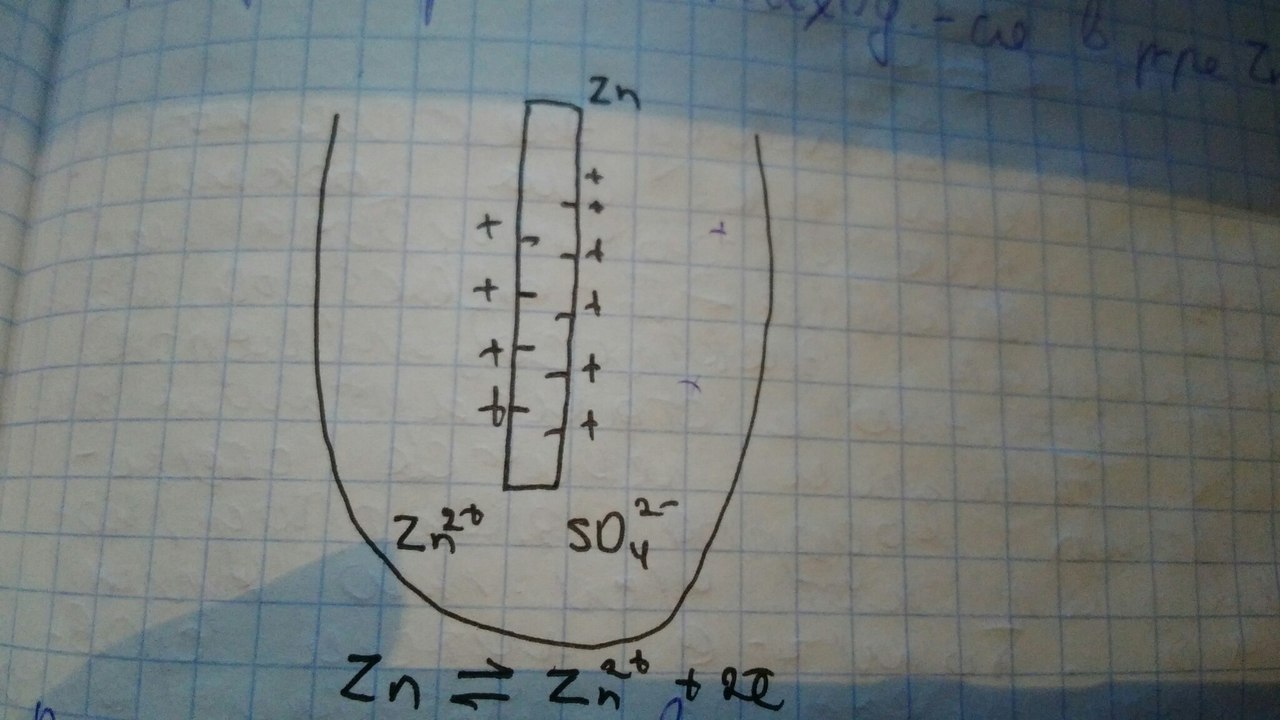
29)Механизм возникновения электродного потенциала в системе Zn +2/ Zn . От чего зависит величина электродного потенциала?
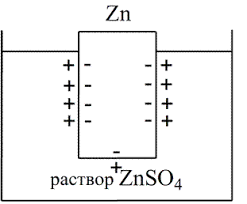 Контакт Ме с р-ром собственной соли: Zn в раре ZnSO4.В раре собственной соли также преобладает выход катионов Zn из кристаллической решетки , но выходу ионов в этом случае мешают ионы zn+2 из рара его соли , поэтому велечина отрицательного заряда цинковой пластинки меньше, чем в случае с H2O. Но и здесь возникает ДЭС => электродный потенциал
Контакт Ме с р-ром собственной соли: Zn в раре ZnSO4.В раре собственной соли также преобладает выход катионов Zn из кристаллической решетки , но выходу ионов в этом случае мешают ионы zn+2 из рара его соли , поэтому велечина отрицательного заряда цинковой пластинки меньше, чем в случае с H2O. Но и здесь возникает ДЭС => электродный потенциал
Причиной возникновения электродного потанцеала ОВР Zn<>zn+2+2e
величина электродного потенциала зависит:
1) От природы Ме
2) От активной концентрации ионов Ме в растворе
3) От температуры
|
|
|
30. Механизм возникновения электродного потенциала в системе 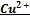 /Cu. От чего зависит величина электродного потенциала?
/Cu. От чего зависит величина электродного потенциала?
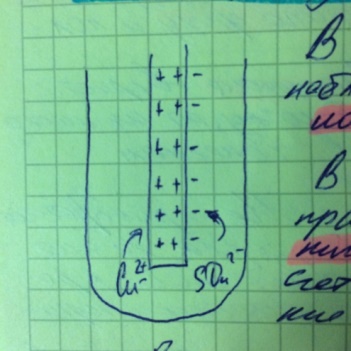
В случае малоактивного Ме наблюдается процесс внедрения ионов 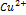 в кристаллическую решетку.
В результате поверхность металла приобретает «+» заряд, а приграничный слой - «-» заряд за счет электростатического притяжения ионов к поверхности Ме.
Причиной возникновения электродного потенциала является ОВР: в кристаллическую решетку.
В результате поверхность металла приобретает «+» заряд, а приграничный слой - «-» заряд за счет электростатического притяжения ионов к поверхности Ме.
Причиной возникновения электродного потенциала является ОВР: 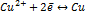
|
Величина электродного потенциала зависит:
1) От природы Ме
2) От активной концентрации ионов Ме в растворе
3) От температуры
Дата добавления: 2020-04-25; просмотров: 1265; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
