Стандартный электродный потенциал , его обозначения , условия измерения.
Электродный потенциал – потенциал, возникающий на границе Ме/ р-р при активности катионов Ме в р-ре 1 моль/л и температуре 298 К.
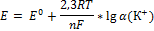

Зависит от природы Ме, заряда катиона, от активности иона, от температуры.
32.Уравнение Нернстна для электродного потенциала. Анализ уравнения.

E-электродный потенциал.
R- 8,31 Дж/моль*K
F- 96500 Кл-число Фарадея.
K- константа, характеризующая природу Ме.
α- активность катиона Ме.
n- число электронов.
Устройство водородного электрода сущность процессов в нем
Представляет собой – платиновую пластинку покрытую платиновой чернью и прогруженную в р-р кислоты с концентрацией ионов водорода 1 моль/л через которую пропускается чистый газообразный водород под давлением в 1атм. Платина поглощает H2 .H2 диссоциирует на атомы , которые затем окисляются обратимо до ионов Н+, ионы Н+ с поверхности Pt могут переходить в р-р и обратно. Образуется ДЭС и скачок потенциала. Потенциал электрода зависит от концентрации ионов Н+ в ра-ре и давления водорода на поверхности электрода.
p  =1 a(H+)=1 T=298K
=1 a(H+)=1 T=298K 
Недостатки: трудно изготавливать, сохранять и поддерживать в рабочем состоянии;
Водород должен быть хим-ки чистым;
Давление и реакция среды должны быть постоянными.

34.Стандартный водородный электрод. Ряд стандартных электродных потенциалов Ме , его значение
Представляет собой – платиновую пластинку покрытую платиновой чернью и прогруженную в р-р кислоты с концентрацией ионов водорода 1 моль/л через которую пропускается чистый газообразный водород под давлением в 1атм. Платина поглощает H2 .H2 диссоциирует на атомы , которые затем окисляются обратимо до ионов Н+, ионы Н+ с поверхности Pt могут переходить в р-р и обратно. Образуется ДЭС и скачок потенциала. Потенциал электрода зависит от концентрации ионов Н+ в ра-ре и давления водорода на поверхности электрода. Используют для измерения величины электродного потенциала
|
|
|
Ряд напряжений(ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Cr→Zn→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
Ряд напряжений используется на практике для сравнительной [относительной] оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе.
Измерение электродных потенциалов. Понятие об электродах сравнения. Примеры.
Измерить величину электродного потенциала невозможно, так как для подключения измерительного прибора необходим двойной металлический электрод. Поэтому потенциал электродов измеряют по отношению к стандартному электроду. Таким является стандартный водородный электрод, потенциал которого условно принимают за 0.
|
|
|
Электроды сравнения — электрохимические системы, предназначенные для измерения электродных потенциалов. Например: водородный, каломельный, хлорсеребряный.
Классификация электродов.
Электроды 1 типа электродный потенциал создается на границе ме-рр в результате ОВР
ОВ(редокс электроды) в результате обмена электродами
Ионометаллические – потенциал возникает в результате обмена ионами
Электроды 2 типа- электродный потенциал возникает на границе раздела2 р-ров отделенных мембраной с избирательной проницаемостью для отдельных ионов – мембраные электроды(ферментныные).
Дата добавления: 2020-04-25; просмотров: 1139; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
