Понятие о гальванических элементах. Укажите возможные варианты составления гальванических цепей. Правила расчета ЭДС.
Гальванический элемент – устройство, состоящее из 2х электродов, дающее возможность получать электрический ток в результате химический реакции.
Химические цепи подразделяют на простые и сложные.
Простая химическая цепь состоит из двух электродов, один из которых обратим по катиону, а другой - по аниону электролита, содержащегося в растворе.
Сложная химическая цепь - такая цепь, в которой указанное условие не соблюдается.
ЭДС гальванического элемента, составленного из 2х металлов: Из потенциалов положительно заряженного электрода вычитают потенциал отрицательно заряженного электрода:

Возникновение ЭДС в элементе Якоби-Даниэля. Выражение для расчета ЭДС.

Суммарная реакция:  . Движение e с цинковой пластинки на медную – и есть электрический ток.
. Движение e с цинковой пластинки на медную – и есть электрический ток.

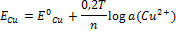


Концентрационный гальванический элемент. Принцип работы.
Концентрационный гальванический элемент – гальванический элемент, состоящий из одинаковых полуэлементов, различающихся только концентрациями растворенного вещества.

Электрическая энергия возникает за счет выравнивания концентраций в растворах электролитов, а не за счет ОВР.
Ток существует, пока не выровняется концентрация или не произойдет полное растворение левого электрода.

Использование концентрационного гальванического элемента. Расчёт ЭДС для концентрационной цепи.
Пример: Ag
ЭДС = Е Ag 1 - Е Ag 2
|
|
|
Е Ag1 = Е0 Ag1 + 0,2Т/n * lgа(Ag1)
Е Ag2 = Е0 Ag2 + 0,2Т/n * lgа(Ag2)
ЭДС =  * lg
* lg 
ЭДС элемента зависит от соотношения активностей ионов и быстро падает во времени.
Измеряя ЭДС концентрационного элемента, можно практически определить:
- Активность ионов
- Коэффициент активности ионов
- Неизвестную концентрацию раствора: а=f*c
Потенциометрическое титрование, Достоинства метода. Кривая титрования, определение точки эквивалентности
Потенциометрия – физико-химический метод анализа, в основе которого лежит измерение ЭДС цепи, составленной из индикаторного электрода и электрода сравнения.
Методы потенциометрии:
- Прямые – определение активности и концентрации ионов или веществ в растворе
- Косвенные – определение концентрации неизвестного вещества при добавлении к нему другого (потенциометрическое титрование)
Главным преимуществом этого метода является возможность раздельного определения ряда близких по свойствам компонентов одного и того же раствора
- График зависимости ЭДС цепи от объема титранта

- График изменения приращения потенциала на единицу добавленного титранта

Потенциометрическое титрование основано на определении точки эквивалентности по результатам потенциометрических измерений. Вблизи точки эквивалентности происходит резкое изменение (скачок) потенциала индикаторного электрода. Это наблюдается, конечно, лишь тогда когда хотя бы один из участников реакции титрования является участником электродного процесса.
|
|
|
Значение потенциометрических методов исселедования:
-определение конц-ции в-в в мутных и окрашенных р-рах;
-опре-е конц-ции нескольких в-в в одной порции исследуемого р-ра;
-измерение pH среды;
-опр-е const-нт диссоциации слабых к-т, ак, белков;
-опр-е констант нестойкости комплексных соединений.
Дата добавления: 2020-04-25; просмотров: 1105; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
