Опыт 3.2.6 Окисление ароматических углеводородов

Реактивы, материалы, приборы: толуол, 1%-й раствор перманганата калия, пробирки, мерные пробирки.
В пробирку, содержащую 2 см3 толуола, прибавляют 2 см3 1%-го раствора перманганата калия и интенсивно встряхивают. Через 15-20 мин фиолетовая окраска перманганата исчезает и выделяется оксид марганца (IV). Бензол при данных условиях в реакцию не вступает.
Какие соединения образуются при окислении изопропилбензола и п-ксилола раствором перманганата калия? Напишите уравнения реакций.
Наблюдение:
Выводы:
4 ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ.
СПИРТЫ И ФЕНОЛЫ
Галогенопроизводные углеводородов получают их галогенированием (хлорирование, бромирование), присоединением хлороводорода или бромоводорода по кратной связи, а также замещением некоторых функциональных групп на атомы галогенов.
Типичными реакциями органических галогенидов являются реакции нуклеофильного замещения атома галогена на различные функциональные группы и используются они для синтеза соединений различных классов (простые и сложные эфиры, нитрилы, спирты, меркаптаны и др.). Эти реакции протекают по механизмам SN1 или SN2.
Реакционная способность галогенидов в значительной степени определяется поляризуемостью связи С–Х, уменьшаясь в ряду: йодиды → бромиды → хлориды. Строение радикала также оказывает большое влияние. В реакциях SN1 реакционная способность R–X зависит от стабильности образующихся карбкатионов R+. Аллильный и бензильный карбониевые ионы особенно стабильны вследствие делокализации положительного заряда за счет сопряжения с двойной связью и ароматическим кольцом. Напротив, в арен- и винил-галогенидах повышенная электроотрицательность sp2-гибридизованных атомов углерода, а также +Мэфф. атома галогена уменьшают обычную полярность связи С–Х и, следовательно, противодействуют ее гетеролизу.
|
|
|
Спирты и фенолы содержат гидроксильную группу: в спиртах она связана с алифатическим радикалом, в фенолах – непосредственно с ароматическим кольцом. Спирты проявляют очень слабые кислотные свойства чуть меньшие, чем вода. Фенолы – более кислые вещества за счет +Мэфф сопряжения р-электронов кислорода гидроксила с π-электронами бензольного ядра, благодаря чему связь О–Н более полярна и водород легче протонируется в водных растворах. В связи с этим фенолы образуют феноляты не только с натрием (как спирты), но и с гидроксидом и карбонатом натрия.
Спирты образуют сложные эфиры с карбоновыми кислотами, вступают в реакции замещения гидроксила на галоген при действии галогенидом фосфора и серы, подвергаются внутримолекулярной и межмолекулярной дегидратации. Спирты и галогенопроизводные элиминируют молекулу воды или галогеноводорода c образованием алкена согласно правилу Зайцева: водород отщепляется от соседнего, наименее гидрогенизированного атома углерода:
|
|
|
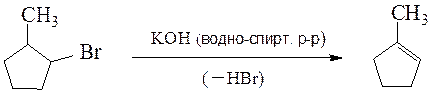

Многоатомные спирты образуют комплексные соединения с гидрок-сидом меди (II), а фенолы активно участвуют в реакциях электрофильного замещения атома водорода ароматического кольца и образуют окрашенные соединения с FeCl3.
Дата добавления: 2020-04-08; просмотров: 227; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
