Химические основы анализа соды
Анализ содержания соды в техническом продукте основан на реакции нейтрализации. Кальцинированная сода представляет собой соль сильного основания и слабой кислоты, поэтому подвергается гидролизу:
Na2CO3 + H2O = NaHCO3 + NaOH (5.2)
или
CO32- + HOH = HCO3- + OH
NaHCO3+ H2O = H2CO3 + NaOH
или
HCO3- + HOH = H2CO3 + OH-
В результате образования свободных ОН-ионов кальцинированная сода имеет в растворе щелочную реакцию. Анализ Na2CO3 проводится по методу нейтрализации ОН--ионов Н+-ионами кислоты по реакции:
Н+ + ОН- = Н2О.
Связывание в малодиссоциированную воду приводит к сдвигу в право равновесия гидролиза Na2CO3. Гидролиз идет до конца, то есть количество ОН--ионов, а, следовательно, и израсходованных Н+-ионов кислоты, эквивалентно количеству соды, взятой для анализа. Поэтому по количеству израсходованной на титрование кислоты можно рассчитать концентрацию соды. Анализ проводят с индикатором метилоранжем. В точке эквивалентности, когда ионы ОН- связаны, при добавлении кислоты, вследствие появления в растворе свободных ионов Н+, индикатор меняет цвет.
Характеристика процесса каустификации содового раствора
Каустификация- основная операция известкового способа получения едкого натра. Содовый раствор, получающийся декарбонизацией суспензии бикарбоната натрия, обрабатывают известью или известковым молоком. Реакция образования гидроксида натрия по обменному взаимодействию между карбонатом натрия и гидроксидом кальция обратима:
|
|
|
Na2CO3 +Са(ОH)2<=>СаCO3 + 2NaOH (5.3)
Константа равновесия реакции определяется уравнением:
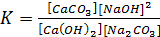 (5.4)
(5.4)
Поскольку значения [СаCO3] и [Са(ОH)2] при наличии твердых фаз можно принять определенными и постоянными, то они могут быть введены в константу равновесия:
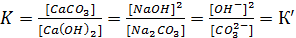 (5.5)
(5.5)
Соответственно, К´ можно выразить через соотношение произведений растворимости гидроксида и карбоната кальция:
ПРСа(ОH)2 =[Са2+][OH-]2
ПРСаCO3=[Са2+][CO32-]
Тогда:
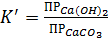 (5.6)
(5.6)
Таблица 5.1
Опытные и расчетные данные К´каустификации содового раствора
| Общая концентрация до каустификации, г-экв/л | Концентрация после каустификации, г-мол/л |
| Степень каустификации, А,% | |
| [OH-] | [CO32-] | |||
| 5.375 | 4.340 | 0.518 | 36.4 | 80.7 |
| 5.125 | 4.220 | 0.408 | 39.3 | 82.3 |
| 4.900 | 4.095 | 0.403 | 41.7 | 83.6 |
| 3.842 | 3.444 | 0.199 | 59.6 | 89.6 |
| 3.073 | 2.903 | 0.085 | 99.1 | 94.5 |
| 2.045 | 1.982 | 0.032 | 124.9 | 96.9 |
С уменьшением концентрации соды в растворе степень каустификации растет, а с ростом температуры значение константы равновесия уменьшается, т.к. при этом растет растворимость гидроксида кальция. Расчетами показана возможность более полного превращения карбоната натрия в гидроксид при 15-20°С. На практике процесс ведут при температуре 80 -100°С. Этот режим, во-первых, объясняется возрастанием скорости взаимодействия компонентов с ростом температуры, во-вторых, при температурах ниже 80°С каустификация сопровождается образованием тонкодисперсного осадка карбоната кальция, трудно фильтруемого и адсорбирующего значительные количества гидроксида натрия.
|
|
|
На практике ведут процесс с 2-3 н. раствором Na2CO3 (10-15% масс.) при 80°С: получают щелок 100-120г/лNaOH, с превращением Na2CO3 в NaOH в среднем на 90%. Скорость процесса зависит от свойств и количества извести, размеров частиц, условий обжига известняка и наличия примесей.
Дата добавления: 2020-04-08; просмотров: 211; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!