ДИФФУЗИОННЫЙ И КОНВЕКТИВНЫЙ МЕХАНИЗМЫ МАССООБМЕНА. РАВНОВЕСИЕ И ДВИЖУЩАЯ СИЛА МАССОПЕРЕДАЧИ.
Для всех массообменных процессов характерным является переход вещества из одной фазы в другую, или массопередача.
Одну фазу обозначим буквой G, другую L, а распределяемый компонент М. Поскольку все массообменные процессы обратимы, то распределяемое вещество может переходить в зависимости от концентрации этого вещества в распределяющих фазах из фазы G в фазу L и наоборот.
Представим для первой группы процессов массопередачи, что распределяемое вещество находится вначале только в фазе G и имеет концентрацию Y. В фазе L в начальный момент распределяемого вещества нет и, следовательно, концентрация его в этой фазе X=0.
Если распределяющие фазы привести в соприкосновение, начнется переход распределяемого вещества из фазы G в фазу L, и в жидкой фазе появится распределяемый компонент с концентрацией, отличной от нуля. С момента появления вещества М в фазе L начинается обратный переход его в фазу G. До некоторого момента времени число частиц М, переходящих в единицу времени через единицу поверхности фазового контакта из фазы G в фазу L, больше, чем число частиц, переходящих обратно из фазы L в фазу G.
Через определенный промежуток времени скорости перехода распределяемого вещества из фазы G в фазу L и обратно становятся одинаковыми. Такое состояние называется равновесным. В состоянии равновесия существует строго определенная зависимость между концентрациями распределяемого вещества в фазах, которые при равновесии системы называются равновесными.
|
|
|
Любой концентрации Xсоответствует равновесная концентрация Y*, и наоборот, любой концентрации Y соответствует равновесная концентрация Х*, т. е. имеют место зависимости вида
Y*=f1(X) или X*=f2(Y)
Условия равновесия и равновесные зависимости могут быть выражены не только через концентрации, но и через другие параметры, например, энтальпии, химический потенциал.
Движущей силой массопередачи является разность между рабочей и равновесной концентрациями или наоборот.
Движущую силу можно выражать либо через концентрации распределяемого вещества в фазе G, либо L. В этой связи уравнения массопередачи, записанные по фазам, имеют вид
dM=Ky·∆Y·dF·dt
dM=Kx•∆X•dF•dt
Индексы у коэффициента скорости процесса K показывают, какие концентрации приняты для выражения движущей силы. В общем случае ∆Y≠∆X и Ky≠Kx, но всегда выполняется равенство Ky·∆Y=Kx·∆X
МАТЕРИАЛЬНЫЙ БАЛАНС МАССОПЕРЕДАЧИ. УРАВНЕНИЕ РАБОЧЕЙ ЛИНИИ. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ ВЕЩЕСТВА В ФАЗЕ.
Рассмотрим прямоточный массообменный аппарат, в котором осуществляется взаимодействие потоков фазы G (кг/с), с изменяющимися в ней концентрациями распределяемого вещества от уН до уК (в масс. долях), и фазы L (в кг/с), с изменяющимися в ней концентрациями распределяемого вещества от хН до хК (в масс. долях) (рис. 2). для непрерывного установившегося процесса материальный баланс запишется:
|
|
|
а) по всему веществу
GH + LH = GK + LK ; (1)
б) по распределяемому компоненту
 (2)
(2)
Если в нижней части аппарата провести произвольное сечение, то текущие концентрации в нем будут равны у и х, а материальный баланс по всему веществу и по распределяемому компоненту:

Решая это уравнение относительно y, получим:
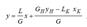 (5)
(5)
Уравнение прямой (5), выражающей связь между рабочими (текущими) концентрациями называется рабочей линией процесса. При совместном построении линии равновесия уР и рабочей линии массообменного процесса в координатах у– х (рис.3) можно установить его направление. Если рабочая линия расположена выше линии равновесия, например, при абсорбции (рис. 3), то для произвольно выбранной точки 1 на ней концентрации у>уР и х<хР. При этом, стремясь к равновесным концентрациям, у снижается, а х повышается в процессе переноса вещества, т.е. распределяемый компонент переходит из фазы G в фазу L.
|
|
|

Если рабочая линия расположена ниже линии равновесия, например, при ректификации, то для любой точки рабочей линии у<уР и х>хР. При этом распределяемый компонент будет переходить из фазы L в фазу G, стремясь к рав-новесным уР и хР.
Обычно количественный состав фаз выражают:
 - в объемных концентрациях, принимая за единицу массы 1 кг или 1 кмоль; объемная концентрация представляет собой число килограммов (или киломолей) данного компонента, приходящееся на единицу объема фазы (в кг/м3 или кмоль/м3);
- в объемных концентрациях, принимая за единицу массы 1 кг или 1 кмоль; объемная концентрация представляет собой число килограммов (или киломолей) данного компонента, приходящееся на единицу объема фазы (в кг/м3 или кмоль/м3);
- в массовых (весовых) или мольных долях, представляющих собой отношение килограммов (или киломолей) данного компонента к массе всей фазы, выраженное общим числом килограммов или киломолей соответственно;
- в относительных концентрациях, т.е. в виде отношения килограммов (или киломолей) данного компонента, являющегося распределяемым веществом к числу килограммов (или киломолей) компонента-носителя, количество которого остается постоянным в процессе массопередачи.
Дата добавления: 2019-11-25; просмотров: 216; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
