ГЕТЕРОФУНКЦИОНАЛЬНЫЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ АЛИФАТИЧЕСКОГО И БЕНЗОЛЬНОГО РЯДОВ. СТРОЕНИЕ И РЕАКЦИОННАЯ СПОСОБНОСТЬ.
ЦЕЛЬ: Сформировать знания:
– структуры биологически важных аминоспиртов и аминофенолов, гидрокси- и оксокислот;
– особенностей химического поведения поли и гетерофункциональных органических соединений с учетом взаимного влияния функциональных групп;
– биологически важных превращений гетерофункциональных органических соединений;
– гетерофункциональных соединений бензольного ряда – родоначальников важных групп лекарственных веществ.
Сформировать умения:
– выделять реакционные центры в составе гетерофункциональных соединений;
– писать характерные специфические реакции гетерофункциональных соединений;
– выполнять характерные и качественные реакции гетерофункциональных соединений.
ВОПРОСЫ ДЛЯ САМОПОДГОТОВКИ К ЗАНЯТИЮ:
1. Особенности химического поведения полифункциональных соединений.
2. Классификация гетерофункциональных соединений. Аминоспирты: этаноламин (коламин), холин, ацетилхолин. Аминофенолы: дофамин, норадреналин, адреналин. Аминотиолы: 2-аминоэтантиол. Понятие об их биологической роли.
3. Гидрокси- и аминокислоты. Одноосновные (молочная), двухосновные (яблочная, винная) и трехосновные (лимонная) кислоты. Характерные свойства и специфические реакции a,b,g-гидрокси и аминокислот. Представление о строении b-лактамных антибиотиков.
4. Оксокислоты: альдегидо- и кетонокислоты. Глиоксалевая, пировиноградная, ацетоуксусная, щавелевоуксусная, a-оксоглутаровая кислоты – важнейшие метаболиты. Кето-енольная таутомерия. Реакции декарбоксилирования b-оксокислот и окислительного декарбоксилирования a-оксокислот.
5. Гетерофункциональные производные бензольного ряда. Салициловая кислота: салицилат натрия, метилсалицилат, ацетилсалициловая кислота и фенилсалицилат, их лекарственное значение.
6. n-Аминобензойная кислота и ее производные (анестезин, новокаин). Биологическая роль n-аминобензойной кислоты.
7. Сульфаниловая кислота и ее амид. Сульфаниламидные препараты.
ЛИТЕРАТУРА:
[1]. Тюкавкина Н.А., Биоорганическая химия. / Н.А.Тюкавкина, Ю.И. Бауков– М.: Медицина, 1991.– С. 230-274.
[2]. Гидранович Л.Г. Биоорганическая химия: Учеб. пособие. /Л.Г.Гидранович. – Витебск: ВГМУ, 2009.– С. 140-153.
[3]. Гидранович Л.Г. Лабораторные занятия по биоорганической химии.: Учеб. пособие / Л.Г.Гидранович. – Витебск: ВГМУ, 2012.– С. 63-70.
[4]. Гидранович Л.Г. Курс лекций по биоорганической химии.– Витебск.– 2003.– С. 117-131.
ЗАДАНИЯ ДЛЯ КОНТРОЛЯ САМОПОДГОТОВКИ К ЗАНЯТИЮ.
1. Изучить теоретический материал по вопросам для самоподготовки к занятиям.
2. Оформить протокол лабораторной работы.
3. Решить задачи 1, 2, 4, 6, 7, 12, 14, 15, представленные на страницах 67-70 данного лабораторного практикума.
Примерный вариант заключительного контроля:
1. Сравните нуклеофильные свойства аминогруппы и фенольного гидроксила в составе п-аминофенола. Напишите схему реакции более активной из них с 1 моль уксусного ангидрида, назовите продукт реакции. Опишите механизм реакции по стадиям.
2. Напишите схемы реакций, обозначьте графически реакционные центры, укажите тип и механизм реакций:

СОДЕРЖАНИЕ ЛАБОРАТОРНОГО ПРАКТИКУМА.
Опыт 1. Разложение молочной кислоты.
При нагревании с Н2SО4 молочная кислота разлагается с образованием муравьиной кислоты и уксусного альдегида.
А. Определение муравьиной кислоты.
В сухую пробирку поместите 1 каплю молочной кислоты и 1 каплю концентрированной серной кислоты, нагрейте над пламенем спиртовки. Жидкость темнеет и пенится от выделения СО, который при поджигании у отверстия пробирки горит голубоватым пламенем.
Б. Определение уксусного альдегида.
Ввиду того, что выделяющийся при разложении молочной кислоты ацетальдегид в присутствии концентрированной серной кислоты легко полимеризуется, его не удается открыть одновременно с муравьиной кислотой. Для открытия ацетальдегида используется разведенная серная кислота. В пробирку «а», снабженную пробкой с газоотводной трубкой поместите 2 капли воды, 1 каплю концентрированной серной кислоты, 1 каплю молочной кислоты. Конец газоотводной трубки опустите в пробирку «б» с 1 каплей раствора йода в йодиде калий и 2 каплями NaOH. Пробирку «а» нагрейте. В пробирке «б» появляется желтовато-белая муть с характерным запахом йодоформа.
Схемы реакций:

Вопросы:
1. Для каких целей может быть использована данная реакция в качественном анализе?
2. Напишите схему разложения лимонной кислоты при нагревании с концентрированной Н2SО4.
Опыт 2. Доказательство наличия двух карбоксильных групп в винной кислоте.
В пробирку поместите 1 каплю 2н раствора винной кислоты и 2 капли 0,5н КОН, хорошо встряхните. Выделяется кристаллический осадок гидротартрата калия. Добавьте в пробирку еще несколько капель раствора КОН до растворения осадка. Образуется средняя соль винной кислоты – тартрат калия. Раствор сохраните для следующего опыта.
Схемы реакций:
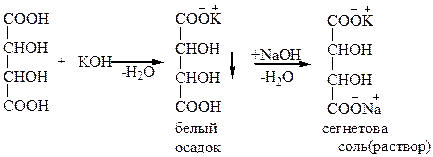
Вопросы:
1. По какому реакционному центру винной кислоты протекает реакция?
2. О чем свидетельствует образование двух типов солей винной кислоты?
Опыт 3. Доказательство наличия гидроксильных групп в винной кислоте.
Поместите в пробирку 2 капли 0,2 н CuSO4 и 2 капли 2н NaOH. К выпавшему осадку Cu(OH)2 добавьте раствор тартрата калия, полученного в предыдущем опыте. Происходит растворение голубого осадка и образование синего раствора. Данный раствор применяют под названием реактива Фелинга для открытия глюкозы в моче.
Схемы реакций:

Вопросы:
1. По какому реакционному центру протекает реакция винной кислоты гидроксидом меди (11)?
2. О чем свидетельствует образование комплекса с ионом меди Сu2+?
Опыт 4. Обнаружение двух таутомерных форм ацетоуксусного эфира.
Поместите в пробирку 1 каплю ацетоуксусного эфира и 1 каплю 0,1н FeCl3. Появляется фиолетово-красное окрашивание, указывающее на наличие енольной формы. Прибавьте 1 каплю насыщенного водного раствора брома. Фиолетовое окрашивание моментально исчезает, но затем постепенно возобновляется. Прибавьте еще одну каплю бромной воды. Вновь происходит обесцвечивание с последующим возобновлением фиолетовой окраски.
Схемы реакций:

Вопросы:
1. Объясните, чем обусловлена возможность кето-енольной таутомерии ацетоуксусного эфира?
2. Для каких целей может быть использована данная реакция в качественном анализе?
Опыт 5. Доказательство отсутствия фенольного гидроксила в ацетилсалициловой кислоте и ее гидролиз.
Поместите в пробирку «а» крупинку аспирина и 5-6 капель воды. Встряхните пробирку, чтобы ускорить растворение вещества и затем отлейте часть раствора в пробирку «б», добавьте в пробирку «б» 1 каплю 0,1 н FeCl3. Фиолетовая окраска не появляется.
Остаток раствора ацетилсалициловой кислоты в пробирке «а» прокипятите в течение полминуты и затем прибавьте 1 каплю 0,1 н FeCl3. Как изменяется цвет раствора? Объясните наблюдаемое явление.
Проба с хлоридом железа (III) служит для определения чистоты ацетилсалициловой кислоты.
Cхемы реакций:

Вопросы:
1. Почему не появляется фиолетовая окраска в пробирке «б»?
2. Какую примесь можно обнаружить в аспирине с помощью этой реакции?
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ:
1. Дайте систематическое название по заместительной номенклатуре 1UРАС для каждого из приведенных соединений:


2. Напишите структурную формулу каждого из следующих соединений по их систематическому названию.
а) 2-амино-3-(4-гидроксифенил)-пропановая кислота(тирозин);
б) гексанолид-1, 4;
в) 5-метилпирролидон-2;
г) 2-гидрокси-3-карбоксипентандиовая кислота;
д) N-4-этоксифенилэтанамид.
3. Цитрат натрия применяется для консервации крови в виде 4-5% раствора. Он представляет собой тринатриевую соль лимонной кислоты. Сравните силу ОН-кислотных центров лимонной кислоты и напишите схему реакции его получения из лимонной кислоты под воздействием карбоната натрия.
4. Лактат кальция (противоаллергическое средство) образуется при действии на молочную кислоту CaCO3. Сравните силу ОН-кислотных центров молочной кислоты и объясните, какой из них вступает в реакцию с карбонатом кальция.
5. Ацетилхолин (нейромедиатор) гидролизуется ферментативно до холина. Напишите схему реакции гидролиза ацетилхолина в присутствии кислотного катализатора. Опишите ее механизм.
6. Сложные эфиры n-аминобензойной кислоты применяют в качестве местноанестезирующих средств. Их получают из n–нитробензойной кислоты по схеме:

Напишите схемы реакций.
7. Для идентификации анестезина используется реакция его гидролиза в щелочной среде. Напишите схему реакции. Опишите механизм.

8. Ацетилсалициловая кислота, ненаркотический анальгетик, гидролизуется в желудочно-кишечном тракте до салициловой кислоты. Напишите схему реакции ее гидролиза в кислой и щелочной среде. Опишите механизм.
9. Одним из механизмов фармакологического действия аспирина является ингибирование биосинтеза простагландинов, которые усиливают воспалительные процессы. Действие осуществляется путем инактивации ферментов, ответственных за синтез простагландинов – простагландинсинтаз. Инактивация одной из концевых субьединиц ферментов (Е-NН2) осуществляется за счет ацетилирования их с участием аспирина. Прогнозируйте схему такого ацетилирования. Опишите возможный механизм.
10. Важное значение для медицины имеют производные лактама g- аминомасляной кислоты (например, пирацетам). Напишите схему получения g-лактама, укажите условия реакции.
11. g-Гидроксимасляная кислота как промежуточный продукт b-окисления накапливается в организме больных сахарным диабетом. Напишите продукт, который образуется при окислении g-гидроксимасляной кислоты, назовите его.
12. Ацетоуксусная кислота вместе с продуктами превращений накапливается в организме больных сахарным диабетом. Напишите схему реакции декарбоксилирования ацетоуксусной кислоты. Назовите продукт реакции.
13. Ацетоуксусный эфир широко применяется в органическом синтезе как исходное вещество для получения кетонов, карбоновых кислот и других важных соединений. Напишите реакцию взаимодействия ацетоуксусного эфира с фенилгидразином, которая имеет место в синтезе анальгина.
14. Напишите таутомерные формы ацетоуксусного эфира, объясните, какая из форм проявляет кислотные свойства. Напишите схему реакции, подтверждающей кислотные свойства ацетоуксусного эфира.
15. Гиппуровая кислота (C6H5CO-NH-CH2COOH) образуется в печени из бензойной и аминоуксусной кислот. Напишите схему реакции ее образования.
16. В состав антибиотиков пенициллиновой группы входит b-лактамное кольцо. Оно чрезвычайно лабильно и подвергается гидролизу в мягких условиях, что приводит к потере биологической активности. Объясните причину неустойчивости b-лактамного кольца, напишите схемы реакций его гидролиза:

17. n-Аминобензойную кислоту получают из толуола. Напишите схемы реакций ее получения:

18. Сульфаниламидные препараты синтезируются из n-сульфохлорида ацетанилида по схеме:

Напишите схемы реакций, укажите их механизм.
ЗАНЯТИЕ 10
Дата добавления: 2019-09-13; просмотров: 723; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
