ВОПРОСЫ ДЛЯ САМОПОДГОТОВКИ К ЗАНЯТИЮ.
1. Электронное и пространственное строение карбоксильной группы.
2. Кислотные свойства карбоновых кислот: моно- и дикарбоновых, предельных, непредельных, ароматических.
3. Реакции нуклеофильного замещения у тригонального атома углерода. Реакции ацилирования – образования гологенангидридов, ангидридов, сложных эфиров и тиоэфиров, амидов и обратные им реакции гидролиза.
4. Ацилирующие агенты (ангидриды, карбоновые кислоты, сложные эфиры, сложные тиоэфиры), сравнительная активность этих агентов.
5. Ацилфосфаты и ацилкофермент А – природные макроэргические ацилирующие агенты. Биологическая роль реакций ацилирования.
6. Понятие о нуклеофильном замещении у атома фосфора, реакции фосфорилирования.
7. Реакции декарбоксилирования карбоновых кислот в зависимости от числа и взаимного расположения карбоксильных групп.
ЛИТЕРАТУРА:
[1]. Тюкавкина Н.А., Биоорганическая химия. / Н.А.Тюкавкина, Ю.И. Бауков– М.: Медицина, 1991.– С. 194-207.
[2]. Гидранович Л.Г. Биоорганическая химия: Учеб. пособие. /Л.Г.Гидранович. – Витебск: ВГМУ, 2009.– С. 125-139.
[3]. Гидранович Л.Г. Лабораторные занятия по биоорганической химии.: Учеб. пособие / Л.Г.Гидранович. – Витебск: ВГМУ, 2012.– С. 56-62.
[4]. Гидранович Л.Г. Курс лекций по биоорганической химии.– Витебск.– 2003.– С. 104-116.
ЗАДАНИЯ ДЛЯ КОНТРОЛЯ САМОПОДГОТОВКИ К ЗАНЯТИЮ.
1. Изучить теоретический материал по вопросам для самоподготовки к занятиям.
|
|
|
2. Оформить протокол лабораторной работы.
3. Решить задачи 1, 2, 4-6, 9-11, представленные на страницах 60-62 данного лабораторного практикума.
Примерный вариант заключительного контроля:
1.Сравните ацилирующую способность этанангидрида, этаноилхлорида, этановой кислоты и этилэтаноата. Напишите схему реакции аммонолиза более активного из них, назовите продукт реакции.Опишите механизм реакции по стадиям.
2. Напишите схемы реакций, обозначьте графически реакционные центры, укажите тип и механизм реакций:
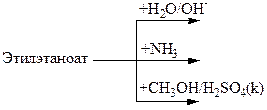
СОДЕРЖАНИЕ ЛАБОРАТОРНОГО ПРАКТИКУМА:
Опыт 1. Диссоциация карбоновых кислот.
На полоску универсальной индикаторной бумаги нанесите в виде маленьких капель растворы уксусной и щавелевой кислот. Сравните полученную окраску со шкалой, определите приблизительное значение рН в растворе.
Схема реакций:
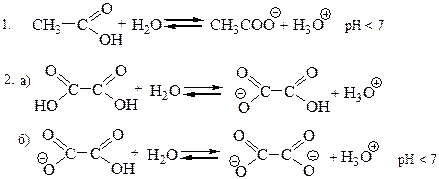
Вопросы:
1. Качественно оцените силу данных кислот.
2. Для какой цели может быть использована данная реакция в качественном анализе?
Опыт 2. Получение бензоата натрия.
В каждую из двух пробирок поместите несколько кристаллов бензойной кислоты и 2 капли воды. Кристаллы бензойной кислоты плохо растворимы. Добавьте в первую пробирку при встряхивании 2-3 капли 2н NaOH до растворения кристаллов, во вторую – насыщенного раствора NaHCО3. Бензоат натрия хорошо растворим в воде. К полученному прозрачному раствору добавьте 2-3 капли 2н HCl. Выпадает осадок.
|
|
|
Схемы реакций:
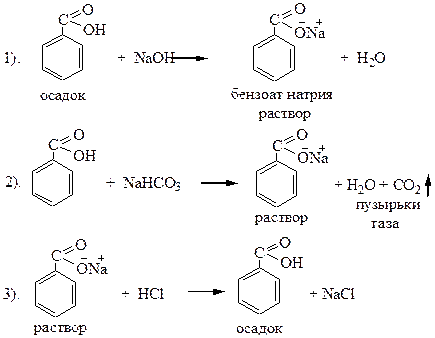
Вопросы:
1. О чем свидетельствует появление осадка при добавлении соляной кислоты?
2. Для каких целей могут быть использованы данные реакции в качественном анализе?
Опыт 3. Получение этилацетата.
В сухую пробирку поместите порошок безводного ацетата натрия (высота ~ 2 мм) и 3 капли этилового спирта. Добавьте 2 капли концентрированной серной кислоты и осторожно нагрейте над пламенем горелки. Через несколько секунд появляется приятный освежающий запах этилацетата.
Схемы реакций:
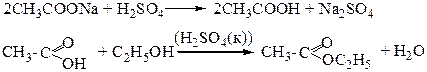
Вопросы:
1. Укажите и назовите реакционные центры, по которым протекает реакция. Определите тип и механизм реакции.
2. Опишите механизм реакции. Объясните роль кислотного катализа.
Дата добавления: 2019-09-13; просмотров: 412; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
