Цель: Научиться распознавать основные органические вещества и важнейшие полимеры и волокна.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Полимеры- это органические соединения, состоящие из макромолекул с большой молекулярной массой
| Название | Физ. свойства | Отношение к нагреванию | Характер горения |
| Полиэтилен (-СН2-СН2-)п | Жирный на ощупь. В виде пленки, прозрачный, эластичный | Размягчается, легко меняет форму, вытягивается в нити | Горит ярким пламенем с запахом расплавленного парафина. Горит вне пламени |
| Поливинилхлорид (-СН2-СНС L -)п | Эластичный, в толстых слоях жесткий. Прозрачный. | Размягчается и разлагается с выделением НCL | Горит коптящим пламенем. Вне пламени гаснет |
Полиметилметакрилат

| Твердый, прозрачный материал. Цвет различный | Из расплава нити не вытягиваются ,но при нагревании размягчается. | Горит желто- синем пламенем, потрескивает, распространяет запах эфиров. |
Фенолформальдегидная смола

| Непрозрачная, твердая, неэластичная, хрупкая | Не размягчается, разлагается при нагревании | Загорается, при длительном пребывании смолы в пламени ощущается запах фенола. В пламени постепенно гаснет. |
Полистирол

| Твердый хрупкий, прозрачный (или молочного цвета). | Термопластичен, вытягивается при нагревании в нити. | Горит сильно- коптящим пламенем, испускает характерный запах. Горит вне пламени. |
Волокна –протяженные , гибкие и прочные тела ограниченной длины и малых поперечных размеров, пригодные для изготовления пряжи и текстильных изделия. Различают волокна:
|
|
|
· Природные волокна- растительного(лен, хлопок) и животного (шерсть, шелк) происхождения.
· Химические волокна- искусственные (вискоза, ацетатное и медноаммиачное волокно)
| Название волокна | Характеристика горении и его результат | Отношение к кислотам и щелочам | ||
| HNO3 конц. | H2SO4 конц. | NaOH конц. | ||
| Хлопок | Быстро сгорает, ощущается запах жженой бумаги. После сгорания остается серый пепел | Растворяется, раствор бесцветный | Растворятся | Набухает, но не растворяется |
| Вискозное | Быстро сгорает, ощущается запах жженой бумаги. После сгорания остается серый пепел | Растворяется. раствор бесцветный | Растворяется. Раствор красно-коричневый | Растворяется |
| Шерсть и шелк натур. | Горит, выделяет запах паленого пера, образует хрупкий черный шарик | Желтый окрас | Разрушается | Растворяется |
| Ацетатное | Горит в пламени, вне его гаснет. Спекается темный нехрупкий шарик | Растворяется, раствор бесцветный | Растворяется | Желтеет и растворяется. |
| Капрон | Размягчается, плавится, образуя твердый нехрупкий блестящий шарик. Из расплава вытягиваются нити. Горит, выделяет запах. | Растворяется, раствор бесцветный | Растворяется, раствор бесцветный | Не растворяется |
ПРАКТИЧЕСКАЯ ЧАСТЬ
|
|
|
| РЕШЕНИЕ ЭКСПЕРИМЕНТАЛЬНЫХ ЗАДАЧ НА ИДЕНТИФИКАЦИЮ ОРГАНИЧЕСКИХ ВЕЩСТВ | |
| КАЧЕСТВННЫЕ РЕАКЦИИ НА ОБНАРУЖЕНИЕ ВЕЩЕСТВ | |
| Пример №1 Газы метан и этилен . С помощью какого реактива можно выявить этилен: КMnO4(раствор), Ag2O , NaOH (раствор), FeCl3 | Запишите реакцию с выбранным реактивом. Укажите признаки, характерные для данной качественной реакции: …………………………………………………………………………………….. ……………………………………………………………………………………. …………………………………………………………………………………….. |
| Пример №2 Растворы уксусной кислоты и глицерина. С помощью какого вещества можно выявить глицерин: Сu(ОН)2 , Ag2O (аммиачный), NaOH, йод | Запишите реакцию с выбранным реактивом. Укажите признаки, характерные для данной качественной реакции: …………………………………………………………………………………….. ……………………………………………………………………………………. …………………………………………………………………………………….. |
| Пример №3 Растворы формальдегида, муравьиной и уксусной кислоты. С помощью какого одного вещества можно выявить муравьиную кислоту и формальдегид: СuSO4 , Ag2O ( аммиачный), NaOH , йод | Запишите реакции с выбранным реактивом. Укажите признаки, характерные для данной качественной реакции: …………………………………………………………………………………….. ……………………………………………………………………………………. …………………………………………………………………………………….. ……………………………………………………………………………………. |
| Пример №4 Растворы глюкозы и этанола . С помощью какого вещества можно выявить глюкозу: СuSO4 , Ag2O ( аммиачный), NaOH, йод | Запишите реакцию с выбранным реактивом. Укажите признаки, характерные для данной качественной реакции: …………………………………………………………………………………….. ……………………………………………………………………………………. ……………………………………………………………………………………... |
| Пример №5 Растворы крахмала и сахарозы . С помощью какого вещества можно выявить крахмал: СuSO4, Ag2O ( аммиачный), NaOH , йод | Укажите признаки, характерные для данной качественной реакции: …………………………………………………………………………………….. ……………………………………………………………………………………. …………………………………………………………………………………….. ……………………………………………………………………………………. |
| Пример №6 Растворы белка и анилина . С помощью какого вещества можно выявить белка: СuSO4, Ag2O( аммиачный), NaOH , НNO3 | Запишите реакцию с выбранным реактивом. Укажите признаки, характерные для данной качественной реакции: …………………………………………………………………………………….. ……………………………………………………………………………………. |
| Пример №7 Фенолформальдегидная смола и полиэтилен. Какой полимер является термореактивным. Почему? | Запишите ответ. Укажите признаки, характерные термореактивности: …………………………………………………………………………………….. ……………………………………………………………………………………. …………………………………………………………………………………….. |
| Пример №8 Ацетатное, шерстяное и вискозное волокно. После сгорания какого волокна остается серый пепел? | Запишите ответ. Укажите как ведет себя данное волокно при растворении в кислотах, щелочах: …………………………………………………………………………………….. ……………………………………………………………………………………. …………………………………………………………………………………….. |
| Пример №9 Полистирол, полиэтилен и полиметилметакрилат. Какой полимер горит желто- синем пламенем и потрескивает? | Запишите ответ. Укажите, каким является указанный полимер: термопластичным или термореактивным? …………………………………………………………………………………….. ……………………………………………………………………………………. …………………………………………………………………………………….. |
| Пример №10 Шёлк, хлопок, капрон. Какое волокно при горении спекается в темный нехрупкий блестящий шарик? | Запишите ответ. Укажите как ведет себя данное волокно при растворении в кислотах, щелочах: …………………………………………………………………………………….. ……………………………………………………………………………………. …………………………………………………………………………………….. |
Вывод:
|
|
|
|
|
|
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
ПРАКТИЧЕСКАЯ РАБОТА №23
«ГЕНЕТИЧЕСКАЯ СВЯЗЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ»
Цель: Рассмотреть генетическую связь между типами углеводородов и классами органических соединений; обобщить и систематизировать знания об органических соединениях на основе сравнительной характеристики их свойств.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ

ПРАКТИЧЕСКАЯ ЧАСТЬ
Задание №1

1. ………………………………………………………………………………………………
2. ………………………………………………………………………………………………
3. ………………………………………………………………………………………………
4. ………………………………………………………………………………………………
5. ………………………………………………………………………………………………
6. ………………………………………………………………………………………………
7. ………………………………………………………………………………………………
8. ………………………………………………………………………………………………
9. ………………………………………………………………………………………………
10. ………………………………………………………………………………………………
11. ………………………………………………………………………………………………
12. ………………………………………………………………………………………………
13. ………………………………………………………………………………………………
14. ………………………………………………………………………………………………
15. ………………………………………………………………………………………………
16. ………………………………………………………………………………………………
17. ………………………………………………………………………………………………
18. ………………………………………………………………………………………………
19. ………………………………………………………………………………………………
20. ………………………………………………………………………………………………
21. ………………………………………………………………………………………………
22. ………………………………………………………………………………………………
Задание №2

1. ………………………………………………………………………………………………
2. ………………………………………………………………………………………………
3. ………………………………………………………………………………………………
4. ………………………………………………………………………………………………
5. ………………………………………………………………………………………………
6. ………………………………………………………………………………………………
7. ………………………………………………………………………………………………
8. ………………………………………………………………………………………………
9. ………………………………………………………………………………………………
Вывод:
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
ПРИЛОЖЕНИЕ
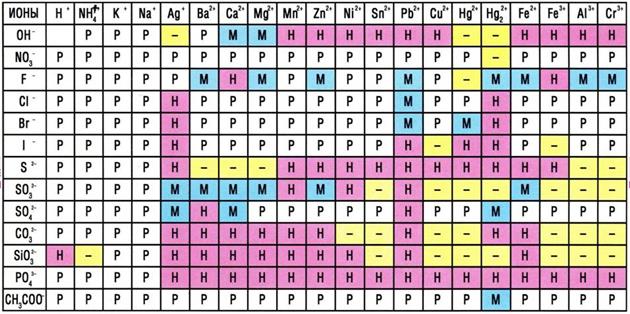
ТАБЛИЦА РАСТВОРИМОСТИ Таблица №1
СПРАВОЧНЫЕ МАТЕРИАЛЫ ПО ХИМИЧЕСКОЙ ТЕРМОДИНАМИКЕ Таблица №2
Стандартные энтальпии образования ∆Н0298, энтропии образования S0298
и энергии Гиббса образования ∆G0298
| Вещество | Состояние | ∆Н0298 кДж/моль | S0 298 Дж/(мольК) | ∆G0298 кДж/моль | Вещество | Состояние | ∆Н0298 кДж/моль | S0 298 Дж/(мольК) | ∆G0298 кДж/моль |
| Al2O3 BaCO3 BaO BeCO3 BeO C C CH4 C2H2 C2H4 C2H6 C6H6 CH3OH C2H5OH CO CO2 CaCO3 CaO Ca(OH)2 CuO Cl2 FeO Fe2O3 Fe3O4 H2 | К К К К К ал. гр. Г Г Г Г Ж Ж Ж Г Г К К К К Г К К К Г | -1676,0 -1218,0 -558,0 -1012,2 -601,02 0 0 -74,85 +226,75 +52,28 -84,68 +49 -238,7 -227,6 -110,52 -393,51 -1207,8 -635,5 -986,50 -162,0 0 -264,8 -821,32 -1117,1 0 | 50,9 112,1 69,56 199,4 14,15 2,44 5,69 186,2 200,8 219,4 229,5 172,8 126,8 160,7 197,9 213,65 88,7 39,7 76,1 42,6 222,9 60,8 87,4 146,2 130,5 | -1582,0 -1138,8 -528,4 -944,75 -581,61 0 0 -50,8 +209,2 +68,1 -32,9 +124,5 -166,31 -174,8 -137,27 -394,38 -1127,7 -604,2 -896,8 -129,9 0 -244,3 -740,3 -1014,2 0 | HCl H2O H2O H2SO4 MgCO3 MgO N2 NH3 N2O NO NO2 NiO O2 PH3 P2O5 PCl3 PCl5 SO2 SO3 SnO SеO2 ZnO | Г Г Ж Ж К К Г Г Г Г Г К Г Г К Г Г Г Г К К К | -92,3 -241,8 -285,8 -811,3 -1098,21 -601,8 0 -46,2 +82,0 +90,3 +33,5 -239,7 0 +17,22 -1492,0 -272,1 -369,4 -296,9 -395,2 -286,0 -235,9 -550,6 | 186,8 188,7 70,1 156,9 65,68 26,9 191,5 192,6 219,9 210,6 240,2 38,0 205,0 211,68 114,5 312,1 352,7 248,1 256,7 56,5 57,12 43,6 | -95,2 -228,6 -237,3 -689,4 -1028,3 -569,6 0 -16,7 -104,1 +86,6 +51,5 -211,6 0 +12,5 -1348,8 -286,4 -324,6 -300,1 -371,2 -256,9 - -320,7 |
| ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА Таблица №3 |

|
Дата добавления: 2019-09-08; просмотров: 151; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
