ПРИМЕР №4 Расчёт относительной плотности газа по другому газу.
ПРИМЕР №1 Определить число протонов, электронов, нейтронов и относительную атомную массу углерода, натрия и рутения.
| а) Для углерода Относительная атомная масса : Аr (С) = 12………………….. Число протонов …р=6……… Число электронов… e- =6…… Число нейтронов : …………… …n= Ar –p= 12-6=6……… | б) Для натрия Относительная атомная масса : Аr (Na) = ……………………………… Число протонов……………………… Число электронов…………………... Число нейтронов : …………………. …………………………………. | с) Для рутения Относительная атомная масса : Аr (Ru) = ………………………………… Число протонов………………………… Число электронов……………………... Число нейтронов : ……………..……… …………………………………………….. |
ПРИМЕР №2 Определить количество молей и число молекул
| а) в 10 граммах серной кислоты Н2 SO 4 | б) в 50 граммах соли А l 2 ( SO 4 )3 ; |
1. По таблице Д.И. Менделеева определяем относительные атомную массу :
 Аr(H)=1, Аr(S)=32, Аr(O)=16, рассчитаем по этим данным относительную молекулярную массу: Мr(H2SO4)= (2*1)+32+(16*4)=98
2. Количество молей:
3. Количество молекул:
N= υ* Na=0,102* 6,02٠1023 =0,614٠1023мол. Аr(H)=1, Аr(S)=32, Аr(O)=16, рассчитаем по этим данным относительную молекулярную массу: Мr(H2SO4)= (2*1)+32+(16*4)=98
2. Количество молей:
3. Количество молекул:
N= υ* Na=0,102* 6,02٠1023 =0,614٠1023мол.
| …………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………. |
| с) Определить количество молей и число молекул в 2х литрах N 2 | д) Определить количество молей и число молекул в 14 х литрах O 2 |
1. Количество молей
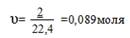 ;
2.Количество молекул
N= υ* Na=0,089 * 6,02٠1023 =0,54٠1023 мол. ;
2.Количество молекул
N= υ* Na=0,089 * 6,02٠1023 =0,54٠1023 мол.
| ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… |
ПРИМЕР №3 Определить массовую долю каждого химического элемента
| а) в молекуле серной кислоты H 2 SO 4. | б) в молекуле сульфат алюминия А l 2 ( SO 4 )3 |
Мr(H2SO4)= 2*1+32+16*4=98
 100%= 2,04+32,65+65,3 100%= 2,04+32,65+65,3
| ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… |
ПРИМЕР №4
| а) Определить практический выход водорода, если при взаимодействии 9,8г. серной кислоты с железом, водорода выделилось 2 г. 2Fe+ 3H2SO4→Fe2(SO4)3 + 3H2 | б) Определить массу железа, которая потребуется для 60грамм сульфата железа , если выход реакции составил 85% 2 Fe + 3 H 2 SO 4 → Fe 2 ( SO 4 )3 + 3 H 2 |
Дано:
m(Fe) =9,8 гр.
m(Н2) практ. =9,8 гр.
Решение: Подставим значения в уравнение
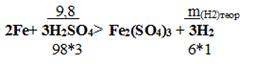

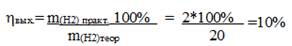
| ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… |
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить задания:
1. Используя ПСЭ Д.И. Менделеева определить число протонов, нейтронов, электронов, относительные атомные массы Аr элементов : алюминия , водорода, кислорода.
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
2. Рассчитать относительную молекулярную массу -Аl(OH)3. Рассчитайте число молекул и число молей в 30
граммах - Аl(OH)3.
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
3. Определите массовую долю каждого вида атомов в соединении- Аl(OH)3
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
4. .Определить массу сложного вещества, выделившегося при взаимодействии 60 литров
AL(NO3 )3 cо щелочью NaOH , если выход реакции 65%(н.у): AL(NO3 )3+ 3NaOH→Аl(OH)3+ 3NaNO3
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Вывод: ………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №2
«РЕШЕНИЕ РАСЧЁТНЫХ ЗАДАЧ С ПРИМЕНЕНИЕМ ГАЗОВЫХ ЗАКОНОВ ХИМИИ»
Цель: Получить практические навыки применения газовых законов для решения химических задач.
ТЕРЕТИЧЕСКАЯ ЧАСТЬ
Формулы для проведения расчётов
Уравнения Клапейрона-Менделеева
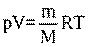
| 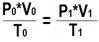 Объединённый газовый закон Бойля–Мариотта и Гей–Люссака: Объединённый газовый закон Бойля–Мариотта и Гей–Люссака:
| Закон Гей–Люссака
 ( Р- const)
( Р- const)
| Закон Бойля–Мариотта
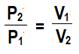 (T - const)
(T - const)
| Закон
Шарля

| Относительная плотность газа
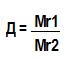
|
ПРАКТИЧЕСКАЯ ЧАСТЬ
ПРИМЕР №1 Расчёты с применением уравнения состояния идеального газа.
а) Масса 0,327•10-3 м3 газа, при 13оС и давлении 1,04•105Па равна 0,828•10-3 кг. Вычислить молярную массу газа.
Дано
V = 0,327•10-3 м3
Т = 13oC+273К= 286К
P=1,04*105Па
m=0,828•10-3 кг
Найти: М=?
Решение: Для решения задачи применим уравнение Клапейрона – Менделеева, выразим из него Молекулярную массу:
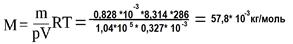
| б) Определите температуру кислорода массой 64 г, занимающего объём 1 л при давлении 500 к Па. Дано ………………………………………………………………………………………………………………………………………………………………………………………………………………………………Найти:………………………………………………………………… Решение: ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..…. …………………………………………………………………………………………………………………………………………………… |
ПРИМЕР №2 Решение задач с применением законов объединенного газовго закона Бойля–Марита и Гей–Люссака и Шарля:
а) Какой объём при нормальных условиях займут 0,4*10-3 м3 газа, находящегося при 50°С и давлении 0,954*105 Па?
Дано:
В нормальных условиях:
Т0=0+273=273К
Р0= 101, 325 кПа
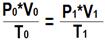 В указанных условиях:
T1=50+273=323К
Р1=95400*105 Па
V1= 0,4*10-3 м3
Найти: V0
Решение: Выразим из формулы значение объёма в нормальных условиях: В указанных условиях:
T1=50+273=323К
Р1=95400*105 Па
V1= 0,4*10-3 м3
Найти: V0
Решение: Выразим из формулы значение объёма в нормальных условиях:
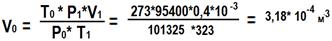
| б) Определить температуру газа , который давлении 20 кПа занимает объем равный 400мл., если в нормальных условиях этот же газ занимает 40мл. Дано ……………………………………………………………………………………………………………………………………………………………………………………………………………………… Найти:…………………………………………………………….. Решение: ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………… |
ПРИМЕР №3 Решение задач с применением законов Бойля–Марита, Гей–Люссака и Шарля:
| а) При 15 0С в баллоне с кислородом давление равно 90 атмосфер . При какой температуре оно станет равным 100 атм ? | б) При 270С объём газа равен 600 мл . Какой объём займет газ при 57 0С , если давление будет оставаться постоянным ? | в) Давление газа объёмом 3 л , равно 93,3 кПа. Каким станет давление (Т- const ),если уменьшить объём газа до 2,8 л .? |
Дано: Т1 = 273 + 15 = 288 К
Р1 = 90 атм.
Р2 = 100 атм.
Найти: Т2=?
Решение:
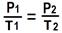 Т2= P 2 * T 1 = 100* 288 / 90 = 320 К
P1
t2= 320-273 = 470C
Т2= P 2 * T 1 = 100* 288 / 90 = 320 К
P1
t2= 320-273 = 470C
| Дано: …………………………………………………………………………………… Найти: ………………………………. Решение: ……………………………………………………………………………………………………………………………………………………………………………………………………………………. | Дано: …………………………………………………………………………………… Найти: ………………………………. Решение: ……………………………………………………………………………………………………………………………………………………………………………………………………………………. |
ПРИМЕР №4 Расчёт относительной плотности газа по другому газу.
а) Определить молекулярную массу неизвестного газа, если его относительная плотность по кислороду О2 равна 0,5
Дано: D О2 // НГ =0,5
Решение: Mrг(02)=16*2=32
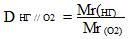 Mrг2=Mrг(02)*Dг1(г2)= 32*0,5=16
Mrг2=Mrг(02)*Dг1(г2)= 32*0,5=16
| б) Определить относительную плотность метана СН4 по отношению к воздуху (М r (воздуха )=29) ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………... ………………………………………………………………………………………………………………………………………………………… |
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить задания:
1. Определить массу газа азота, находящегося в сосуде объёмом 10 литров при давлении 400 к Па. при температуре 670С.
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
2. Определить давление газа объемом 45кПа при температуре 55 0С, если этот же газ в нормальных условиях занимает объем 400мл.
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
3. При 80 0С объём газа равен 75л. Какой объём займет этот же газ газ при 20 0С , если давление будет оставаться постоянным?
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
- Определить молекулярную массу неизвестного газа, если его относительная плотность по водороду равна 12.
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Вывод: ………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №3
«МОДЕЛИРОВАНИЕ ПОСТРОЕНИЯ ПСЭ. СТРОЕНИЕ ОБОЛОЧКИ АТОМА»
Цель: Научиться определять расположение в ПСЭ металлов, галогенов, благородных газов, лантаноидов, актиноидов, переходных элементов; ххарактеризовать изменения свойств элементов и их соединений внутри групп и периодов (металлические свойства, радиус атомов ,электроотрицательность); распределять электроны по электронным орбиталям у элементов первых четырех периодов и записывать соответствующие электронные и графические формулы
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
| Периодический закон: «Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от зарядов ядра атомов элементов.» 1. Свойства элементов внутри периода и подгруппы меняются периодично: ¾ В периодах слева направо R атомов уменьшаются- связано с ростом размера ядра. ¾ В подгруппах сверху вниз R атомов увеличиваются -растет число электронных слоев. 2. Энергия ионизации, сродство к электрону, электроотрицательность - ¾ В периоде слева направо они возрастают, поэтому способность притягивать к себе электроны увеличивается(окислительная)-снижаются металлические свойства. ¾ В подгруппе сверху вниз они снижается– способность отдавать свои электроны усиливается (восстановительная ) - растут металлические свойства. | 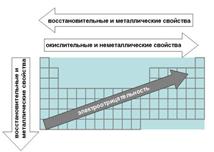 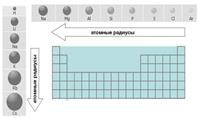
|
СТРОЕНИЕ АТОМА
| ¾ n - главное число, определяет энергетический уровень электрона; ¾ ℓ – орбитальное число, определяет форму атомной орбитали. ¾ mℓ – магнитное число, характеризует количество орбиталей одинаковой формы, mℓ = ℓ до +ℓ . ¾ ms спиновое число | Значения
¾ п=1 →ℓ=0 (s), mℓ= 0  Ns =2
¾ п=2 →ℓ=1(p), mℓ= (-1, 0, 1 ) Ns =2
¾ п=2 →ℓ=1(p), mℓ= (-1, 0, 1 )    Np =6
¾ п=3 →ℓ=2(d), mℓ= (-2, -1, 0, 1, 2 ) Np =6
¾ п=3 →ℓ=2(d), mℓ= (-2, -1, 0, 1, 2 )      Nd =10
¾ п=4 →ℓ=3(f), mℓ= (-3,-2,-1,0,1,2,3 ) Nd =10
¾ п=4 →ℓ=3(f), mℓ= (-3,-2,-1,0,1,2,3 )        Nf=14
Размещение: ms=+/-0,5 → Nf=14
Размещение: ms=+/-0,5 → 
|
· Принцип наименьшей энергии (правило Ключковского)- электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией:1 s 2 <2 s 2 <2 p 6 <3 s 2 <3 p 6 <4 s 2 <3 d 10 <4 p 6 <5 s 2 <4 d 10 <5 p 6 <6 s 2 <4 f 14 <5 d 10 <6 p 6 <7 s 2 <5 f 14 <6 d 10 <7 p 6
· Принцип Паули: В одной квантовой ячейке не может быть 2х- электронов с параллельными спинами.
· Правило Гунда -электроны заполняют квантовые ячейки последовательно –по одному. Электроны, заполняющие квантовые ячейки последовательно, имеют одинаковые спины.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Задание №1
Заполните таблицу. Как изменяются: атомный радиус, металлические свойства элементов, электроотрицательность в указанном ряду.
Задание №2 Укажите элемент, которому принадлежит данная электронная формула: a) 1s22s22p63s23p64s23d6…………………………………………………….. b) 1s2 2s2 2р63s23р64s23d104p6……………………………………………… Задание №3 Составить электронно- графические формулы химических элементов и ионов.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить задания:
1. Какому элементу принадлежит данная электронная формула: 1s22s22p63s23p64s23d104p6…………………………
2. Составьте электронные конфигурация и графические формулу элементов № 5,10 и ионов S6+, Mg2+
| №5 ------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------ | №10 ------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------ | S 6+ ------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------ | М g 2+ ------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------ |
К, Na, Li укажите их название, общее число электронов, относительную атомную массу, формулу высшего оксида, гидроксида. Как изменяются: атомный радиус, металлические свойства элементов, электроотрицательность в данном ряду.
| Название | е- = р+ | Ar | Высший оксид | Высший гидроксид | Рост металлических свойств | Атомный радиус | Электо отрицательность | |
| K |
Ý ß |
Ý ß |
Ý ß | |||||
| Na | ||||||||
| Li |
Вывод: ………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №4
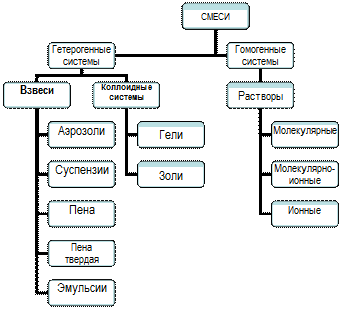
«СМЕСИ И ПРИМЕСИ. РЕШЕНИЕ ЗАДАЧ НА ОПРЕДЕЛЕНИЕ МАССОВОЙ ДОЛИ ПРИМЕСЕЙ»
Цель: Ознакомиться с видами смесей, научиться выполнять готовить суспензию и эмульсию; решать задачи на определение массовой доли компонентов смеси и примесей
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
| · ЧИСТЫМИ- называют вещества, которые обладают постоянными физическими свойствами и состоят из молекул одного вида. · СМЕСЯМИ –называют системы, состоящие из нескольких чистых веществ. · ПРИМЕСЬ- это один из компонентов смеси. |  ФОРМУЛЫ ДЛЯ РАСЧЁТА ФОРМУЛЫ ДЛЯ РАСЧЁТА
|
Смеси могут быть:
1. Однородными (гомогенные)- граница раздела фаз не выражена, частицы не определяется. Для разделения применяют выпаривание, кристаллизацию, дистилляцию, хроматографию.
Растворы –этогомогенные системы, состоящие из растворителя, растворенного вещества и продуктов их взаимодействия. Вещества, составляющие раствор, называют компонентами реакции.
2. Неоднородными (гетерогенные)- граница раздела фаз выражена, частицы определяются. Иначе их называют дисперсными системами. Для разделения применяют отстаивание, фильтрование и действие магнита.
Дисперсные системы – это гетерогенные системы ,в которых одно (или несколько) вещество - дисперсная фаза в виде очень мелких частиц равномерно распределено в объеме другого -дисперсионной среде
| | ТИПЫ ДИСПЕРСНЫХ СИСТЕМ | ||

|  …………………………………………
…………………………………………
|  …………………………………………
…………………………………………
| |
 …………………………………………
…………………………………………
|  …………………………………………
…………………………………………
|  …………………………………………
…………………………………………
| |
 …………………………………………
…………………………………………
|  …………………………………………
…………………………………………
|  …………………………………………
…………………………………………
| |
ПРАКТИЧЕСКАЯ ЧАСТЬ
| Задача№1 | |
| Определить массу чистого вещества в 200гр технического СаО, если содержание в нем примесей 30%. Дано: m(CaO) тех.= 200 гр. Wприм.= 30% Найти: m(CaO) чист.= ? Решение: .m(прим.) = W прим.* m ( CaO )тех. = 0,3*200= 60гр. 100% m(CaO) чист.= m (CaO)тех.- m(прим.) =200-60= 140гр. | Определить массу примесей в 300гр технического СаС2 , если содержание примесей в нем 64%. Дано: Найти:………………………… Решение:……………………………………………………… ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… |
| Задача№2 | |
| 11,2 гр. мрамора растворили в избытке соляной кислоты и получили 2, 24 л газа (н.у.). Рассчитайте массовую долю примесей в израсходованном образце мрамора. Дано: m(CaCO3)тех.= 11.2гр. V(CO2)=2,24л. Найти: Wприм.= ? Решение: Хгр. 2,24л CaCO3 + 2 HCl = CaCl 2 + CO2+ H2O 40+12+48 22,4л. m(CaCO3)чист.= Х= 100* 2,24 =10гр. 22,4 m(примесей) = m(CaCO3)тех.- m(CaCO3)чист. m(примесей) = 11,2-10= 1,2гр. Wприм.= m (примесей)*100% = 1,2*100% = 10,7% m(CaCO3)тех. 11,2 | Вычислите, какая масса оксида железа (III) содержащего 10 % примесей, необходима для получения железа массой 400 кг. Дано: ………………………………… ………………………………… Найти:………………………… Решение: ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… |
| Задача№3 | |
| Рассчитайте массу сложного вещества , образованного при взаимодействии с соляной кислотой 325 г цинка, содержащего 20% примесей. Дано: Wприм.= 20% m (Zn)тех.= 325гр. Найти: m (ZnCl2) =? Решение: Wприм.= m (примесей)*100% m (Zn)тех. .m(примесей) = W прим.* m ( Zn )тех. = 0,2*325= 65гр. 100% m (Zn)чист.= m (Zn)тех.- .m(примесей)= 325-65= 260гр. 260гр. Хгр.. Zn + 2HCl = ZnCl2 + H2 65 65+71 m (ZnCl2) = 136*260/ 65 = 544гр. | Определить объем выделившегося газа, который можно получить при термическом разложении 600гр. карбоната магния, содержащего 10% примесей? М gCO 3 = Mg О+ CO 2 Дано: ………………………………… ………………………………… Найти: ………………………… Решение:………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… |
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить задания:
· Определить процентное содержание примесей в бромиде железа , если при взаимодействии 400 грамм его с избытком хлора получили 0,224 литра брома: 2 FeBr 3 + 3 Cl 2 = 2 FeCl 3 + 3 Br 2
| Дано: ………………………………… ………………………………… Найти: ………………………… | …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… |
Вывод: ………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №5
«РЕШЕНИЕ РАСЧЕТНЫХ ЗАДАЧ НА ОПРЕДЕЛЕНИЕ ЖЁСТКОСТИ ВОДЫ»
Цель: Научиться выполнять расчеты связанные с определением общей, временной и постоянной жесткости воды.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Жёсткость вод ы - это совокупность свойств, обусловленных содержанием в воде ионов Са2+,Mg2+.
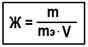
| ¾ m – масса вещества, обусловливающего жесткость воды ,мг; ¾ V –объем воды, л. ¾ mЭ молярная масса эквивалента вещества. |
· Жвр - временная (карбонатная) жёсткость- обусловлена гидрокарбонатами кальция и магния (Са(НСО3)2; Mg(НСО3)2),устраняется обычным кипячением.
· Ж пост -постоянная (некарбонатная) жёсткость, вызвана присутствием других солей, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).
Суммарная концентрация ионов Ca2+ (кальциевая Ж. в.) и Mg2+ (магниевая Ж. в.) называется общей жесткость, она образуется:
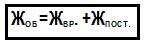
Типы воды (по жесткости)
· Мягкая вода с жесткостью менее 3,0 ммоль/л или мг-экв/л,
· Средней жесткости – 3,0-6,0 ммоль/л или мг-экв/л
· Жесткая – более 6,0 ммоль/л или мг-экв/мл.
ПРАКТИЧЕСКАЯ ЧАСТЬ
| Задача №1 | |
Чему равна жесткость воды, если для ее устранения к 50 л воды потребовалось прибавить 21,2 г карбоната натрия?
Дано :
 V(H2O)= 50 л .
m(Na2CO3)= 21,2 гр .
Найти: Ж=?
Решение:
mэ (Na2CO3) = М r ( Na 2 CO 3 ) = 46+12+48 = 53 г/моль.
n*ZNa 2* 1
Ж = 21,2*1000 /(53 . 50) = 0,008 моль/л.=
= 8 ммоль/л (мг-экв/л) V(H2O)= 50 л .
m(Na2CO3)= 21,2 гр .
Найти: Ж=?
Решение:
mэ (Na2CO3) = М r ( Na 2 CO 3 ) = 46+12+48 = 53 г/моль.
n*ZNa 2* 1
Ж = 21,2*1000 /(53 . 50) = 0,008 моль/л.=
= 8 ммоль/л (мг-экв/л)
| Какая масса СаSO4 содержится в 200 л воды, если жесткость, обуславливаемая этой солью, равна 8 ммоль/л. Дано: ………………………………… ………………………………… Найти: ………………………… Решение …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. |
| Задача №2 | |
Вода, содержащая только гидрокарбонат кальция, имеет жесткость 9 ммоль/л. Какая масса гидрокарбоната кальция содержится в 500 л воды?
Дано:
 V ( H 2 O )= 500л.
Ж=9ммоль/л
Найти: m (Са(Н CO 3 )2) = ?.
Решение:
mэ (Са(Н CO 3 )2) = М r (Са(НCO3)2) = 40+ 2+16*6
n*ZСa 2
mэ (Са(Н CO 3 )2)= 162/ 2= 81 г/моль
mэ (Са(Н CO 3 )2)= mэ (Са(Н CO 3 )2)* Ж * V(H 2 O)=
81*9*10-3 * 500 = 364,5 г. V ( H 2 O )= 500л.
Ж=9ммоль/л
Найти: m (Са(Н CO 3 )2) = ?.
Решение:
mэ (Са(Н CO 3 )2) = М r (Са(НCO3)2) = 40+ 2+16*6
n*ZСa 2
mэ (Са(Н CO 3 )2)= 162/ 2= 81 г/моль
mэ (Са(Н CO 3 )2)= mэ (Са(Н CO 3 )2)* Ж * V(H 2 O)=
81*9*10-3 * 500 = 364,5 г.
| Вычислить жесткость воды, зная, что в 400 мл. ее содержится 202,5 г Mg (HCO3)2. Дано: ………………………………… ………………………………… Найти: ………………………… Решение …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. |
| Задача №3 | |
Для устранения общей жесткости по известково-содовому методу добавлено 7,4г Са(ОН)2 и 5,3г Na2CO3. Рассчитать временную и постоянную жесткость 50л. воды.
Дано:
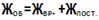 V ( H 2 O )= 50л.
m (Са(ОН)2)=7,4гр. V ( H 2 O )= 50л.
m (Са(ОН)2)=7,4гр.
 m (Na2CO3)=5,3гр.
Найти: Ж общ. = ?
Решение:
Добавление к воде Са(ОН)2 может устранить временную жесткость, а добавление Na2CO3 – постоянную жесткость. При добавлении этих реагентов к воде происходят следующие реакции:
Mе(HCО3)2 + Са(ОН)2 = МеCО3 + СаCО3 + 2Н2О
Mе(NО3)2 + Na2CO3 = MeCO3 + 2NaNO3
(где Ме2+ = Са2+; Mg2+; Fe2+ и др. )
mэ (Са(ОН)2)= М r (Са(ОН)2) = 40+ 2+32 = 37 г/моль
n*ZСa 2
mэ (Na2CO3)= М r(Na2CO3) = 23+ 12+48 = 53 г/моль
n*ZNa 2
Жвр.= m (Са(ОН)2)____ = 7,4гр. = 0,004моль/л
mэ (Са(ОН)2)* V(H 2 O) 37*50
Жвр.= 4 ммоль/л
Жпост.= m (Na2CO3)____ = 5,3. = 0,002моль/л
mэ (Na2CO3)* V(H2O) 53*50
Жпост.= 2 ммоль/л
Ж общ.= 4+2= 6ммоль/л m (Na2CO3)=5,3гр.
Найти: Ж общ. = ?
Решение:
Добавление к воде Са(ОН)2 может устранить временную жесткость, а добавление Na2CO3 – постоянную жесткость. При добавлении этих реагентов к воде происходят следующие реакции:
Mе(HCО3)2 + Са(ОН)2 = МеCО3 + СаCО3 + 2Н2О
Mе(NО3)2 + Na2CO3 = MeCO3 + 2NaNO3
(где Ме2+ = Са2+; Mg2+; Fe2+ и др. )
mэ (Са(ОН)2)= М r (Са(ОН)2) = 40+ 2+32 = 37 г/моль
n*ZСa 2
mэ (Na2CO3)= М r(Na2CO3) = 23+ 12+48 = 53 г/моль
n*ZNa 2
Жвр.= m (Са(ОН)2)____ = 7,4гр. = 0,004моль/л
mэ (Са(ОН)2)* V(H 2 O) 37*50
Жвр.= 4 ммоль/л
Жпост.= m (Na2CO3)____ = 5,3. = 0,002моль/л
mэ (Na2CO3)* V(H2O) 53*50
Жпост.= 2 ммоль/л
Ж общ.= 4+2= 6ммоль/л
| Рассчитайте общую жесткость воды (ммоль/л), если в 0,15 л воды содержится 16,2мг гидрокарбоната кальция, 2,92мг гидрокарбоната магния, 11,10 мг хлорида кальция и 9,50мг хлорида магния. Дано: ………………………………… ………………………………… Найти: ………………………… Решение …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. |
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить одно из заданий:
- Вычислите общую жесткость (моль эк/л) воды в 200 литрах, которой находится 250мг гидрокарбоната магния , 156 мг сульфата кальция и 300 мг. гидрокарбоната кальция . Определить тип воды по жесткости.
- Рассчитать жесткость 150 мл. воды в которой присутствует 5 гр Са(НСО 3)2 и 7гр. Mg (НСО 3)2
- Вода, содержащая только гидрокарбонат кальция, имеет жесткость 5 ммоль/л. Какая масса гидрокарбоната кальция содержится в 800мл. воды?
| Дано: ………………………………… ………………………………… ………………………………… Найти: ………………………… | …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… |
Вывод: ………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №6
«РЕШЕНИЕ ЗАДАЧ НА ОПРЕДЕЛЕНИЕ ПРОЦЕНТНОЙ, МОЛЯРНОЙ И МОЛЯЛЬНОЙ КОНЦЕНТРАЦИИ
РАСТВОРОВ»
Цель: Научиться выполнять расчёты на определение процентной, молярной и моляльной концентрации с учётом разбавления растворов и увеличения доли растворимого вещества.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Раствор- это однородная система , состоящая из растворителя ,растворенных веществ и продуктов их взаимодействия. По агрегатному состоянию различают растворы: жидкие , твердые, газообразные.
Состав раствора обычно передается содержанием в нем растворимого вещества в виде:
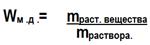
| ¾ Массовая доля (безразмерная величина) – это отношение массы растворенного вещества к массе всего раствора: |
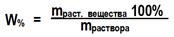
| ¾ Процентная концентрация ( %) – это величина показывающая сколько грамм растворенного вещества cсодержится в 100 гр. раствора |

| ¾ Молярная концентрация , или молярность (моль/литр)- это величина показывающая сколько молей растворимого вещества содержатся в 1 литре раствора |
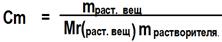
| ¾ Моляльная концентрация (моль/кг)- это величина показывающая сколько молей растворимого вещества содержатся в 1 килограмме растворителя: |
ПРАКТИЧЕСКАЯ ЧАСТЬ
| Задача №1 | |
| Вычислить процентную концентрацию соли в растворе , если в 450 г воды растворили 50 гр. CuSO4 Дано: m (CuSO4)=50г. m (Н 2O)=450г. Найти: W% Решение mраствора = m (CuSO4)+m (Н 2O)= =450+50=500гр. W% = m ( CuSO 4 ) * 100% · mраствора W% = 50*100%/500=10% | Сколько грамм соли и воды содержится в 800 граммах 12 %-ного раствора NaNO3? Дано: ………………………………… ………………………………… Найти: ………………………… Решение …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. |
| Задача №2 | |
| Определить молярность и моляльность раствора серной кислоты, если объём раствора 600 литров а масса растворённой в нём кислоты 196 грамм , если плотность раствора 1,1г/л. Дано: Vраствора=600л m (H2SO4)=196г ρ раствора= 1,1г/л Найти: Ср,Сm Решение Используя ПСЭ рассчитаем относительную молекулярную массу растворённой кислот Mr (H2SO4)= 98 Определим молярность Ср = m ( H 2 SO 4 ) = 196/98·600=0,0033моль/л. Mr (H2SO4) ·Vраствора. Определим массу раствора и моляльность m раствора = ρ раствора* Vраствора = 1,1* 600= 660 гр. Ср = m(H2SO4) = 196 /98*(660-196)=0,0043моль/кг Mr (H2SO4)*mрастворителя | Определить молярность и моляльность раствора соляной кислоты массой 700 гр. и концентрацией 10%, если плотность раствора 1,25 г/мл Дано: ………………………………… ………………………………… ………………………………… ………………………………… Найти: ………………………… Решение …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. |
| Задача №3 | |
| Определить процентную концентрацию раствора КОН, если для его получения к400граммам 30%-ного раствора КОН прилили 50 грамм воды. Дано: W% 1 = 30%. m равтвора1=400г. m (Н 2O)=50г Найти: W% 2 Решение: W%= m (КОН) * 100% / m раствора Определим массу растворённого вещества m(КОН)= W%· mраствора = 30·400 / 100=120г. 100% · Концентрация раствора после добавления воды W%2= m (КОН) * 100% = 120·100% / (400+50) = 26,67% (mр.+m(Н 2O)) | Определить процентную концентрацию раствора соли NaCL , если для его получения к 400 гр/ 50%-ного раствора соли NaCL добавили 20 гр/ этой же соли. Дано: ………………………………… ………………………………… ………………………………… Найти: ………………………… Решение …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. |
| Задача №4 | Задача №5 |
| Сколько сахара надо добавить к 300г 30% сахарного сиропа, чтобы получить 40% сироп. Определить моляльность полученного раствора. Дано: ………………………………… ………………………………… Найти: ………………………… Решение …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. | Определить W % концентрацию раствора соли К CL , если для его получения к 600 г 50%-ного раствора этой соли добавили 200гр. 10%-ного раствора К CL Дано: ………………………………… ………………………………… Найти: ………………………… Решение …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. …………………………………………………………………. |
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить одно из заданий:
A. Сколько грамм сахара необходимо добавить к 300г. 60%-ного сахарного раствора, чтобы он стал 90%-ным
B. Смешали 40 гр. 9%-ного раствора уксуса и 20гр. 70%-ного раствора уксусной кислоты. Определить концентрацию полученного раствора уксусной кислоты.
C. Определить процентную, молярную и моляльную концентрацию раствора массой 20 гр., содержащего 3 гр. соли NaCL, плотность которого 1,2 гр/л
| Дано: ………………………………… ………………………………… Найти: ………………………… | …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… |
Вывод:
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №7
«КЛАССЫ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ»
Цель: Познакомиться с основными классами неорганических веществ, исследовать наиболее распространенные свойства данных соединений.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Кислоты – сложные вещества, содержащие в своем составе водород и кислотныей остаток.
Основания-это соединения, состоящие из катионов металла ( или катиона аммония) и гидроксильной группы ОН1-
Соли – это продукты полного или частичного замещения атомов «Н» в молекуле кислоты на металл(либоNH4+), либо групп «ОН» в молекуле основания на кислотный остаток.
Оксиды – это сложные вещества, состоящие из двух видов химических элементов, один из которых- кислород в степени окисления 2-.

ПРАКТИЧЕСКАЯ ЧАСТЬ
| Ход работы | Наблюдения, реакции, рисунки | Вывод |
| Опыт № 1 ОЗНАКОМЛЕНИЕ СО СВОЙСТВАМИ КИСЛОТ | ||
| а) Кислоты меняют цвет индикатора В 3-пробирки влить по 1мл. НСL и добавим лакмус, метилоранж, фенолфталеин | Наблюдали: …………………………………………………........ …………………………………………………........ …………………………………………………........ …………………………………………………........ | ………………………………… ………………………………… ………………………………… ………………………………... |
| б)Взаимодействие кислот с металлами: 1. Взаимодействие кислот неокислителей с металлами В 2-пробирки влить по 1-2мл. соляной кислоты и добавим кусочки меди и цинка. | Наблюдали: …………………………………………………........ …………………………………………………........ Допишем реакции: HCL +Zn→......................................................... HCL+Cu→.......................................................... | Кислоты (все кроме HNO3, H2SO4) с металлами, ¾ стоящими в РН до «Н» ………………………………... ………………………………… ¾ стоящими в РН после «Н» ………………………………... |
| 2.Взаимодействие серной кислоты с металлами ¾ В 2-пробирки влить по 1-2мл. разбавленной серной кислоты и добавим кусочки меди и цинка. ¾ В 2-пробирки влить по 1-2мл. концентрированной серной кислоты и добавим кусочки меди и цинка. | Допишем реакции: H2 SO4(разб) +Zn→.............................................. H2 SO4(разб) +Cu→............................................. Наблюдали: …………………………………………………........ …………………………………………………........ Допишем реакции: H2 SO4(конц) +Zn→SО2 +…............................. →Н2S +................................. →S +….................................... H2 SO4(конц) +Cu→ SО2 +............................... Наблюдали: …………………………………………………........ …………………………………………………........ | Разбавленная H 2 SO 4 с металлами, ¾ стоящими в РН до «Н» ………………………………... ¾ стоящими в РН после «Н» ………………………………... Концентрированная H 2 SO 4 с металлами, ¾ стоящими в РН до «Н» ………………………………... ¾ стоящими в РН после «Н» ………………………………... |
| 3. Взаимодействие азотной кислоты с металлами ¾ В 2-пробирки влить по 1-2мл. разбавленной азотной серной кислоты и добавим кусочки меди и цинка. ¾ В 2-пробирки влить по 1-2мл. концентрированной азотной кислоты и добавим кусочки меди и цинка. ¾ В пробирку с HNO3 конц. опустим алюминивую проволоку (предварительно очищенную) | Допишем реакции: HNO3(разб) +Zn→NH3 +................................... HNO3(разб) +Cu→ NО +.................................. Наблюдали: …………………………………………………........ …………………………………………………........ Допишем реакции: HNO3(конц) +Zn→NО2 +.................................. HNO3(конц) +Cu→ NО2 +................................ HNO3(конц) +Al→.............................................. Наблюдали: …………………………………………………........ …………………………………………………........ | Разбавленная HNO3 с металлами, ¾ стоящими в РН до «Н» ………………………………... ………………………………… ¾ стоящими в РН после «Н» ………………………………... Концентрированная HNO3 с металлами, ¾ стоящими в РН до «Н» ………………………………... ¾ стоящими в РН после «Н» ………………………………... |
| с) Кислоты взаимодействуют с основными оксидами В 3-пробирки влить по 1мл. НСL и добавим оксиды Fe2O3 и CаО. Пробирку с Fe2O3 нагреем | Допишем реакции: HCL +Fe2O3→............................................ HCL +CаО→.............................................. Наблюдали: ............................................................................ ............................................................................ | ………………………………… ………………………………… ………………………………… ………………………………... |
| д) Кислоты взаимодействуют с солями ¾ В пробирку влить 1мл серной кислоты и добавить хлорид бария. ¾ Нанести 1мл соляной кислоты на кусок мрамора. | Допишем реакции: HCL +СаСО3 →............................................... H2 SO4+ВаСL2 →............................................. Наблюдали: ............................................................................ ............................................................................ ........................................................................... | …………………………………….. …………………………………….. …………………………………….. …………………………………….. …………………………………….. …………………………………….. |
| Опыт № 2 ОЗНАКОМЛЕНИЕ СО СВОЙСТВАМИ ОСНОВАНИЙ- | ||
| а) Меняют цвет индикатора В 3-пробирки влить по 1мл. NaOH и добавим лакмус, метилоранж, фенолфталеина | Наблюдали: .................................................................................................................................................................................................................. | …………………………………….. …………………………………….. …………………………………….. …………………………………….. |
| б) Взаимодействуют с кислотами В пробирку влить по 1мл. NaOH и добавим фенолфталеин , после чего добавить HCL | Допишем реакцию: NaOH +HCL→.................................................. Наблюдали: ............................................................................ ............................................................................ | …………………………………….. …………………………………….. …………………………………….. …………………………………….. …………………………………….. |
| с)Взаимодействуют с солями В пробирку поместим 1мл раствора CuSO4 , добавим по 1-2 капли NaOH.Осадок меди будем длительно нагревать . | Допишем реакцию: СuSO4+ NaOH ® ………………………… Сu(ОН)2нагреем®………………............ Наблюдали: ............................................................................ ............................................................................ | …………………………………….. …………………………………….. …………………………………….. …………………………………….. …………………………………….. …………………………………….. |
| Опыт №3 ОЗНАКОМЛЕНИЕ СО СВОЙСТВАМИ СОЛЕЙ | ||
| а) Взаимодействуют друг с другом В пробирку поместим 1мл. раствора сульфида натрия Na2S, добавим 1мл. нитрата серебра | Допишем реакцию: Na2S+ AgNO3® ………………………… Наблюдали: ............................................................................ ............................................................................ | …………………………………….. …………………………………….. …………………………………….. …………………………………….. …………………………………….. |
| б) Взаимодействуют c металлами В 3 пробирки поместим по 1мл. растворов AgNO3, СuSO4 Pb(NO3)2добавим металлы соответственно Сu, Fe, Zn | Допишем реакцию: Сu+ AgNO3® …………………………..… … Fe + СuSO4 ® ……………………………… Zn+ Pb(NO3)2® …………………………….. Наблюдали: ............................................................................ ........................................................................... | …………………………………….. …………………………………….. …………………………………….. …………………………………….. …………………………………….. …………………………………….. |
Вывод:
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №8
«СОСТАВЛЕНИЕ УРАВНЕНИЙ ГИДРОЛИЗА СОЛЕЙ»
Цель: Познакомиться с понятием «гидролиз солей» .Научиться определять среду раствора солей, кислот, щелочей с помощью индикаторов и составлять реакции гидролиза.
ТЕОРЕТИЧЕСКИЙ ОБЗОР
Гидролиз –это процесс взаимодействия ионов соли с водой , приводящий к образованию слабого электролита .
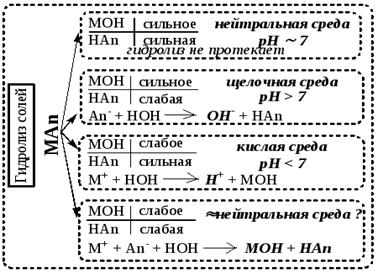
Все соли можно разделить на 4 группы:
| Сведения по веществам · Сильные кислоты – кислоты, являющиеся сильными электролитами (H2SO4, HCl, HNO3, HBr, HI, HClO4 и другие). · Слабые кислоты – кислоты, являющиеся слабыми электролитами (H2CO3, H2SO3, H2S, H2SiO3, H3PO4 , НСN и другие) · Сильные основания – сильные электролиты - щелочи (NaOH, KOH, и другие). · Слабые основания – нерастворимые основания, слабые электролиты (Cu(OH)2, Ca(OH)2, NH4OH, Al(OH)3 и др. |
Глубина гидролиза зависит от температуры (чаще всего ее приходится повышать) и концентрации раствора (при разбавлении раствора гидролиз усиливается).
| ПРОДУКТЫ НЕОБРАТИМОМОГО ГИДРОЛИЗА | ||
| · ОСАДКИ: трудно растворимое вещество согласно таблицы растворимости Например: AL(OH)3↓ | 1. ГАЗЫ: Н2S↑, H2CO3→ CO2↑+H2O H2SO3→ SO2↑+H2O NH4OH→NH3↑+H2O | СЛАБОДИССОЦИИРУЮЩИЕ ВЕЩЕСТВА: H2O, HF, СН3СООН HNO2, HCN, H3PO4 |
ПРАКТИЧЕСКАЯ ЧАСТЬ
| 1. Соль образована сильным основанием и сильной кислотой (К2 SО4, NaNO3,)– гидролиз не идет , | |
| Пример №1 NaCL NaCL + HOH → N аОН + HCL Na++CL- + HOH→ Na1++ ОН 1- + H1++CL1- HOH→ ОН 1- + H+ Среда нейтральная рН = 7 | К2 S О4 + HOH →……………………………………………… …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... |
| 2. Соль образована сильным основанием и слабой кислотой (например : Na2СО3, К2S, Ва(NO2)2, СН3СООLi) -гидролиз протекает в щелочной среде рН >7 , гидролиз идет по аниону. | |
| Пример №2 Na 2 SO 3 1 ступень I. Na 2 С O 3 + HOH → N аОН + Na НС O 3 2Na++СO32- + HOH→ Na1++ ОН1- + Na1++HСO31- СO32- + HOH→ ОН1- + H СO31- 2 ступень II. NaНСO3+ HOH→Nа ОН +Н2СO3 (Н2 СO3→СO2↑+ H2O ) Na++H++ СO32- + HOH→Na++ ОН1- + СO2↑ + H2O H1++ СO32- + HOH→ ОН 1- + СO2↑ + H2O Избыток ионов OH–в растворе обусловливает щелочную реакцию среды в растворе (pН>7) | К2 S + HOH →………………………………………………… …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... |
| 3. Соль образована слабым основанием и сильной кислотой (MgSО4, AlCL3, Zn(NO3)2, ..) - гидролиз протекает в кислой среде рН< 7 , гидролиз идет по катиону. | |
| Пример №3: AlCl3 1-ступень I. AlCl3 +Н2О→ AlОНCl2 +НCL Al3+ + 3 CL1- +НОН→ Al ОН2+ +2CL1- +Н1+ +CL1- Al 3+ +НОН→ Al ОН2+ +Н1+ 2 ступень II. Al ОНCl2+Н2О→ Al (ОН)2Cl +НCL AlOH2+ +2CL1- +НОН→ Al(ОН)21++CL1-+Н1+ + CL1- AlOH2+ + НОН→ Al (ОН)21+ + Н1+ 3 ступень III. Al (ОН)2Cl +Н2О→ Al (ОН)3↓ +НCL Al (OH)21++CL1- +НОН→ Al (ОН)3↓+Н1+ +CL1- Al (OH)21++НОН→ Al (ОН)3↓+Н1+ Избыток ионов H+ в растворе обусловливает кислую реакцию среды в растворе (pН<7). | С uSO4 + НОН →……………………………………………… …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... |
| 4. Соль образована слабым основанием и слабой кислотой (MgСО3, Al 2S3, Zn(NO2)2, ..) - гидролиз протекает практически в нейтральной среде рН ближе к 7 , гидролиз идет по катиону и аниону: | |
| Пример №4: CH 3 COONH 4 CH3COONH4+ Н2О→CH3COOН+NH3↑+H2O NH41+ +CH3COO1-+НОН→CH3COOН+NH3 ↑+H2O | Mg СО3 + НОН →……………………………………………… …………………………………………………………............... …………………………………………………………............... …………………………………………………………................ |
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить одно из заданий:
Записать реакции гидролиз в трех молекулярно-ионных формах по стадиям , укажите характер среды(кислая , нейтральная , щелочная):
А-программа a) Li2S + НОН; б)Fe(NO3)3+ НОН; в) NH4NO3 + НОН г) CsNO3+ НОН
Б-программа а) Li2SO3 + HOH, б)NH4J + НОН в)KBr + НОН
С-программа а) NH4J +HOH б)KCL + НОН
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
Вывод:
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №9
«ХИМИЧЕСКИЕ РЕАКЦИИ: ПРИСОЕДИНЕНИЯ, ЗАМЕЩЕНИЯ, РАЗЛОЖЕНИЕ, РЕАКЦИИ ИОННОГО ОБМЕНА, ЭНДО-, ЭКЗОТЕРМИЧЕСКИЕ РЕАКЦИИ»
Цель: Научиться практически выполнять реакции соединения, разложения, замещения, ионного обмена. составлять РИО, идущие необратимо .
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
ХИМИЧЕСКАЯ РЕАКЦИЯ, или химическое превращение, — это процесс, во время которого из одних веществ образуются другие вещества, отличающиеся по химическому составу и строению.
| ЗАМЕЩЕНИЯ | РАЗЛОЖЕНИЯ | ПРИСОЕДИНЕНИЯ | ОБМЕНА |
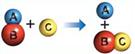 Реакция замещения —происходит замещение одних атомов , содержащихся в молекуле, на другие.
Реакция замещения —происходит замещение одних атомов , содержащихся в молекуле, на другие.
|  Реакция разложения —из исходного вещества образуется два и более новых веществ:
СаСО3t® СаО+СО2
Реакция разложения —из исходного вещества образуется два и более новых веществ:
СаСО3t® СаО+СО2
|  Реакция присоединения —из исходных веществ получается одно новое вещество:
Н2+ CL2®2HCL.
Реакция присоединения —из исходных веществ получается одно новое вещество:
Н2+ CL2®2HCL.
|  Реакции обмена—происходит обмен атомами , входящими в состав молекулы:
Реакции обмена—происходит обмен атомами , входящими в состав молекулы:
|
РЕАКЦИИ ИОННОГО ОБМЕНА
РИО идут в соответствии со схемой: AB + C Д à АД + ВС
Записываются РИО в трёх формах : молекулярная форма, полное ионно- молекулярное уравнение, сокращённое ионно- молекулярное уравнение.
РИО протекает необратимо в трех случаях, когда образуется:
| 1. ТРУДНОРАСТВОРИМОЕ ИЛИ НЕРАСТВОРИМОЕ ВЕЩЕСТВО –ОСАДОК («М» или «Н» в таблице растворимости) AL(OH)3↓, Cu(OH)2↓ | 2. ГАЗООБРАЗНОЕ ВЕЩЕСТВО: Н2S↑, H2CO3→ CO2↑+H2O H2SO3→ SO2↑+H2O NH4OH→NH3↑+H2O | 3. СЛАБОДИССОЦИИРУЮЩИЕ ВЕЩЕСТВА: H2O, HF, СН3СООН HNO2, HCN, H3PO4 |
ПРАКТИЧЕСКАЯ ЧАСТЬ
| ¾ РЕАКЦИИ ИОННОГО ОБМЕНА | ||
| а) РИО обратимые, идущие с образованием хорошо дислоцирующих растворимых веществ Например: KCl + Na NO3®KNO3 + NaCl K+ + Cl- + Na+ + NO3- ↔K+ + NO3- + Na+ + Cl- С точки зрения ТЭД эти реакции не идут, так как продукты и реагенты этих реакций - сильные электролиты, существующие в растворе в виде ионов. |
1. NaNO3+ HBr→……………………………………........... …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... | |
| б) РИО необратимые, идущие с образованием трудно растворимого соединения – осадка. Например: AgNO3 + NaCl → AgCl+ NaNO3 Ag+ + NO3- + Na+ + Cl- →AgClâ + Na+ +NO3- Ag+ + Cl- → AgCl | 2. С uSO 4 + NaOH →….……………………………............. …………………………………………………………........... …………………………………………………………........... | |
| б) РИО необратимые, идущие с образованием газообразных веществ. Например: Na2S + 2HCl→2 NaCl + H2Sá 2Na+ + S-2 + 2H+ + 2Cl- → 2Na++ 2Cl- + H2S↑ S-2 + 2H+ →H2Sá |
3. Na2CO3 + HC l → ……………………………………... …………………………………………………………........... …………………………………………………………........... …………………………………………………………...........
| |
| РИО необратимые, идущие с образованием слабодиссоциирующих веществ. Например: NaOH + HCl→ NaCl + H2O Na+ + OH- + Cl- +Н+→Na+ + Cl- + H2O OH- + H+ → H2O |
4. К3 PO 4 + HCL →……………………………………........... …………………………………………………………............... …………………………………………………………............... | |
| ЭНДО – и ЭКЗОТЕРМИЧЕСИЕ РЕАКЦИИ | ||
| а) ЭКЗОТЕРМИЧЕСКАЯ РЕАКЦИЯ В химическом стакане в воде растворяем гранулы NaOH и наблюдаем за происходящим. Измеряем температуру раствора термометром. | Наблюдали: …………………………………………………………............... …………………………………………………………............... | |
| б) ЭНДОТЕРМИЧЕСКАЯ РЕАКЦИЯ В химическом стакане в воде растворяем роданид аммония NH4SCN и наблюдаем за происходящим. | Наблюдали: …………………………………………………………............... …………………………………………………………............... | |
| РЕАКЦИЯ РАЗЛОЖЕНИЯ | ||
|
В пробирку поместить немного карбоната меди, собрать прибор как на рисунке. Нагреть содержимое. | Наблюдали: …………………………………………………………............... …………………………………………………………............... …………………………………………………………............... СuCO3®……………………………………………………… | |
| РЕАКЦИЯ ЗАМЕЩЕНИЯ | ||
|
| Наблюдали: …………………………………………………………............... ………………………………………………………............... Н2SO4 (разб.)+ Fe ®….…………………………………..... | |
| РЕАКЦИИ ПРИСОЕДИНЕНИЯ | ||
|
Кусочек алюминия помещаем в пробирку с бромом, алюминий воспламеняется в броме | Наблюдали: …………………………………………………………............... …………………………………………………………............... Al + Br2 ®….……………………………………...................... | |
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить одно из заданий:
Записать, РИО в трех формах между веществами:
А-программа a)Ca(OH)2+ HNO3; б) (NH4)2CO3 +HCL; в) AlCL3+ KOH.
Б-программа a ) K2SO3+ HCL ; б) Fe (OH)3 + H2SO4.
С-программа а) MgCL2 +KOH
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
Вывод:
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №10
«МЕТОД ЭЛЕКТРОННОГО БАЛАНСА В ОВР»
Цель: Познакомиться с понятием ОВР, окислитель , восстановитель, процесс окисления, восстановления, научиться различать виды ОВР, расставлять коэффициенты методом электронного баланса.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
ОКИСЛИТЕЛЬНО-ВОСТАНОВИТЕЛЬНЫЕ РЕАКЦИИ–это реакции, протекающие с изменением степеней окисления элементов , входящих в состав веществ.
Метод электронного баланса-один из методов уравнивания окислительно-восстановительных реакций (ОВР)
В ходе ОВР одни элементы отдают электроны, другие принимают.
ü Восстановители - атомы , или вещества отдающие свои электроны, а процесс отдачи электронов – окисление : АL0-3e-® AL3+
ü Окислители- атомы , или вещества принимающие электроны, а процесс принятия электронов – восстановление : Fe2++2e-® Fe0
Различают 4 типа ОВР:
¾ ВНУТРИМОЛЕКУЛЯРНЫЕ- атомы окислителя и восстановителя входят в состав разных молекул
¾ МЕЖМОЛЕКУЛЯРНЫЕ - окислитель и восстановитель находятся в одной и той же молекуле
¾ ДИСПРОПОРЦИОНИРОВАНИЯ-это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты
¾ РЕПРОПОРЦИОНИРОВАНИЕ-это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт.
Степень окисления- условный заряд атома в молекуле при ее разделении на составные части.
1. Степень окисления простых веществ всегда равна нулю: СL20, Na0, H20.
2. Водород во всех соединениях проявляет степень окисления- «1+», исключение гидриды металлов: Са2+Н21-, Na1+H1-.
3. Кислород во всех соединениях проявляет степень окисления - «2-», исключение Н21+О21- и F21- O2+.
4. Степень окисления щелочных и щелочноземельных металлов всегда положительна и равна номеру группы ПСЭ Д.И. Менделеева: Na+1СL1-, Mg2+O2-.
5. У одноатомных ионов степень окисления равна заряду иона: AL3+, S2-.
6. Некоторые атому имеют несколько значений степеней окисления: HCL7+ O4, HCL1-,HCL5+ O3
7. Алгебраическая сумма степеней окисления атомов соединения равна нулю, а в сложном ионе его заряду: К+Мn+7O42-, (C4+O2-3)2-
ПРАКТИЧЕСКАЯ ЧАСТЬ
Пример №1 А l + Fe2O3 ® Fe + AL2O3
1. Тип реакции - межмолекулярная реакция,
2. Расставляем степени окисления всех элементов: Аl0 + Fe3+ 2O2- 3® Fe0 + AL3+ 2O2- 3
3. Определяем окислитель, восстановитель , количество принятых и отнятых электронов и на основании этих данных записываем уравнения процессов окисления и восстановления. При составлении электронных уравнений необходимо учитывать тот факт, чтобы число атомов в левой части баланса соответствует их числу в правой части этого же баланса. Подбираем дополнительные множители , чтобы число принятых электронов было равно отданным:
4. Найденные коэффициенты проставляем в ОВР: , 2Аl + Fe2O3® 2Fe + AL2O3 |
1. K2Cr2O7 + HCl = Cl2 + KCl + CrCl3 + H2O ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… 2. C + HNO3( конц ) = CO2 ↑ + NO2 ↑+ H2O. ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… 3. NaNO3 → NaNO2 + O2↑. ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… 4. (NH4)2Cr2O7 → N2 ↑+ Cr2O3 + H2O ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… ………………………………………………………………
5. Br2 + KOH → KBr + KBrO3 + H2O, ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… 6. H2S + SO2 = S + H2O ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… | |||||||
Пример №2 O 2 + H 2 ® H 2 О
1. Тип реакции - внутримолекулярная реакция
2. Расставляем степени окисления всех элементов:
O0 2 + H0 2 ® H1+ 2О 2-
О0 2+2Н0 2® 2О22 - + 2Н21+ O2 + 2H2 ® 2H2O
Пример №3 Na2 S4+ O3 ® Na2 S6+ O4- +Na 2S2- 1. Тип реакции -диспропорционирования
S4+ 3 S4+® S2-+ 3S6+ , или 4Na2 S O3 ® 3Na2 SO4+Na2S |
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить из задания:
1. Допишите электронные уравнения, укажите окислитель, восстановитель, процесс окисления и восстановления : а) Zn0 -2e- ®…….. б ) Ba2+ +2e-®……….
2. Расставить коэффициенты в уравнениях, используя метод электронного баланса , указать окислитель , восстановитель, процесс окисления и восстановления и тип ОВР.
a) Ca3(PO4)2+C+SiO2→CaSiO3+P+CO
b) HNO2→HNO3+NO+H2O
c) Р+HNO3+H2O→H3PO4+NO
d) KCLO3→KCL+O2
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
Вывод:
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №11
«ЭЛЕКТРОЛИЗ РАСПЛАВОВ И РАСТВОРОВ»
Цель: Познакомиться с понятием электролиз, катод, анод, научиться составлять анодные и катодные процессы, протекающие на катоде и аноде при электролизе растворов и расплавов на инертных и растворимых анодах; выполнять простейшие расчёты с использованием законов Фарадея.
ТЕОРЕТИЧЕСКИЙ ОБЗОР
Ø ЭЛЕКТРОЛИЗ– окислительно- восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита. АНОДОМ при электролизе называется положительный электрод, КАТОДОМ — отрицательный. Положительные ионы — катионы, они движутся к катоду, отрицательные ионы — анионы , они движутся к аноду
Ø КАТОДНЫЕ ПРОЦЕССЫ

1. Катионы, стоящие в ряду СЭП от лития Li до алюминия AL при электролизе водных растворов на катоде не восстанавливаются, вместо них из воды восстанавливается Н 2↑: К(-) 2Н2О + 2е- ® Н02 +2 OH -
2. Катионы, стоящие в ряду СЭП от марганца Mn до водорода Н при электролизе водных растворов на катоде восстанавливаются одновременно с молекулами воды до водорода:
К(-) Ме n + + ne - → Me 0 2Н2О +2е- ® Н02 +2 OH -
3. Катионы, стоящие в ряду СЭП от меди Cu до золота А u при электролизе водных растворов на катоде восстанавливаются полностью: К(-) Ме n + + ne - → Me 0
4. При электролизе расплавовна катоде восстанавливается только металл: К(-) Ме n + + ne - → Me 0
5. Если водный раствор содержит катионы различных металлов , то при электролизе металлы будут выделяться на катоде в порядке уменьшения СЭП: Аu, Pt, Ag, Cu…Чем левее металл в ряду напряжений, тем труднее его ионы восстанавливаются.
Ø АНОДНЫЕ ПРОЦЕССЫ
1. Растворимый анод- при электролизе сам подвергается окислению: А(+) Ме 0 - ne - → Me n +
2. Нерастворимый анод (угольный, инертный)- не окисляется , на нем окисляются :
¾ Анионы безкислородные (Cl1 -,I 1- ,Br1-,S2-,CN- ) –окисляются: А(+) 2С L 1- -2 e - → CL 0
¾ Анионы кислородосодержащие (NO3-, SO2-4, SO2-3 CO2-3, PO3-4 , ОН1-, F1- ) не окисляются , вместо них на аноде окисляется вода до О2 ↑: А(+) 2Н2О -4 e - →О02 ↑+ 4Н 1+
ЗАКОНЫ ФАРАДЕЯ
| m( вещ .)= mЭ(вещ.)•I• t 96500 ¾ mЭ(Са2+ )= Мr / n = 40/2=20 (n равно числу принятых электронов) ¾ VЭ (О2 ) = Vm/ n = 22,4/4 =5,6л ¾ VЭ (Н2 ) = Vm/ n = 22,4/2 =11,2л V ( газа ) = VЭ(газа) • I• t 96500 | · m(вещ)- масса выделившегося и растворившегося вещества при электролизе. · I-сила тока (А) · t- время (секунды) · mЭ(вещ.)- эквивалентная масса mЭ(вещ.)= Мr / n · VЭ(газа)-эквивалентный объем |
ПРАКТИЧЕСКАЯ ЧАСТЬ
Пример №1. Электролиз раствора NaI
c нерастворимым анодом:NaI↔Na1++ I1-
Пример №2 Электролиз раствора ZnCL 2 c цинковым анодом: ZnCL 2 ↔ Zn 2+ + 2 CL 1-
Zn2++2Н2О+2 Zn0→ Zn0 + 2Zn2++ Н02+2ОН- Zn CL2+2Н2О+2 Zn0→ Zn0 + Zn CL2+ Н02+ Zn(ОН)2
Пример №3. Электролиз раствора С uSO 4 c угольным анодом: С uSO 4 ↔ Cu 2+ + SO 4 2-
2Cu2++2Н2О→ 2Cu0 + О02 ↑+ 4Н 1+ 2CuSO4 +2Н2О→ 2Cu + О2 ↑+ 2Н2 SO4
Пример №4 Электролиз расплава NaCL c нерастворимым анодом:NaCL↔Na1++ CL1-
| 1. Электролиз раствора MgBr 2 c нерастворимым анодом: ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… 2. Электролиз раствора СrCL3 c хромовым анодом: ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… 3. Электролиз раствора Hg(NO3)2 c угольным анодом ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… 4. Электролиз расплава К I c нерастворимым анодом ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… | ||||||||||||||||||||||||||||
| Задача№1Какая масса меди выделится на катоде при электролизе раствора CuSO 4 в течение 1 ч при силе тока 4 А? Дано: t =1ч.= 60 • 60 = 3600 с. I = 4А Найти: m(Cu.)=? Решение. Согласно законам Фарадея: m(Cu.)= m Э (С u )* I * t = 31,77* 4*3600 = 4,74гh. 96500 96500 mЭ(Cu)= Mr(Cu )/2= 63,54/ 2= 31,77 | Рассчитайте массу металла, выделившегося при электролизе расплава KBr c силой тока 1,5А в течение 40 минут Дано:……………………………………………………… Найти:……………………………………………………… Решение ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… | ||||||||||||||||||||||||||||
| Задача№2Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода (н.у.)? Дано: t =1 ч 40 мин 25 с= 6025с. V (Н2 ) = 1.4л. Найти: I=? Решение: VЭ (Н2 ) = 22,4/2= 11,2 л I = V (Н2 ) * 96500/ VЭ (Н2 ) *t=1,4*96500/11,2*6025=2,002А | При электролизе NiCL 2 в течении 2 часов на катоде выделяется 44,2г никеля. Определить силу тока.. Дано:……………………………………………………… Найти:……………………………………………………… Решение ……………………………………………………………… ……………………………………………………………… ……………………………………………………………… |
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить из задания:
a) Составьте уравнения электрохимических реакций на инертных электродах, протекающих в ходе электролиза водного раствора CoCL2
b) Определить массу металла, выделившегося при электролизе расплава KBr c силой тока 1,5А в течение 40 мин.
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
Вывод:
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №12
Дата добавления: 2019-09-08; просмотров: 422; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

 Реакция разложения
Реакция разложения В химический стаканчикс раствором серной кислоты Н2 SO4 опустим железную пластинку.Наблюдаем за происходящим.
В химический стаканчикс раствором серной кислоты Н2 SO4 опустим железную пластинку.Наблюдаем за происходящим. 