ИЗГОТОВЛЕНИЕ МОДЕЛЕЙ МОЛЕКУЛ УГЛЕВОДОРОДОВ. ОБНАРУЖЕНИЕ УГЛЕРОДА И ВОДОРОДА В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ»
Цель: Изучить строение молекул метана, этилена, ацетилена, циклопрпана, бензола и их гомологов. Научиться: изготавливать шаростержневые модели этих молекул и определять характер связей; обнаруживать углерод в органических соединениях с помощью реакции горения.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
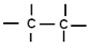
| 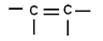
| 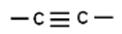 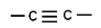 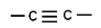 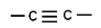
| ||
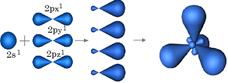
При перекрывании всех 4х орбиталей 2S1, 2Px1, 2Py1, 2Pz1 образуется 4 гибридные орбитали, которые направлены к вершинам тетраэдра,
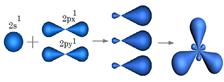
| При перекрывании орбиталей 2S1, 2Px1, 2Py1 образуется 3 гибридные орбитали. Орбиталь 2Pz1 остается без изменений, так как в гибридизации не участвует
| При перекрывании орбиталей 2S1, 2Px1 образуется 2 гибридные орбитали,. Орбитали 2Py1 и 2Pz1 остаются без изменений, в гибридизации не участвуют.
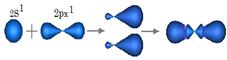
| ||
| Углерод в Sр3 гибридном состоянии | Углерод в Sр2 гибридном состоянии | Углерод в Sр гибридном состоянии | ||
| Валентный угол j = 109028¢ | Валентный угол j = 1200 | Валентный угол j = 1800 | ||
| Между атомами углерода: ¾ 1 ковалентная неполярная G-связь Между атомами водорода и углерода: ¾ ковалентные полярные G-связи | Между атомами углерода: ¾ 1 ковалентная неполярная G-связь ¾ 1 ковалентная неполярная π-связь Между атомами водорода и углерода: ¾ ковалентные полярные G-связи | Между атомами углерода: ¾ 1 ковалентная неполярная G-связь ¾ 1 ковалентные неполярные π-связи Между атомами водорода и углерода: ¾ ковалентные полярные G-связи | ||
| G -связь(сигма-связь) — ковалентная связь, образующаяся перекрыванием электронных облаков «по осевой линии».
π-связь(пи-связь) -это связь, образованная по обе стороны от линии соединяющей центры атомов | ||||
ПРАКТИЧЕСКАЯ ЧАСТЬ
| Опыт №1 ОБНАРУЖЕНИЕ УГЛЕРОДА И ВОДОРОДА В ГЕКСАНЕ И КЕРОСИНЕ | |||||
| Нальём немного керосина и гексана, подожжём. Обратим внимание на цвет пламени и характер горения керосина и гексана. Допишем реакции: С6Н14 + О2® ……………. ……………………………...... С18Н38 + О2® ……………………………………………… | Наблюдали: …………………………………………………............................ ……………………………………………………………………..…………………………………………………............................ …………………………………………………………………….. | ||||
| Опыт №2 СТРОЕНИЕ АЛКАНОВ | |||||
| Молекула МЕТАНА · Молекулярная формула ………………………………. 1. Тип гибридизации «С» …………………………………. 2. Валентный угол…………………………………………. 3. Строение молекулы…………………………………….. | Молекула ЭТАНА · Молекулярная формула ………………………………. 4. Тип гибридизации «С» …………………………………. 5. Валентный угол…………………………………………. | ||||
| 6. Вид связей: ……………………………………….…………………………………………………………………. | 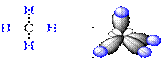
| 7. Вид связей: ……………………………………….…………………………………………………………………. ………….. | 
| ||
| Опыт №3 СТРОЕНИЕ АЛКЕНОВ
| |||||
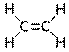
| Молекула ЭТИЛЕНА · Молекулярная формула ………………………………. 8. Тип гибридизации «С» …………………………………. 9. Валентный угол…………………………………………. 10. Строение молекулы…………………………………….. | Молекула ПРОПЕНА · Молекулярная формула ………………………………. 11. Тип гибридизации «С» …………………………………. 12. Валентный угол…………………………………………. | ||||
| 13. Вид связей: ……………………………………….…………………………………………………………………. | 
| 14. Вид связей: ……………………………………….…………………………………………………………………. ………….. | 
| ||
| Опыт №4 СТРОЕНИЕ АЛКИНОВ | |||||
| Молекула АЦЕТИЛЕН · Молекулярная формула ………………………………. 15. Тип гибридизации «С» …………………………………. 16. Валентный угол…………………………………………. 17. Строение молекулы…………………………………….. | Молекула ПРОПИНА 18. Молекулярная формула ……………………………….
19. Тип гибридизации «С» …………………………………. 20. Валентный угол…………………………………………. | ||||
| 21. Вид связей: ……………………………………….…………………………………………………………………. |
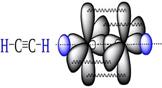
| 22. Вид связей: ……………………………………….…………………………………………………………………. ………….. | 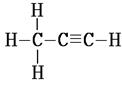
| ||
| Опыт №4 СТРОЕНИЕ АРЕНОВ И ЦИКЛОАЛКАНОВ | |||||
| Молекула БЕНЗОЛА · Молекулярная формула ………………………………. 23. Тип гибридизации «С» …………………………………. 24. Валентный угол…………………………………………. | 25. Молекула ЦИКЛОПРОПАНА 26. Молекулярная формула ………………………………. 27. Тип гибридизации «С» …………………………………. 28. Валентный угол…………………………………………. | ||||
29.  Вид связей: ……………………………………….…………………………………………………………………. Вид связей: ……………………………………….………………………………………………………………….
| 
| 30. Вид связей: ……………………………………….…………………………………………………………………. ………….. | 
| ||
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить задания
1. Укажите название класса углеводорода, тип гибридизации углерода, валентный угол, вид и количество связей (КПσ, КННσ , КНПπ):
|
|
|
А) 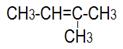 в)
в) 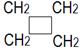 С)
С) 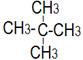
2. Составьте структурную формулу углеводорода , содержащего 3КНσ , 2 КНπ и несколько КПσ
Вывод:
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №15
Дата добавления: 2019-09-08; просмотров: 365; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
