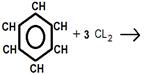
ИЗОМЕРИЯ И НОМЕНКЛАТУРА УГЛЕВОДОРОДОВ».
Цель: Изучить основные правила составления названий углеводородов по систематической номенклатуре IUPAC, научиться составлять структурные формулы изомеров.
ТЕОРЕТИЧЕСКА ЧАСТЬ
1. Выбираем главную цепь - цепочку из последовательно соединенных атомов углерода, в которую входят все кратные (=, ≡) связи и наибольшее число атомов "С".
2. Оставшиеся углеводородные группы являются заместителями.
3. Пронумеруем главную цепь, присваивая каждому атому углерода порядковый номер - 1,2,3, 4.
4. Нумерацию цепи начинаем с той стороны, где ближе расположены кратные связи;
5. Если кратные связи отсутствуют, или находятся посередине главной цепи, то нумерацию начинаем с той стороны, где ближе расположены заместители:
6. Если заместители одинаковые и расположены на равном расстоянии от концов цепи, то нумеруем с любого конца цепи. Если с одной из сторон цепи заместителей больше по количеству, то нумерацию начинаем именно с этого конца цепи. Если заместители разные и они расположены на равном расстоянии от концов цепи, то нумерацию начинаем с той стороны цепи, где расположен заместитель первая буква названия, которого идет по алфавиту раньше.
7. Если есть несколько вариантов максимально длинной цепи, то выбираем цепь с наибольшим числом разветвлений. Составляем название по таблице №1.
8. Если главная цепь имеет несколько разных заместителей-алкилов, то все сведения о них записываются в алфавитном порядке: метил, пропил, этил. Иные заместители (галогены и нитрогруппа) указываются в первую очередь.
|
|
|
9. В соединениях с кратными связями указывается номер атома углерода в главной цепи, после которого расположена данная связь.
10. При наименовании циклоалканов и аренов нумеруются атомы углерода цикла, так чтобы номера заместителей были минимальны.
| ПОРЯДОК СОСТАВЛЕНИЯ НАЗВАНИЙ | ||||||||
| ПРИСТАВКА | КОРЕНЬ | СУФФИКС | ||||||
| Положение заместителей | Число одинаковых заместителей | Название заместителей | количество атомов «С» в цепи | Алкан- «-» | Алкен- "=" | Алкин- "≡" | Алкадиен две "=" | Циклоалканы |
| № атома "С" к которому присоединён заместитель 2,3.... | 1--- 2-ди 3-три 4-тетра 5-пента 6-гекса | Сl-хлор Br-бром NO2-нитро Алкил СпН2п+1 СН3- метил С2Н5-этил С3Н7 -пропил | 1. мет- 2. эт- 3. проп- 4. бут- 5. пент- 6. гекс- 7. гепт- 8. окт- 9. нон- | - АН | -ЕН | -ИН | -аДИЕН | -АН (ЦИКЛО-перед корнем) |
ПРАКТИЧЕСКАЯ ЧАСТЬ
ЗАДАНИЕ №1 Назвать углеводороды по систематической номенклатуре
|
|
|
1.  ………………………………………………….. …………………………………………………..
| 2. ……………………………………………………….
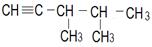
| 3. ……………………………………………………………..
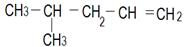
| 4. ……………………………………………….
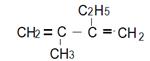
|
5. ……………………………………………………….
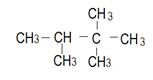
| 6. …………………………………………………….....
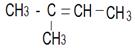
| 7. ……………………………………………………………..

| 8. …………………………………………….
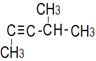
|
9. ………………………………………………………..
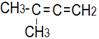
| 10. ……………………………
……………..  ................ ................
| 11. ……………………………………………………………..

| 12. ………………………
……………………..

|
13. …………………………
…………………………….
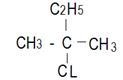
| 14. …………………………………………………….....
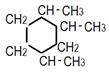
| 15. ……………………………………………………………..

| 16. …………………………………………….
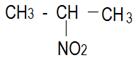
|
ЗАДАНИЕ №2 Составить структурную формулу веществ:
| 1) 3,4-диметил 4-этилгексин-1 …………………………………………………………………. | 2) 2-метил 3-этилгексан. …………………………………………………………………. |
ЗАДАНИЕ №3 Составить структурные изомеры и назвать их по систематической номенклатуре:
| a) Пентан С5Н12; | b) Гексен С6Н12 |
| ……………………………………………………… ……………………………………………………… ……………………………………………………… ……………………………………………………… ……………………………………………………… ……………………………………………………… | ……………………………………………………… ……………………………………………………… ……………………………………………………… ……………………………………………………… ……………………………………………………… ……………………………………………………… |
САМОСТОЯТЕЛЬНАЯ РАБОТА
|
|
|
1. Назовите соединения по систематической номенклатуре.
 ………………………………. ………………………. ………………………..
………………………………. ………………………. ………………………..
| 2. Для соединения №2 составьте структурные формулу 2х изомеров, назовите их. ……………………………………………….. ………………………………………………. |
Вывод:
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №16
«ПОЛУЧЕНИЕ И ИЗУЧЕНИЕ СВОЙСТВ МЕТАНА, ЭТИЛЕНА, АЦЕТИЛЕНА, БЕНЗОЛА».
Цель: Экспериментально получить метан, этилен и ацетилен. Изучить свойстват метана, этилена, ацетилен и бензола.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
¾ Метан (СН4)-это газ без цвета и запаха, почти в два раза легче воздуха. Он плохо растворим в воде, но хорошо растворяется в органических растворителях. Смесь метана с кислородом в соотношении 1:2 и метана с воздухом 1:10 взрывоопасна. Обычно для обнаружения утечки метана в газопроводах, к нему добавляют небольшое количество, сильно пахнущего вещества (меркаптаны). Запишем реакции:
|
|
|
| 1. СН4 +CL2→………………………………………………. 2. СН4 +HNO3→…………………………………………… 3. 2СН4крекинг →……………………………………………. 4. 2СН4крекинг →……………………………………………. | 5.2СН4крекинг →…………………………………………………... 6.СН4 +O2 горение→……….……………………………………… 7.СН4 +O2 окисление→……….……………………………………. 8.СН4 +Н2O →……….………………………………………….. |
¾ Этилен (СН2=СН2) -это газ без цвета и практически без запаха, легче воздуха. Он плохо растворим в воде, но хорошо растворяется в органических растворителях (бензоле , хлороформе и т.п. С воздухом этилен и его газообразные гомологи образуют взрывчатые смеси. Запишем реакции.
| 1. СН2=СН2 +Н2→……………………………………… 2. СН2=СН2 +CL2→…………………………………… 3. СН2=СН2 +НCL→…………………………………… 4. СН2=СН2 +Н2О→…………………………………… | 5. СН2=СН2 +О2 горение→……………………………………. 6. СН2=СН2 +О2 окисление→..………………………………… 7. СН2=СН2 + СН2=СН2 +….n→…………………………… |
¾ Ацетилен (СН≡СН)-это газ без цвета и практически без запаха , легче воздуха. Он плохо растворим в воде ,как и большинстве органических растворителей. Ацетилен хорошо растворяется в ацетоне. С воздухом ацетилен образует взрывчатую смесь. Запишем реакции.
| 1. СН≡СН +Н2→……………………………………… 2. СН≡СН +CL2→…………………………………… 3. СН≡СН +НCL→…………………………………… 4. СН≡СН +Н2О→…………………………………… | 5. СН≡СН +О2 горение→………………………………………. 6. СН≡СН +О2 окисление→..…………………………………… 7. СН≡СН + СН≡СН →………………………………………. 8. 3СН≡СН →…………………………………………………. |
¾ Бензол (С6Н6) – это бесцветная , легкокипящая нерастворяющаяся в воде жидкостьТкип.=80,1°С;Т пл.=5,5 °С, при охлаждении бензол превращаетсяв бесцветные кристаллы. Бензол ядовит, имеет запах.
| 1. С6Н6+Н2→……………………………………… | 2. С6Н6+CL2 FeCL3→………………………………………. |
ПРАКТИЧЕСКАЯ ЧАСТЬ
| Ход работы | Рисунки, реакции, наблюдения. | Выводы | ||||
| Опыт №1 ПОЛУЧЕНИЕ МЕТАНА И ИЗУЧЕНИЕ ЕГО СВОЙСТВ | ||||||
| 1. Соберем прибор. Внесём в пробирку несколько грамм ацетата натрия и щёлочи. Закроем пробирку пробкой с газоотводной трубкой. Нагреем смесь, соберем газ. Подожжем полученный газ с помощью лучины. 2. Пропустим полученный газ через бромную воду и водный раствор КMnO4 |  Наблюдали:
………………………………………………………………………………………………………………………………………………………………………………
…………………………………………………………..
Допишем реакции:
СН3 COONa+NaOH ®…….……….………..
СН4+ О2®………………………………….... Наблюдали:
………………………………………………………………………………………………………………………………………………………………………………
…………………………………………………………..
Допишем реакции:
СН3 COONa+NaOH ®…….……….………..
СН4+ О2®…………………………………....
| Вывод: ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… | ||||
| Опыт №2 ПОЛУЧЕНИЕ ЭТИЛЕНА ДЕГИДРОТАЦИЕЙ ЭТАНОЛА И ИЗУЧЕНИЕ ЕГО СВОЙСТВ | ||||||
| 1. Соберем прибор. Нальем в пробирку 1-2 мл. смесь этанола с Н2SO4 (конц.) Прибавим 0,5г. речного песка, закроем пробирку пробкой с газоотводной трубкой. Нагреем смесь, соберем газ и пропустим через раствор КMnO4. 2. Подожжем газ с помощью тлеющей лучины. |
……………………………………………………………………………………………………………………………………………………………………………………………………………………………… Допишем реакции: С2Н5ОН®………………………………..….. СН2=СН2 + О2 ®……………………...………..... СН2= СН2+Н 2О+ О КМпО4®……………… | Вывод: ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… | ||||
| Опыт №3 ПОЛУЧЕНИЕ АЦЕТИЛЕНА ГИДРОТАЦИЕЙ КАРБИДА КАЛЬЦИЯ И ИЗУЧЕНИЕ ЕГО СВОЙСТВ | ||||||
| 1. Соберем прибор. Поместим в пробирку 1-2 кусочка карбида кальция и прильем 0,5мл воды. Закроем пробирку пробкой с газоотводной трубкой . Соберем газ и пропустим его через раствор КMnO4. 2. Газ подожжем с помощью тлеющей лучины. |
……………………………………………………………………………………………………………………………………………………………………………………………………………………………… Допишем реакции: СаС2+ Н2О ®…………………………… СН≡СН + О2 ® ………………………………. СН≡СН + Н2О +О К MnO 4® ………………………… | Вывод: ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… | ||||
| Опыт №4 СВОЙСТВА БЕНЗОЛА | ||||||
| а) Физические свойства бензола Визуально определим свойства бензола. Растворим бензол в воде, эфире и спирте. Охладим пробирку с бензолом до t > 5,50C б) Химические свойства бензола ¾ Поместим немного бензола в фарфоровую чашку и подожжём. ¾ Добавим к 1мл. бензола столько же азотной и серной кислоты ¾ Пропустим через 1мл. бензола хлор в присутствии света ¾ Смешаем бензол с 1мл водного раствора КMnO4 и бромную воду | Наблюдали: ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… Допишем реакции: С6Н6 + О2®………………………………..………….... С6Н6 + НNO3®……………………………………..…..
С6Н6 +К MnO 4 ®………………………………..………….. С6Н6 +бромная вода ®……………………..…..………….. | Вывод: ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… | ||||
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполнить задание.
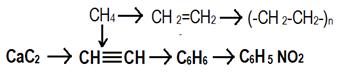
| ………………………………………………………………….. …………………………………………………………………. …………………………………………………………………… | …………………………………………………………………… …………………………………………………………………... …………………………………………………………………… |
Вывод:
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №17
«ИЗОМЕРИЯ И НОМЕНКЛАТУРА КИСЛОРОДОСОДЕРЖАЩИХ ВЕЩЕСТВ»
Цель: Изучить основные правила составления названий кислородосодержащих органических веществ по систематической номенклатуре IUPAC, научиться составлять структурные формулы изомеров.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
| Класс | Спирты | Альдегиды | Кетоны | Карбоновые кислоты |
| Функциональная группа | Гидроксильная -ОН | Альдегидная
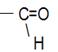
| Кетонная
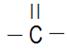
| Карбоксильная

|
| Выбор ГЦ | ГЦ включает в себя атом «С» соединенный с группой –ОН. | ГЦ включает в себя атом «С» альдегидной группы | ГЦ включает в себя атом «С» кетонной группы | ГЦ включает в себя атом «С» карбоксильной группы |
| Нумерация ГЦ | ГЦ нумеруется с той стороны, где ближе гидроксильная группа | ГЦ нумеруется, начиная с углерода альдегидной группы | ГЦ нумеруется с той стороны, где ближе кетонная группа | ГЦ нумеруется, начиная с углерода карбоксильной группы |
| Приставка | Перечисляются: положение, количество и название заместителей в алфавитном порядке | |||
| Корень | Количество атомов углерода в главной цепи: мет-(1), эт-(2), проп-(3), бут-(4), пент- (5), гекс- (6)….. | |||
| Суффикс | -АН | |||
| Окончание | -ОЛ и номер атома «С» к которому присоединена группа ( -ОН) | -АЛЬ | -ОН и номер атома «С» к которому присоединена группа (– СО –) | -ОВАЯ КИСЛОТА |
| Примеры | 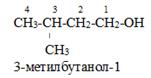
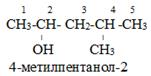
|  
|  
| 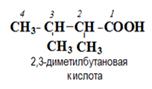 
|
ПРАКТИЧЕСКАЯ ЧАСТЬ
Дата добавления: 2019-09-08; просмотров: 465; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

 Наблюдали:
Наблюдали: Наблюдали:
Наблюдали: