РЕШЕНИЕ ЗАДАЧ НА ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ ФОРМУЛЫ»
Цель: Научиться решать задачи на нахождение молекулярной формулы веществ по известным данным о продуктах реакции и составе вещества.
ТЕОРИТИЧЕСКАЯ ЧАСТЬ
Реакция: аА + бВ® сС + дД
Используя данные пропорции можно рассчитать любую величину:
Формулы для расчёта:
| ¾  По водороду ( Mr(H2)= 2):
¾ По водороду ( Mr(H2)= 2):
¾  По хлору( Mr(CL2)= 71):
¾ По воздуху ( Mr(воздуху)= 29): По хлору( Mr(CL2)= 71):
¾ По воздуху ( Mr(воздуху)= 29):
 ¾ По кислороду ( Mr(О2)= 32):
¾ По кислороду ( Mr(О2)= 32):

|
ПРАКТИЧЕСКАЯ ЧАСТЬ
| ЗАДАЧА №1 Установите молекулярную формулу углеводорода, если плотность его равна 4,107г/л.(н.у.), а массовая доля углерода -91,31%. Дано: Р (СхНу)=4,107г/л W%(С)=91,31%. W%(Н)=100-91,31=8,69%. Найти: СxHy, где Х -число атомов «С», Y- атомов «Н» Решение: 1. Найдем молекулярную массу углеводорода: М(СхНу)= Р (СхНу) * Vm=4.107* 22.4=92г/ моль 2. Определим количество атомов «С» в веществе: -92г/моль - 100% - m (С) г. - 91,31 m(С) =92 * 91.31 / 100% = 84 г., Х= m(С) / Аr(C) = 84 / 12 = 7 3. Определим количество атомов «Н» в веществе: -92г/моль - 100% - m (Н) г. - 8,69% m(Н) =92 * 8,69 /100% = 8 г. Y= m(Н) / Аr(C) = 8 / 1 = 8 4. Сделаем проверку: Мr (С7Н8) =7*12+8*1=92 Ответ: С7Н8 | Хлоропроизводное углеводорода имеет плотность по воздуху 8,07. Определите формулу соединения, если его состав входят:89,1%хлора и 10,9%углерода. Дано: …………………………………………………………………… …………………………………………………………………… Найти:…………………………………………………………… Решение: …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… |
| ЗАДАЧА №2 При сжигании 25г .органического вещества получили 70,2 г. газа СО2 и 14.36г. воды. Определите формулу вещества , если его плотность по отношению к кислороду равна 2,937. Дано: m(CxHyOz) =25г. m (СО2)=70,2г. m (Н2О)=14,36г. Д о2(СхНуОz)=2,937 Найти: СхНуОz Решение: При горении cоединения образовался СО2 и Н2О, предположим, что формула его СхНуОz. a) Найдем молекулярную массу вещества М(СхНуОz)=М(О2)* Dо2(СхНуОz)=32×2,937=94г/моль. b) Составим уравнение горения 2СхНуОz+вО2® 2хСО2 +уН2О Составим пропорцию: m (СхНуО z ) = m ( C О2) = m (Н2О) 2М(СхНуОz) 2хМ(СО2) уМ(Н2О) Выразим из пропорции Х m (СхНуО z = m ( C О2) 2М(СхНуОz) 2хМ(СО2) Х= m ( C О2) *2*М(СхНуО z ) = 70,2*2*94 =6 m (СхНуОz)*2*М(СО2) 25*2*44 Выразим из пропорции У : m (СхНуО z ) = m (Н2О) 2М(СхНуОz) уМ(Н2О) У= m (Н2О) × 2М(СхНуО z ) = 14,36*2*94 =6 m (СхНуОz)×М(Н2О) 25*18 Выразим z Z=М(СхНуО z )-хА r (С)-уА r ( H) = 94-6*12-6*1 = 1 Ar(O) 16 Ответ : С 6Н6О. | При сжигании 3г. неизвестного органического соединения получили 4,63 л. углекислого газа и 4,69г. воды. Определите формулу соединения, если известно , что 2,5л. его весят 6,47г.(н.у.) Дано: …………………………………………………………………… …………………………………………………………………… Найти:…………………………………………………………… Решение: …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… …………………………………………………………………… |
САМОСТОЯТЕЛЬНАЯ РАБОТА
|
|
|
|
|
|
Выполнить одно из дифференцированных заданий.
|
|
|
| Программа А («5») Сожгли 44 г. углеводорода и получили 17,11г. СО2 и 16,55г. Н2О. Определите его формулу, если его плотность по водороду равна 36. Необходимо учесть , что в веществе присутствовало 25 % горючего материала. Программа Б («4») Сожгли 7г. углеводорода и получили 20,53г. углекислого газа и 12,6г. воды. Определить формулу углеводорода, если его плотность при нормальных условиях равна 1,34г/л. Программа С («3») Найдите молекулярную формулу вещества содержащего 82,8% углерода и 17,2% водорода, плотность вещества при нормальных условиях 2,59г/л | …………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… |
Вывод:
|
|
|
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №20
«ЭКСПЕРИМЕНТАЛЬНОЕ ПОЛУЧЕНИЕ КАРБОНОВЫХ КИСЛОИ И ИЗУЧЕНИЕ ИХ СВОЙСТВ.
СВОЙСТВА УГЛЕВОДОВ»
Цель: Получить СН3СООН лабораторным способом, изучить ее способность вступать в реакции с активными металлами, их оксидами, гидроксидами и спиртам. Изучить качественные реакции на обнаружение глюкозы и крахмала, познакомиться с физическими свойствами этих веществ.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Муравьиная кислота НСООН - бесцветная прозрачная жидкость, с резким , кислым вкусом и запахом. Самая сильная из всех карбоновых кислот. Единственная , из всех кислот вступает в реакцию «серебряного зеркала»
Уксусная кислота СН3СООН - бесцветная прозрачная жидкость, с резким , кислым вкусом и запахом, хорошо растворяющаяся в воде. Уксусная кислота проявляет слабые кислотные свойства. Она применяется в синтезе красителей, медикаментов (н/р аспирин), ацетатного волокна, органического стекла и т.д.
Сложные эфиры -это продукты взаимодействия карбоновых кислот со спиртами,
в результате реакции этерификации. Благодаря ароматичности, эфиры применяются в кондитерской и парфюмерной промышленности .
ГлюкозаС6Н12О6- бесцветное кристаллическое вещество со сладким вкусом, хорошо растворимое в воде. В свободном виде содержится почти во всех органах зеленых растениях, особенно ее много в винограде (поэтому ее иногда называют виноградным сахаром), меде (это смесь глюкозы с фруктозой), в мышцах , в крови и в клетках человека.
Сахароза С12Н22О11-бесцветное кристаллическое вещество сладковатое на вкус, хорошо растворимое в воде. Входит в состав сока сахарной свеклы (16-20%) и сахарного тростника (14-26%), в небольшом количестве вместе с глюкозой содержится в плодах и листьях многих зеленых растений.
Целлюлоза (С6Н10О5)n-волокнистое вещество, нерастворимое в воде ,ни в обычных органических растворителях (кроме реактива Швейцера).Она является основной составной частью оболочки растительных клеток. Волокна хлопка , льна, конопли состоят главным образом из целлюлозыЦеллюлоза - природный полимер, молекула состоит из остатков β-глюкозы.
Крахмал (С6Н10О5) n- белый порошок, нерастворимый в холодной воде, в горячей набухает ,образует клейстер. Присутствует в картофеле, рисе, пшенице.Крахмал-это природный полимер, молекула которого состоит из отдельных звеньев - остатков α-глюкозы
ПРАКТИЧЕСКАЯ ЧАСТЬ
| Ход работы | Рисунки, реакции, наблюдения. | Выводы |
| Опыт № 1 ИНДИВИДУАЛЬНЫЕ СВОЙСТВА МРАВЬИНОЙ КИСЛОТЫ | ||
| а) Разложение муравьиной кислоты Нагреем немного муравьиной кислоты в присутствии Н2SO4 б) Окисление муравьиной кислоты Нагреем немного муравьиной кислоты в присутствии аммиачного раствора оксида серебра | Наблюдали: ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… Допишем реакции: НСООН H 2 SO 4→ …………………………………… НСООH +Ag2O → ………………………………… | Вывод: ................................................................................................................................................................................................................................................................... |
| Опыт №2 ПОЛУЧЕНИЕ УКСУСНОЙ КИСЛОТЫ И ИЗУЧЕНИЕ ЕЁ СВОЙСТВ | ||
| а) Получение уксусной кислоты Поместим в пробирку 2-3 г. ацетата натрия и прибавим 1-2 мл. H2SO4 Пробирку закроем пробкой c газоотводной трубкой , конец которой опустим в другую пробирку. Смесь нагреем, пока в пробирке- приемнике соберется 1-1,5 мл. жидкости. |  Наблюдали:
…………………………………………………………………………………………………………………………………………
Допишем реакцию:
СН3СООNa+ H2SO4→………………………………. Наблюдали:
…………………………………………………………………………………………………………………………………………
Допишем реакцию:
СН3СООNa+ H2SO4→……………………………….
| Вывод: ................................................................................................................................................................................................................................................................... |
| б) взаимодействие с металлами, их оксидами, гидроксидами и солями В 6 пробирок поместим по 1 мл. раствора уксусной кислоты. ¾ В одну пробирку добавим немного стружек магния, а во вторую – несколько гранул цинка. Нагреем пробирку с цинком. ¾ В третью пробирку добавим несколько капель раствора метилоранжа. Прильем раствор щелочи NaOH ¾ В четвертую пробирку добавим немного оксида меди, нагреем ¾ В пятую пробирку прильем карбонат натрия ¾ Шестую пробирку охладим к помощью льда |  Наблюдали:
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..................
…………………………………………………………
Допишем реакции:
CH3СООН+Mg®……………………………………
CH3СООН+Zn®……………………………………
CH3СООН+ NaOH® ………………………………
CH3СООН+ СuO® ………………………………
CH3СООН+ Na2СО3® …………………………… Наблюдали:
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..................
…………………………………………………………
Допишем реакции:
CH3СООН+Mg®……………………………………
CH3СООН+Zn®……………………………………
CH3СООН+ NaOH® ………………………………
CH3СООН+ СuO® ………………………………
CH3СООН+ Na2СО3® ……………………………
| Вывод: .............................................................................................................................................................................................................................. ........................................................................ ............................................................................................................. |
| в) Реакция этерификации В пробирку поместим по 1мл. уксусной кислоты и этанола, добавим несколько капель Н2SO4. Закроем пробирку пробкой с трубкой холодильником.Нагреем пробирку. | Наблюдали: ……………………………………………………………………………………………………………………………………………………………………………….. Допишем реакцию: С2Н5ОН+СН3СООН®…………………………….… | Вывод: ......................................................................................................................................................................................... |
| Опыт № 3 КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ОБНАРУЖЕНИЕ УГЛЕВОДОВ | ||
| а) Качественные реакции на обнаружение глюкозы. В 2 пробирки поместим по1 мл глюкозы. В первую поместим смесь растворов NaOH и CuSO4, а во вторую аммиачный раствор оксида серебра . Нагреем пробирки с растворами. | Наблюдали: ………………………………………………………… …………………………………………………………………………………………………………………… Допишем реакции: С6Н12О6+2Сu(ОН)2→ …………………………..... С6Н12О6+ Аg2O→ …………………................ | Вывод: ......................................................................................................................................................................................... …………………………………………………………………………………………………………………………………… |
| б) Качественные реакции на обнаружение крахмала. К 1 г. крахмала добавим 1 мл. воды , нагреем содержимое пробирки и прильем 1 каплю раствора йода. | Наблюдали: ………………………………………………………… …………………………………………………………………………………………………………………… | |
САМОСТОЯТЕЛЬНАЯ РАБОТА
Выполним реакции CH3СОН ®CH3СООН ® CH3СООNa®СН3СOOH→ CH3СОOCH3
| ………………………………………………………………….. …………………………………………………………………. …………………………………………………………………… | …………………………………………………………………… …………………………………………………………………... …………………………………………………………………… |
Вывод:
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
………………………………………………………………………………………………………………………………………….
ПРАКТИЧЕСКАЯ РАБОТА №2 1
«СВОЙСТВА АНИЛИНА И БЕЛКОВ. ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛОК».
Цель: Исследовать способность анилина реагировать с серной кислотой. Экспериментально изучить качественные реакции на белок и его денатурацию.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Анилин(С6Н5 NH 2 )- бесцветная маслянистая жидкость , буреющая на воздухе . Плохо растворяется в воде, ядовита. Проявляет основные свойства (слабее , чем другие амины
Белки -высокомолекулярные органические вещества, играющие фундаментальную роль в структуре и жизнедеятельности живых организмов. Денатурация –это процесс свертывания белка.
ПРАКТИЧЕСКАЯ ЧАСТЬ
| Ход работы | Рисунки, реакции, наблюдения. | Выводы | ||
| Опыт №1 ПОЛУЧЕНИЕ АНИЛИНА И ИЗУЧЕНИЕ ЕГО СВОЙСТВ. | ||||
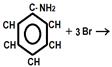
| а) Получение анилина В раствор соли солянокислого анилина прильём по каплям раствор щёлочи NaOH .Что наблюдаем ? б) Растворимость анилина Внесем в стакан с холодной, а потом с горячей водой 0,5 мл. анилина. Тщательно перемешиваем. с) Химические свойства анилина ¾ Прильём к анилину несколько капель бромной воды ¾ Прильём к анилину несколько капель хлорной извести ¾ Прильём к анилину несколько капель соляной кислоты | Наблюдали:
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………Допишем уравнения: С6Н5NH3СL+NaОH®……………………………..
С6Н5NH2+НСL®……………………………………
С6Н5NH3СL+ хлорная известь®…….……………
| Вывод: ......................................................................................................................................................................................... ……………………………………………………………………………………………………………………………………………… | ||
| Опыт №2 СВОЙСТВА БЕЛКОВ | ||||
| а) Денатурация белков ¾ В пробирку нальем 1 -2мл. белка и нагреем ¾ В пробирку нальем 1 -2мл. белка и добавим этанол ¾ В 2 пробирки нальем по 1 -2мл. белка и добавим растворы СuSO4 и AgNO3 | Наблюдали: ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………............................... | Вывод: ........................................................................................................................................................................................................... | ||
| б) Цветные реакции на белок ¾ Биуретовая реакция: к 1 мл. белка, добавим растворы по 0,5 мл. СuSO4 и NaOH. ¾ Ксантопротеиновая реакция: к 1 мл. раствора белка и 1 мл. раствора HNO3, добавим NH4OH | Наблюдали: ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… | Вывод: ......................................................................................................................................................................... | ||
|
САМОСТОЯТЕЛЬНАЯ РАБОТА Выполним реакции С6Н6® С6Н5NO2 ® С6Н5NH2 ® С6Н5NH3CL® С6Н5NH2
Вывод: ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… | ||||
ПРАКТИЧЕСКАЯ РАБОТА №2 2
"РЕШЕНИЕ ЭКСПЕРИМЕНТАЛЬНЫХ ЗАДАЧ НА ИДЕНТИФИКАЦИЮ ОРГАНИЧЕСКИХ ВЕЩСТВ.
РАСПОЗНОВАНИЕ ПЛАССТМАС И ВОЛОКОН".
Дата добавления: 2019-09-08; просмотров: 281; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!



