Алгоритм вычисления относительной плотности газа
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ | ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
| 1.Прочитайте текст задачи. | Рассчитать относительную плотность оксида серы (IV) по азоту. |
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений. | 2.Дано: SO2 D(N2) =? |
| 3. Запишите формулу расчёта относительной плотности: | 3.Решение:
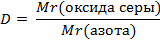
|
| 4. Вычислить относительные молекулярные массы оксида серы (IV) и азота | Mr (SO2) = Ar(S) + 2Ar(O) = 32 + 2 · 16 = 64 Mr (N2) = 2Ar(N) = 2 · 14 = 28 |
| 5. Вставить полученные значения в формулу | 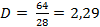
|
| Записать ответ | Ответ: D (N2) = 2,29 |
Алгоритм вычисления объёма вещества по известной массе вещества
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ | ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
| 1.Прочитайте текст задачи. | Вычислить, какой объём (при н.у.) занимают 42 г азота N2 |
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений. | 2.Дано: m (N2) = 42 г Vгаза (н.у.) = ? |
| 3. Вычислить молярную массу азота | 3.Решение: Mr (N2) = 2Ar(N) = 2 · 14 = 28 М (N2) = 28 г/моль |
| 4. Вычислить количество азота | 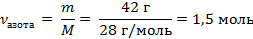
|
| 5. Рассчитать объём азота по формуле, зная, что Vm - величина постоянная для любого газа (н.у.) 22,4 л/моль | V = ν · Vm V = 1,5 моль · 22,4 л/моль = 33,6 л |
| Запишите ответ | Ответ: V = 33,6 л |
Алгоритм расчёта по химическому уравнению реакции объёмных отношений газов
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ | ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ | ||
| 1.Прочитайте текст задачи. | Вычислите объем кислорода, необходимого для сжигания порции ацетилена объемом 50 л | ||
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений. | 2.Дано: V (C2H2) = 50 л V(O2) = ? | ||
| 3. Запишите уравнение реакции | 3.Решение: 2C2H2 + 5O2 = 4CO2 + 2H2O | ||
| 4. Над формулами записать, что известно по условию задачи | 50 л Х л 2C2H2 + 5O2 = 4CO2 + 2H2O | ||
| 5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (находим объёмы ацетилена и кислорода). ν – коэффициенты перед соответствующими веществами | Vm = 22,4 л/моль V = ν · Vm V(C2H2) = 2 моль · 22,4 л/моль = 44,8 л V (O2) = 5 моль · 22,4 л/моль = 112 л 50 л Х л 2C2H2 + 5O2 = 4CO2 + 2H2O 44,8 л 112 л | ||
| 6. Составляем пропорцию и производим расчёт | 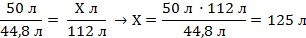
| ||
| или методом стехиометрического соотношения
| |||
| выполняем пункты 1 - 4 | |||
| 5. Над формулами веществ запишем данные об объемах газообразных веществ, известные из условия задачи, а под формулами — стехиометрические соотношения, отображаемые уравнением реакции, которые для газов, согласно закону Авогадро, равны их объемным отношениям | 50 л Х л 2C2H2 + 5O2 = 4CO2 + 2H2O 2 моль 5 моль 50 : Х = 2 : 5 | ||
| 6. Составить пропорцию и решить | 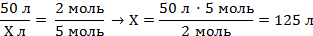
| ||
| Запишите ответ | Ответ: V = 125 л | ||
Алгоритм решения задач по уравнению химической реакции
|
|
|
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ | ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ | ||
| на нахождение массы вещества | |||
| метод пропорций | |||
| 1.Прочитайте текст задачи. | Какая масса гидроксида натрия необходима для реакции с 68,6 г ортофосфорной кислоты с образованием средней соли? | ||
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений. | 2.Дано: m (H3PO4) = 68,6 г m (NaOH) = ? | ||
| 3. Запишите уравнение реакции | 3.Решение: 3NaOH + H3PO4 = Na3PO4 + 3H2O | ||
| 4. Над формулами записать, что известно по условию задачи | Х г 68,6 г 3NaOH + H3PO4 = Na3PO4 + 3H2O | ||
| 5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (находим массы гидроксида натрия и ортофосфорной кислоты). (ν – коэффициенты перед соответствующими веществами) | Mr (NaOH) = Ar(Na) + Ar(O) + Ar(H) = 23 + 16 + 1 = 40 M (NaOH) = 40 г/моль m (NaOH) = ν · M = 3 моль · 40 г/моль = 120 г Mr (H3PO4) = 3Ar(H) + Ar(P) + 4Ar(O) = 3 · 1 + 31 + 4 · 16 = 98 M (H3PO4) = 98 г/моль m (H3PO4) = ν · M = 1 моль · 98 г/моль = 98 г Х г 68,6 г 3NaOH + H3PO4 = Na3PO4 + 3H2O 120 г 98 г | ||
| 6. Составляем пропорцию и производим расчёт | 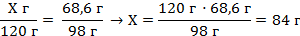
| ||
| количественный метод
| |||
| выполнить пункты 1 - 3 | |||
| 4. Рассчитать молярные массы гидроксида натрия и ортофосфорной кислоты | Mr (NaOH) = Ar(Na) + Ar(O) + Ar(H) = 23 + 16 + 1 = 40 M (NaOH) = 40 г/моль Mr (H3PO4) = 3Ar(H) + Ar(P) + 4Ar(O) = 3 · 1 + 31 + 4 · 16 = 98 M (H3PO4) = 98 г/моль | ||
| 5. Рассчитать количество ортофосфорной кислоты по формуле | 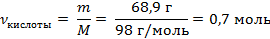
| ||
| 6. Записать в уравнении данные по условию уравнения и полученные величины над формулами, под формулам - количество данных веществ (ν – коэффициенты перед соответствующими веществами) | Х моль 0,7 моль 3NaOH + H3PO4 = Na3PO4 + 3H2O 3 моль 1 моль | ||
| 7. Составить и решить пропорцию | 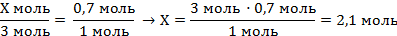
| ||
| 8. По формуле найти массу гидроксида натрия | m (NaOH) = ν · M = 2,1 моль · 40 г/моль = 84 г | ||
| Записать ответ | Ответ: m (NaOH) = 84 г | ||
| на нахождение объёма вещества | |||
| 1.Прочитайте текст задачи. | Какой объём газа выделится при взаимодействии 6,5 г цинка с избытком раствора серной кислоты? | ||
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений. | 2.Дано: m (Zn) = 6,5 г V(Н2) = ? | ||
| 3. Запишите уравнение реакции | 3.Решение: Zn + H2SO4 = ZnSO4 + H2↑ | ||
| 4. Над формулами записать, что известно по условию задачи | 6,5 г Х л Zn + H2SO4 = ZnSO4 + H2↑ | ||
| 5. Вычислить массу цинка и объём водорода по уравнению реакции | Mr (Zn) = Ar(Zn) = 65 M (Zn) = 65 г/моль m (Zn) = ν · M = 1 моль · 65 г/моль = 65 г V = ν · Vm = 1 моль · 22,4 л/моль = 22,4 л | ||
| 6. Полученные величины записать под соответствующими формулами | 6,5 г Х л Zn + H2SO4 = ZnSO4 + H2↑ 65 г 22,4 л | ||
| 7. Составить и решить пропорцию | 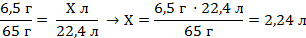
| ||
| количественный метод
| |||
| выполнить 1 – 3 | |||
| 4. Рассчитать количество цинка | Mr (Zn) = Ar(Zn) = 65
M (Zn) = 65 г/моль
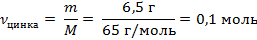
| ||
| 5. Полученную величину записать в уравнение над формулой цинка, под формулами количество вещества по уравнению реакции (коэффициенты перед формулами) | 0,1 моль Х моль Zn + H2SO4 = ZnSO4 + H2↑ 1 моль 1 моль | ||
| 6. Составить пропорцию и решить | 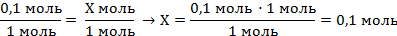
| ||
| 7. По формуле найти объём выделившегося газа | Vm = 22,4 л/моль V = ν · Vm V(H2) = 0,1 моль · 22,4 л/моль = 2,24 л | ||
| Записать ответ | Отсвет: V(H2) = 2,24 л | ||
| на нахождение количества вещества | |||
| 1.Прочитайте текст задачи. | Какое количество вещества алюминия реагировало с избытком соляной кислоты, если в ходе реакции выделилось 13,44 л (н.у.) водорода? | ||
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений. | 2.Дано: V (Н2) = 13,44 л н.у. ν (Al) = ? | ||
| 3. Запишите уравнение реакции | 3 Решение: Al + HCl = AlCl3 + H2↑ | ||
| 4. Над формулами записать, что известно по условию задачи | Х моль 13,44 л 2Al + 6HCl = 2AlCl3 + 3H2↑ | ||
| 5. По формуле вычислите объём водорода (по уравнению реакции) | V = ν · Vm V(H2) = 3 моль · 22,4 л/моль = 67,2 л | ||
| 6. Под формулами записать рассчитанный объём водорода и количество алюминия по уравнению реакции (коэффициент перед формулой) | Х моль 13,44 л 2Al + 6HCl = 2AlCl3 + 3H2↑ 2 моль 67,2 л | ||
| 7. Составить пропорцию и решить | 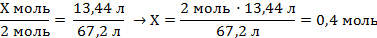
| ||
| количественный метод | |||
| выполнить пункты 1 - 3 | |||
| 4. Рассчитать количество водорода | 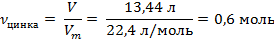
| ||
| 5. Над формулами записать, что известно и что надо найти | Х моль 0,6 моль 2Al + 6HCl = 2AlCl3 + 3H2↑ | ||
| 6. Под формулами записать количество водорода и количество алюминия по уравнению реакции (коэффициент перед формулой) | Х моль 0,6 моль 2Al + 6HCl = 2AlCl3 + 3H2↑ 2 моль 3 моль | ||
| 7. Составить пропорцию и решить | 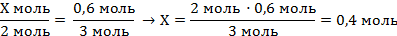
| ||
| Записать ответ | Ответ: ν (Al) = 0,4 моль | ||
Дата добавления: 2019-09-08; просмотров: 217; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
