Алгоритм расчёта по термохимическим уравнениям реакций
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ | ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
| 1.Прочитайте текст задачи. | Вычислить, какое количество теплоты выделится при сгорании 6,2 г фосфора. Термохимическое уравнение реакции горения фосфора: 4Р+5O2 = 2Р2O5+3010кДж. |
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений. | 2.Дано: m (Р) = 6,2 г Q = ? |
| 3.Запишите уравнение реакции | 3.Решение: 4Р+5O2 = 2Р2O5+3010кДж |
| 4. Над формулами записать, что известно по условию задачи | 6,2 г Х кДж 4Р+5O2 = 2Р2O5+3010кДж. |
| 5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (находим массу магния). | Mr (Р) = Ar(Р) = 31 M (Р) = 31 г/моль m (Р) = 4 моль · 31 г/моль = 124 г 6,2 г Х кДж 4Р+5O2 = 2Р2O5+3010кДж. 124 г |
| 6. Составьте пропорции и определите количество выделившейся теплоты . | 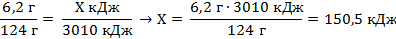
|
| количественный метод | |
| выполняем пункты 1 - 3 | |
| 4. Рассчитать количество фосфора | Mr (Р) = Ar(Р) = 31
M (Р) = 31 г/моль
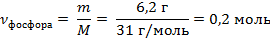
|
| 5. Над формулами записать известные величины и расчётное количество фосфора, под формулой количество фосфора по уравнению реакции (коэффициент перед формулой); составить и решить пропорцию | 0,2 моль Х кДж
4Р+5O2 = 2Р2O5+3010кДж.
4 моль
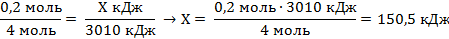
|
| Запишите ответ. | Ответ: Q = 150,5 кДж |
Алгоритм определения состава смеси
|
|
|
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ | ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ | ||
| 1.Прочитайте текст задачи. | Смесь кальция и оксида кальция массой 5 г обработала водой. В результате реакции выделилось 1,68 л газа (н.у.). Определите массовую долю оксида кальция в исходной смеси. | ||
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений. | 2.Дано: mсмеси = 5 г Vгаза = 1,68 л (н.у.) ω (CaO) = ? | ||
| 3. Составьте уравнения химических реакций. Оба компонента смеси взаимодействуют с водой, но только при взаимодействии кальция с водой выделяется газ (водород). Поэтому расчёт производим по уравнению 1. | 3.Решение: 1) Са + 2Н2О = Са(OН)2 + Н2↑ 2) CаO + Н2О = Са(OН)2 | ||
| 4. Над формулами записать, что известно по условию задачи | Х г 1,68 л Са + 2Н2О = Са(OН)2 + Н2↑ | ||
| 5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (находим массу кальция). | Mr (Са) = Ar(Са) = 40 M (Са) = 40 г/моль m (Са) = 1 моль · 40 г/моль = 40 г Х г 1,68 л Са + 2Н2О = Са(OН)2 + Н2↑ 40 г 22,4 л | ||
| 6. Составьте пропорции и определите массу кальция в смеси . | 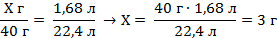
| ||
| 7. Рассчитать массу оксида кальция в смеси | m (CaO) = m (смеси) - m (Са) = 5 г – 3 г = 2 г | ||
| 8. Рассчитать массовую долю оксида кальция в смеси | 
| ||
| количественный метод
| |||
| выполняем пункты 1 - 3 | |||
| 4. Рассчитать количество газообразного вещества – водорода, зная, что Vm - величина постоянная для любого газа (н.у.) 22,4 л/моль | 
| ||
| 5. Над формулами записать известные величины и расчётное количество фосфора, под формулой количество фосфора по уравнению реакции (коэффициент перед формулой); составить и решить пропорцию | Х моль 0,075 моль
Са + 2Н2О = Са(OН)2 + Н2↑
1 моль 1 моль
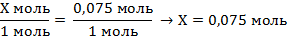
| ||
| 6. Рассчитать массу кальция в смеси | Mr (Са) = Ar(Са) = 40
M (Са) = 40 г/моль
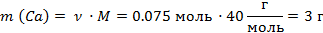
| ||
| 7. Рассчитать массу оксида кальция в смеси | m (CaO) = m (смеси) - m (Са) = 5 г – 3 г = 2 г | ||
| 8. Рассчитать массовую долю оксида кальция в смеси | 
| ||
| Запишите ответ. | Ответ: 
| ||
Дата добавления: 2019-09-08; просмотров: 175; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
