Алгоритм определения массовых соотношений элементов в соединении
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ | ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
| 1.Прочитайте текст задачи. | Определить массовые соотношения железа и кислорода в оксиде железа (III) |
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений. | 2.Дано: Fe2O3 |
| 3.Найдите относительную молекулярную массу оксида железа (III) | 3.Решение: Mr(Fe2O3) = 2Ar(Fe) + 3Ar(O) = 2 · 56 + 3 · 16 = 112 + 48 |
| 4. Вычислите простейшие массовые отношения, для чего сократите массы элементов на одно и то же число. | 4.  → 28 : 12 → → 28 : 12 → 
|
| 5.Запишите ответ. | Ответ: В оксиде железа (III) на 7 г атомов железа приходится 3 г атомов кислорода |
Алгоритм определения молекулярной формулы вещества по массовым соотношениям элементов
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ | ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
| 1.Прочитайте текст задачи. | Химическое соединение содержит по массе 17,56% натрия, 39,69% хрома и 42,75% кислорода. Определите простейшую формулу соединения |
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений. | 2.Дано:
 (Na) = 17,56% (Na) = 17,56%
 (Cr) = 39,69% (Cr) = 39,69%
 (O) = 42,75%
NaxCryOz = ? (O) = 42,75%
NaxCryOz = ?
|
| 3.Запишите относительные атомные массы для каждого элемента | 3.Решение: Ar(Na) = 23 Ar(Cr) = 52 Ar(O) = 16 |
| 4. Составьте пропорции соотношения массовой доли элемента к его относительной атомной массе | 4. 

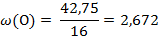 x : y : z = 0,763 : 0,763 : 2,672 = 1 : 1 : 3,5
x : y : z = 0,763 : 0,763 : 2,672 = 1 : 1 : 3,5
|
| 5. Если получается десятичная дробь, то необходимо избавиться от десятичной дроби. Для этого полученные цифры увеличиваем в 2 раза | x : y : z = 2·1 : 2·1 : 2·3,5 = 2 : 2 : 7 |
| 6.Запишите ответ. | Ответ: Простейшая формула вещества Na2Cr2O7 |
|
|
|
Алгоритм расчёта выхода продукта реакции от теоретически возможного
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ | ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
| 1.Прочитайте текст задачи. | Определите объём (н.у.) оксида азота (II), образовавшегося при окислении 100 г аммиака в присутствии платинового катализатора, если выход продукта реакции составляет 85% |
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений. | 2.Дано: m (NH3) = 100 г η (NO) = 85% = 0,85 V (NO) = ? |
| 3.Запишите уравнение реакции | 3.Решение: 4NH3 + O2 → 4NO + 6H2O |
| 4. Над формулами соответствующих веществ запишите то, что дано в условии задачи, и то, что надо найти | 100 г х л 4NH3 + O2 → 4NO + 6H2O |
| 5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (массу аммиака и объём оксида азот (П) | Mr (NH3) = Ar(N) + 3Ar(H) = 14 + 3 · 1 = 17 M (NH3) = 17 г/моль m (NH3) = 4 моль · 17 г/моль = 68 г V (NO) = ν (NO) · Vm = 4 моль · 22,4 л/моль = 89,6 л 100 г х л 4NH3 + O2 → 4NO + 6H2O 68 г 89,6 л |
| 6. Составьте пропорции и определите теоретически возможный объём оксида азота (П) | 
|
| 7. По формуле находим практический объём оксида азота (П) |  Vпрактический = 0,85 · 132 л = 112,2 л
Vпрактический = 0,85 · 132 л = 112,2 л
|
| 8.Запишите ответ. | Ответ: Vпрактический (NO) = 112,2 л |
|
|
|
Алгоритм решения задачи на расчёт по уравнению реакции, если одно из реагирующих веществ дано в избытке
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ | ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ | ||
| 1.Прочитайте текст задачи. | Определите массу соли, образующейся при взаимодействии 10 г гидроксида натрия и 10 г азотной кислоты | ||
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений. | 2.Дано: m (NaOH) = 10 г m(HNO3) = 10 г m (NaNO3) = ? | ||
| 3.Запишите уравнение реакции | 3.Решение: NaOH + HNO3 = NaNO3 + H2O | ||
| 4. Вычислить молярные массы веществ | Mr(NaOH) = Ar(Na) + Ar(O) + Ar(H) = 23 + 16 + 1 = 40 M(NaOH) = 40 г/моль Mr(HNO3) = Ar(H) + Ar(N) + 3Ar(O) = 1 + 14 + 3 · 16 = 63 M(HNO3) = 63 г/моль Mr (NaNO3) = Ar(Na) + Ar(N) + 3Ar(O) = 23 + 14 + 3 · 16 = 85 M (NaNO3) = 85 г/моль | ||
5. Определим, какое вещество дано в избытке, какое – в недостатке по формуле 
| 
 (избыток) (избыток)
 (недостаток)
0,25 (недостаток)
0,25  0,159, следовательно азотная кислота дана в недостатке 0,159, следовательно азотная кислота дана в недостатке
| ||
| 6. Расчёты производим по веществу, которое дано в недостатке | |||
| метод пропорций
| |||
| 7. Над формулами соответствующих веществ запишите то, что дано в условии задачи (над веществом, данным в недостатке), и то, что надо найти | 10 г Х г NaOH + HNO3 = NaNO3 + H2O | ||
| 8. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (массу азотной кислоты и нитрата натрия) | m(HNO3) = ν · M = 1 моль · 63 г/моль = 63 г m(NaNO3) = ν · M = 1 моль · 85 г/моль = 85 г 10 г Х г NaOH + HNO3 = NaNO3 + H2O 63 г 85 г | ||
| 9. Составьте пропорции и определите массу соли | 
| ||
| количественный метод | |||
| Выполняем пункты 1 - 6 | |||
| 7. Над формулами соответствующих веществ запишите то, что дано в условии задачи (над веществом, данным в недостатке), и то, что надо найти | 0,159 моль Х г NaOH + HNO3 = NaNO3 + H2O | ||
| 8. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (количество азотной кислоты и массу нитрата натрия) | 0,159 моль Х г NaOH + HNO3 = NaNO3 + H2O 1 моль 85 г | ||
| 9. Составьте пропорции и определите массу соли | 
| ||
| 10.Запишите ответ. | Ответ: m(NaNO3) = 13,5 г | ||
Дата добавления: 2019-09-08; просмотров: 305; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
