Научные положения, выносимые на защиту
1. Наиболее частой причиной ОПН в многопрофильном лечебном учреждении является нарушение системной гемодинамики в результате септического или геморрагического шока, гиповолемии, острой сердечно-сосудистой недостаточности. Поскольку острая почечная недостаточность циркуляторного генеза в 98% случаев сочетается с недостаточностью других органов и систем (чаще всего сердечно-сосудистой) ее следует рассматривать не как изолированное моноорганное повреждение, а как компонент полиорганной недостаточности.
2. Ранняя диагностика и своевременное начало интенсивной медикаментозной терапии позволяет у 49 % больных предотвратить развитие тяжелого почечного повреждения. Отсутствие выраженного диуретического эффекта в течение 12 часов или нарастание азотистых шлаков крови более чем в 1,5 раза при острой почечной недостаточности является показанием для начала проведения заместительной почечной терапии, не дожидаясь развития тяжелых уремических осложнений.
3. Проведение гемодиафильтрации с замещением 90 мл/кг/час при септическом шоке позволяет стабилизировать гемодинамику, существенно снизить дозы адреномиметиков и в 92% случаев предотвратить развитие анурической острой почечной недостаточности, поэтому высокообъемную гемофильтрацию следует включать в комплексную терапию септического шока и следует рассматривать как средство нефропротективной терапии.
|
|
|
4. Гемодиализ оказывает выраженный катаболический эффект, проявляющийся в потере за 4 часа стандартного диализа до 2000 кДж энергии и до 37,4 г глюкозы в экстракорпоральном контуре, что сопровождается снижением концентрации инсулина и нарастанием уровня глюкагона в плазме. Оптимальная компенсация катаболического эффекта достигается применением изотермического диализата с интрадиализной инфузией глюкозо-инсулиновой смеси.
5. Альбуминовый диализ является эффективным методом элиминации как гидрофобных, так и гидрофильных токсических веществ, накапливающихся при острой печеночной и печеночно-почечной недостаточности. В результате проведения альбуминового диализа устраняются проявления энцефалопатии, происходит стабилизация гемодинамики и нормализация суточного диуреза, что позволяет рассматривать альбуминовый диализ не только в качестве средства заместительной терапии, но и как метод лечения острой печеночно-почечной недостаточности.
Практическая реализация результатов работы. Основные результаты проведенных исследований внедрены в клиническую практику отделений анестезиологии и реанимации, гемодиализа, детоксикации Главного военного клинического госпиталя имени академика Н.Н. Бурденко и 7 центрального военного клинического авиационного госпиталя. Результаты исследований используются в лекционном и учебном материале ГУ НИИ общей реаниматологии РАМН, кафедры анестезиологии и реаниматологии ГОУ ВПО МГМСУ Росздрава, а также Государственного института усовершенствования врачей Министерства обороны Российской Федерации.
|
|
|
Апробация работы
Материалы диссертации доложены на научно-практических конференциях ГВКГ им. Н.Н. Бурденко: «Интенсивные методы лечения в клинической практике» 1996, «Возможности и перспективы диагностики и лечения в клинической практике» 1997, «Внепочечные методы очищения крови в специализированной медицинской помощи» 1997, «25 лет Центру анестезиологии, реанимации и интенсивной терапии. Анестезиология, реаниматология и интенсивная терапия в госпитале за 40 лет» 2000, «Неотложная медицинская помощь: состояние, проблемы, перспективы развития» 2004; VI Всероссийского съезда анестезиологов и реаниматологов, 1998; научных конференциях НИИ ОР РАМН «Критические технологии в реаниматологии» 2003, «Реаниматология. Ее роль в современной медицине» 2004; IV и V международных конференциях «Актуальные аспекты экстракорпорального очищения крови в интенсивной терапии» 2004, 2006; XII Российском национальном конгрессе «Человек и лекарство» 2005; V межрегиональной научно-практической конференции «Искусственное питание и инфузионная терапия больных в медицине критических состояний» СПБ 2005; заседании и ежегодной сессии Московского научного общества анестезиологов и реаниматологов 2006, 2007; 11 и 12 Российской конференции «Гепатология сегодня» 2006, 2007; Межрегиональной научно-практической конференции «Сепсис: вопросы клинической патофизиологии, эпидемиологии, диагностики и интенсивной терапии» Кемерово, 2006; IV международной конференции «Современные аспекты заместительной почечной терапии» Тунис, 2006; международной конференции «Инновационные технологии Гамбро в лечении почечной недостаточности» Прага, 2006; научной конференции «Критические и терминальные состояния, постреанимационная болезнь (патогенез, клиника, лечение)» Москва, 2006; Российско-французской школе-семинаре «Передовые рубежи нефрологии» Москва, 2007; Международной научно-практической конференции “Актуальні питання замісної ниркової та печінкової терапії” Киев 2007; международном симпозиуме «Острое повреждение легких, острый дистресс синдром, пневмонии при критических состояниях» Прага, 2007.
|
|
|
Объем и структура диссертации. Диссертация изложена на 222 страницах текста и состоит из введения, 6 глав, заключения, выводов и практических рекомендаций, указателя использованной литературы. Список литературы включает 310 источников, в том числе 248 работ иностранных авторов. Работа иллюстрирована 36 рисунками, 20 таблицами.
|
|
|
Характеристика больных
В работе выполнен анализ лечения 276 больных и пострадавших с острой почечной недостаточностью, лечившихся в ГВКГ им. Н.Н. Бурденко. Основную группу (более 70%) составили мужчины (табл. 1).
Таблица 1 Распределение больных по полу и возрасту
| Возраст (лет) | Мужчины | Женщины | Всего |
| 19 - 35 | 37 | 8 | 45 |
| 36 - 55 | 58 | 18 | 76 |
| 56 - 75 | 109 | 54 | 155 |
| Всего | 204 | 72 | 276 |
Чаще ОПН развивалась в пожилом возрасте. В 48 наблюдениях (17,4%) острая почечная недостаточность развилась на фоне предшествующего заболевания почек и хронической почечной недостаточности I ст. Выделены следующие состояния, приведшие к ОПН (рис. 1) – циркуляторный (преренальный) механизм (септический шок, кардиогенный шок, гиповолемия), ренальное повреждение (рабдомиолиз, токсико-аллергическая реакция на лекарственные препараты, инфекционное повреждение при ГЛПС и лептоспирозе), почечный блок (уретеро и нефролитиаз, внутриканальцевая обструкция при миеломе и подагре), печеночно-почечная недостаточность.
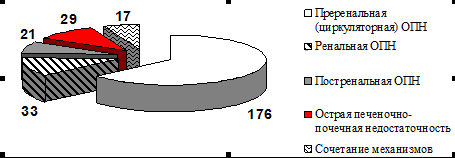
Рис. 1. Частота различных механизмов ОПН
В 17 случаях отмечено сочетание механизмов почечного повреждения – у 10 больных гемодинамической нестабильности и применения нефротоксичных препаратов, еще у 7 – травматического шока и рабдомиолиза.
Наиболее частой причиной ОПН (63,8%) было нарушение системной и органной циркуляции. Основными причинами были сепсис и септический шок, а также гиповолемия, в том числе связанная с секвестрацией внеклеточной жидкости (перитонит, панкреатит) и сердечно-сосудистая недостаточность после кардиохирургических вмешательств (рис. 2). Поскольку ОПН циркуляторного генеза была связана с нарушением системной гемодинамики, сопровождалась нарушением макро- и микроциркуляции во всех органах и системах, как правило она сочеталась с недостаточностью других органов и систем (системы крови в 95 %, дыхательной системы в 61%, ЦНС 59%, ЖКТ– 43 %) и являлась компонентом полиорганной недостаточности.
Ренальную (паренхиматозную) ОПН наблюдали у 33 раненых и больных. Наиболее частыми причинами ее стали варианты рабдомиолиза - ишемический (синдром позиционного сдавления – 12 пострадавших, 36,3 %) и травматический (9 пострадавших (27,3 %), в том числе синдром длительного сдавления – 4 пострадавших, минно-взрывная травма и массивное размозжение мышц – 6 пострадавших). Токсико-аллергическая реакция на лекарственные препараты (аминогликозиды у 4 больных, препараты платины у 3 больных, рентгенконтрастные препараты у одного больного) и ОПН инфекционного генеза встречались реже. Малое количество токсико-аллергической ОПН связано с широким информированием врачей о нефротоксичности различных препаратов и появлением возможности выбора альтернативной медикаментозной терапии. У 2 больных причиной ОПН явился лептоспироз, и у одного больного – геморрагическая лихорадка с почечным синдромом.

Рис. 2. Этиологические факторы ОПН циркуляторного генеза.
Постренальную ОПН наблюдали у 21 больного - у 9-ти (42,8%) причиной стала двусторонняя обструкция конкрементами или нефролитиаз единственной почки. У 2 больных сдавление мочеточников извне осуществлялось опухолью забрюшинной клетчатки (фибромой), у одной больной гигантская опухоль матки винтообразно деформировала мочеточники, вызвав нарушение оттока мочи и острую почечную недостаточность. У 8 больных наблюдали внутриканальцевую обструкцию – у 6 на фоне парапротеинового криза при меланоме и у 2 – в результате выпадения кристаллов мочевой кислоты при подагре.
У подавляющего большинства больных с ОПН циркуляторного генеза (81,8%) поражение почек развилось во время стационарного лечения, и лишь у 18,2% - на догоспитальном этапе. В отличие от этого, ренальная и постренальная ОПН чаще развивалась вне стационара (72,2% и 96 % соответственно).
Особую группу составили больные с острой печеночно-почечной недостаточностью. Причины совместного повреждения органов детоксикации долгие годы оставались неясными. Однако оно наблюдалось как при изолированных заболеваниях печени (вирусный гепатит), так и при полиорганной недостаточности. Активное развитие хирургии печени и расширение показаний к оперативному вмешательству, а также хирургической агрессии привело к существенному увеличению значимости интраоперационного уменьшения паренхимы печени в качестве причины острой печеночно-почечной недостаточности (рис. 3)
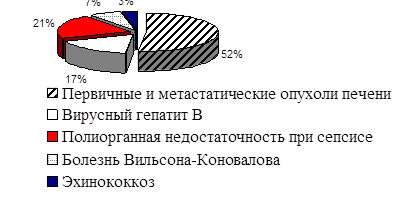
Рис. 3. Этиология острой печеночно-почечной недостаточности
Таким образом, наиболее частой причиной ОПН в многопрофильном госпитале является нарушение системной циркуляции в результате сепсиса или тяжелой сочетанной травмы, гиповолемии, острой сердечно-сосудистой недостаточности.
Методы исследования.
Больным проводили всестороннее клиническое, лабораторное и инструментальное обследование. В работе выполнен анализ лабораторных показателей при поступлении больных в стационар, до и после проведения операций экстракорпоральной детоксикации. Состояние больных при поступлении в стационар оценивали по шкале тяжести APACHE 2. При развитии системной гипотонии со снижением САД ниже 70 мм рт.ст. больным выполняли исследование количественного и биохимического состава мочи (мочевина, креатинин, натрий, калий, 2 – микроглобулин) (в2мг). Общеклинические исследования крови производили на автоматическом гематологическом аппарате «System 9000» (Baker, США). Определение биохимических показателей крови и мочи выполняли на автоматическом биохимическом анализаторе Technikon (Technikon, США) и биохимическом лабораторном аппарате Spektrum (Abbot, США). У части больных радиоиммунохимическим методом на аппарате Trakor – 1290 (Голландия) определялся уровень 2 – микроглобулина (в-2-мг), С-пептида, инсулина и глюкагона крови.
Многокомпонентный неинвазивный мониторинг состояния больного включал динамическое наблюдение за параметрами центральной гемодинамики, балансом водных секторов. Для оценки центральной гемодинамики и состояния водных секторов использовали аппаратно-программный комплекс "Диамант-Р", с помощью которого выполнялась импедансная спектроскопия (по Тищенко М.И.), проводимая до начала лечения и ежедневно в течение всего периода проведения заместительной почечной терапии. Кислотно-щелочное состояние (КЩС) и газы крови определяли на аппарате ABL – 300 (Radiometer, Дания).
Расчет доставки кислорода (DO2, мл/мин • м2) проводили по формуле:
DO2 = СИ (мл/мин *м2) * caO2(г/л)/1000 (норм. 550-680 мл/мин*м2).
Потребление кислорода (VO2, мл/мин • м2) определяется по формуле:
VO2 = AVR cO2(г/л)* СИ (мл/мин*м2)/1000 (норм. 115-165 мл/ мин* м2),
где AVR cO2 - артерио-венозная разница по содержанию кислорода.
Коэффициент экстракции кислорода (КЭК, %) считали по формуле:
КЭК = AVR cO2(г/л)/ caO2(г/л) *100 (норм 26-34%)(Золотокрылина Е.С., 1997)
Состояние углеводного обмена оценивали по данным «Кибернетического комплекса», разработанного Новиковым В.К. и соавт. (патент №1718822), который основан на одновременном определении ректальной температуры и температуры поверхности тела. С целью контроля температурного баланса во время гемодиализа использовали дополнительный модуль BTM аппарата «Искусственная почка» Fresenius 4008 Н, который позволяет оценить температуру крови в выходящей и входящей магистрали аппарата «Искусственная почка», а также суммарную потерю энергии в процессе гемодиализа (в кДж). Этот же модуль использовали для оценки доли рециркуляции в экстракорпоральном контуре термодилюционным способом. Одновременно с оценкой рециркуляции исследовали клиренс по мочевине, креатинину и фосфатам, рассчитывая его по формуле
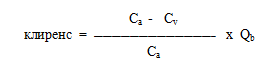
где Сa - концентрация вещества перед диализатором
Сv - концентрация вещества после диализатора
Qb - скорость кровотока (мл/мин)
Заместительная почечная терапия выполнялась в различных режимах - интермиттирующего гемодиализа, продленной гемофильтрации и гемодиафильтрации, а также высокообъемной гемофильтрации. Интермиттирующий гемодиализ выполнялся на аппаратах «Искусственная почка» 2008 С и 4008 Н (Fresenius, ФРГ). Последний аппарат, оснащенный дополнительным блоком «HDF on line», использовался для проведения также гемодиафильтрации и гемофильтрации в режиме производства замещающего раствора из диализата. Продленную гемофильтрацию и гемодиафильтрацию выполняли на специальных гемопроцессорах Prisma и Prismaflex (Gambro, Швеция) и Multifiltrat (Fresenius, ФРГ). Заместительное аппаратное лечение при острой печеночно-почечной недостаточности проводили с использованием комбинации гемодиафильтрации (ГДФ) и гемосорбции на аппарате «Искусственная почка» Fresenius 4008 H, а также альбуминового диализа на аппарате MARS (Gambro, Швеция). В отличие от гемодиализа и гемосорбции в этой системе реализован принцип опосредованной детоксикации через специальную высокопроницаемую мембрану. Перфузия крови осуществляется внутри капилляров диализатора, при этом снаружи роль диализата выполняет донорский альбумин. По градиенту концентраций происходит диффузия токсических субстанций через полупроницаемую мембрану из крови в наружный альбуминовый контур, принимающий на себя токсины. В связи с ограниченной проницаемостью мембраны (до 50 кДа) через мембрану проходят только вещества с малой и средней молекулярной массой, что позволяет избежать потери эндогенных функциональных молекул. В последующем за счет рециркуляции через обычный диализатор, сорбент и анионно-обменную смолу осуществляется регенерация связывающей способности насыщенного токсинами донорского альбумина.
Результаты, полученные при исследовании, обработаны вариационно-статистическим методом по t-критерию Стьюдента. Рассчитывали среднюю арифметическую (Х), среднее квадратическое отклонение (SD), значение t-критерия Стьюдента (t) и уровень значимости различий (р). При сравнении групп данных определяли коэффициент корреляции (k). Учитывая небольшое число наблюдений в группах, проверка статистических гипотез осуществлялась на основе непараметрических методов (Манна-Уитни, Колмогорова-Смирнова). Различие считали статистически достоверным, если уровень значимости был р < 0,05. Статистическая обработка результатов исследований выполнена на персональном компьютере с использованием пакета статистических прикладных программ Microsoft Statistica 6.0 и применением специальных программ непараметрической статистики, определяющих достоверность различий малых групп данных.
Дата добавления: 2019-09-02; просмотров: 153; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
