РИБОЗИМЫ КАК БИОКАТАЛИТИЧЕСКИЕ МОЛЕКУЛЫ И ПЕРСПЕКТИВЫ ИХ ИСПОЛЬЗОВАНИЯ
И.П. Гаврилов, В.И. Дудаков, 2 курс
Научный руководитель – к.б.н., доц. И.В. Карнаухова
Кафедра биологической химии
Оренбургский государственный медицинский университет
RIBOZYMES AS BIOCATALYTIC MOLECULES AND PROSPECTS FOR THEIR USE
I.P. Gavrilov, V.I. Dudakov, 2 course
Supervisor -Candidate of Biological Sciences, Assistant Professor I.V. Karnaukhova
Department of Biological Chemistry
The Orenburg State Medical University
Аннотация . В настоящее время исследование биокаталитической активности молекул РНК, называемыхрибозимами, имеет актуальное значение. В частности, остаются открытыми вопросы не только о раскрытии механизмов их действия, но и о применении в клинической практике. Изучается использование рибозимов в регуляции экспрессии генов, репарации мРНК.
Ключевые слова: Рибозим, биокаталитическая активность, естественные и синтетические рибозимы, экспрессия гена, онкоген, репарация, генотерапия.
Annotation.Currently, the question of the biocatalytic activity of RNA molecules, called ribozymes, is of relevant. In particular, questions remain not only about the disclosure of the mechanisms of their action, but also about the use in clinical practice. The use of ribozymes in the regulation of gene expression, in the reparation of mRNA is studying.
Key words: Ribozyme, biocatalytic activity, natural and synthetic ribozymes, gene expression, oncogene, reparation, gene therapy.
На протяжении многих десятилетий биохимики были уверены, что биологический катализ всегда и всюду осуществляется белками (ферменты). Но в1982-1983 гг. было показано, что в природе имеются виды РНК, которые, подобно белкам, обладают высокоспецифической каталитической активностью. Такие РНК-катализаторы были названы рибозимами.
|
|
|
Рибозим(сокращение от «рибонуклеиновая кислота» и «энзим») –это молекула РНК, обладающая каталитическим действием. Многие рибозимы естественного происхождения катализируют расщепление самих себя или других молекул РНК. Случаев, когда РНК выполняет каталитическую функцию, находясь в комплексе с белками, или организует сборку функционального РНК-белкового комплекса, сегодня известно очень много.
У большинства организмов, в том числе и человека, сплайсингом занимаются не рибозимы в чистом виде, а так называемые малые ядерные рибонуклеиновые частицы, представляющие собой комплексы РНК с белками, в которых РНК играет и структурную, и каталитическую роль. В природе обнаружены следующие рибозимы:интроны групп I и II; свинцовый рибозим(leadzyme) - обнаружено несколько естественных образцов, хотя впервые был создан в лаборатории;рибозим, содержащий шпильку;рибозим типа hammerhead;рибозим вируса дельта-гепатита;рибозимTetrahymena;рибозим VS;рибозим глюкозамин-синтазы(рибозим, активируемый глюкозамин-6-фосфатом).
После обнаружения естественных рибозимов начались и исследования новых синтетических рибозимов, созданных в пробирке. Например, получены саморасщепляющиеся РНК, обладающие высокой каталитической активностью.Тан и Брейкер выделили саморасщепляющиеся РНК путём отбора фрагментов из РНК, сформированных случайным образом. Среди синтетических рибозимов есть как обладающие уникальной структурой, не встречающейся или не обнаруженной в живой природе, как и другие, весьма схожие с природным рибозимом типа hammerhead, образующие пространственную структуру типа "головки молотка" (hammerhead - HH). Такие РНК были найдены у сателлитных РНК вирусов растений, вироидов, а также среди транскриптовсателлитных ДНК тритонов. У РНК подобного типа была определена минимальная каноническая последовательность, необходимая для появления ферментативной активности, длиной в 27 нуклеотидов, из которых высококонсервативны 13 нуклеотидов, а также последовательность из трех нуклеотидов, в пределах которой происходит расщепление фосфодиэфирной связи (Рис.1а).Другими примерами рибозимов являются РНК, образующие структуры типа шпилек, а также РНК вируса гепатита дельта (ВГД) и сателлитная РНК Варкуда (Varcudsatellite - VS) природных изолятовNeurospora (Рис.1б, в,г).
|
|
|

Рис.1. Примеры естественных рибозимов.
В начале 2000-х годов были открыты и так называемые рибосвитчи – РНК-переключатели биохимических процессов. Это участки молекул мРНК, которые сами ничего не кодируют, могут, связывая какую-то сигнальную молекулу в клетке, менять свою структуру и тем самым влиять на процесс транскрипции. Например, тиаминовыйрибосвитч, открытый российскими учеными из Института генетики и селекции промышленных микроорганизмов (Москва), связывается с тиаминпирофосфатом – производным витамина B1, что снижает трансляцию мРНК генов, участвующих в синтезе витамина B1. Раз этого витамина много, клетке можно не тратить силы на его производство.
|
|
|
На основании накопленных знаний о рибозимах складывается мнение о принципиальной возможности использования рибозимов для регуляции активности конкретных генов человека. Область применения рибозимов как лекарственных средств может быть весьма широкой. В качестве возможных сфер их использования в клиниках в настоящее время рассматривают лечение вирусных инфекций, онкологических заболеваний, для которых известны продукты онкогенов, а также патологических состояний организма, вызываемых сверхэкспрессией конкретных генов.
Большие усилия предпринимаются для использования рибозимов в лечении СПИДа, вызываемого вирусами иммунодефицита человека (ВИЧ). Уже в 1990 г. Н. Сарвер и соавторы продемонстрировали возможность расщепления геномной ВИЧ-РНК с помощью рибозимаinvitro в бесклеточной системе. Длительные эксперименты на культурах клеток показали, что клетки, экспрессирующие такие рибозимы, не изменяли своего обычного фенотипа на протяжении, по крайней мере, 9 месяцев. Полностью устойчивыми к заражению ВИЧ оказались клетки, содержащие рибозим под контролем вирусного регуляторного элемента tar, в которых вирус не обнаруживали даже через 22 дня после заражения. Еще одним подходом к преодолению ВИЧ-инфекции является отщепление 5’-концевой кэп-структуры ВИЧ-РНК с помощью рибозимов. Известно, что у большинства изолятов ВИЧ 5’-концевая лидерная последовательность их геномной РНК высококонсервативна. В то же время исследованные штаммы ВИЧ различаются по другим участкам 5’-концевой лидерной последовательности. Эндонуклеазное удаление в составе олигонуклеотида 5’-концевой кэп-группы РНК ВИЧ подавляет трансляцию РНК и делает ее более доступной мишенью для внутриклеточных нуклеаз. Все имеющиеся экспериментальные данные позволяют сегодня сделать вывод о перспективности использования 5’-концевой лидерной последовательности ВИЧ-РНК в качестве мишени для рибозимов.
|
|
|
Подавление функционирования онкогенов рибозимами – еще одна перспективная область их применения. Так, например, изучена роль подавления функционирования рибозимами гена H-ras. Мутация в кодоне 12 этого гена, приводящая к замене GGC на GUC, создает консенсусный сайт, по которому HH-рибозим может расщеплять мутантную мРНК. Invitro было продемонстрировано пятикратное различие в эффективности действия рибозима на мутантную H-ras-РНК и соответствующую РНК дикого типа. Получены H-ras-зависимые линии клеток, стабильно трансформированные экспрессирующим вектором, который направлял синтез HH-рибозима под контролем промотора бета-актинового гена. Для таких клеток характерна пониженная скорость пролиферации, сопряженная с уменьшением внутриклеточных уровней H-ras-РНК и белка р21, кодируемого этим геном. Далее рибозимэкспрессировали в клетках линии EJ карциномы мочевого пузыря человека. Введение исходных клеток мышам сопровождалось их быстрой гибелью на фоне развития высокоинвазивных опухолей. В отличие от этого клоны EJ-клеток, экспрессирующихрибозим, в организме мышей обладали резко сниженным опухолевым фенотипом. Образующиеся опухоли были малоинвазивны, и наблюдалось приблизительно двукратное повышение уровня выживаемости мышей с трансплантатами. Гистологические исследования подтверждали слабую способность опухолей к метастазированию. Рибозимы в опухолях обнаруживались методом ПЦР на протяжении 86-90 дней.
Исследована роль в подавлении рибозимами экспрессии гена c-fos. Его белковый продуктучаствует в передаче сигнала эукариотическими клетками, вовлечен в синтез ДНК и может придавать клеткам устойчивость к противоопухолевым препаратам. Последние два свойства этого белка находят подтверждение в том, что при проведении лечения часто используемым противоопухолевым лекарством = цисплатином (цис-диаминодихлорплатина)происходит индукция гена c-fos вслед за генами dTMP-синтазыи ДНК – полимеразы. Рибозим, разрушающий c-fos-мРНК, снижал конечный уровень экспрессии гена c-fos, приводил к повышению чувствительности опухолевых клеток к химиотерапевтическим агентам.
Рибозимыи используются также в репарации мутантных мРНК. Дж.Т.Джонс с соавторами (1996 г.) удалось приспособить рибозимы для восстановления генетической информации на уровне молекул РНК, структура которых нарушена мутациями. Рибозиминтрона группы I Tetrahymena после генно-инженерных модификаций оказался способным выполнять такие репарирующие функции.Такой подход был успешно использован для репарации мРНКгена lacZв клетках E. coli и в культивируемых клетках животных.
Применение рибозимов в реакциях транс-сплайсинга для корректировки экспрессии мутантных генов на посттранскрипционном уровне рассматривается как весьма перспективное направление в генотерапии.
РОЛЬ ФЕРМЕНТОВ В БИОСИНТЕЗЕ ПОЛОВЫХ СТЕРОИДНЫХ ГОРМОНОВ В ПЛАЦЕНТЕ
К.М. Жариков, И.А. Столяр, Н.В. Терехов, 4 курс
Научный руководитель – асс. Н.А. Воронцова
Кафедра акушерства и гинекологии
Оренбургский государственный медицинский университет
THEROLEOFENZYMES IN THE BIOSYNTHESIS OF SEX STEROID HORMONES IN THE PLACENTA
K.M. Zharikov, I.A. Stolyar, N.V. Terekhov, 4 course
Supervisor -Ass. N.A. Vorontsova
Department of obstetrics and gynecology
The Orenburg State Medical University
Аннотация . В статье проанализированы данные литературы о процессе синтеза половых стероидных гормонов во время беременности. Подробно разобраны стадии преобразования холестерина в прогестерон и эстрогены в фетоплацентарном комплексе, рассмотрены ферменты, участвующие в биосинтезе, представлены последние сведения о регуляции процесса.
Ключевые слова: синтез прогестерона, синтез эстрогенов, плацента.
Annotation .The references review about the process of sex steroid hormones synthesis during pregnancy is analyzed in the article. The stages of cholesterol transforming into progesterone and estrogens in fetoplacental complex are studied in detail, enzymes involved in biosynthesis are also examined, and the latest data about the process regulation are given.
Key words: progesterone synthesis, estrogens synthesis, placenta.
Актуальность.Во время беременности в женском организме появляется еще один важнейший орган, продуцирующий гормоны - плацента. О способности клеток трофобласта принимать участие в метаболизме стероидов свидетельствуют данные, полученные еще в 60-70 годах прошлого века. Считается, что плацента между первым и третьим месяцами внутриутробного эмбриогенеза берет на себя обеспечение плода всеми гормонами, необходимыми для его развития.
Цель и задачи исследования.Изучить роль ферментов в биосинтезе половых стероидных гормоновв фетоплацентарном комплексе, описать механизм биосинтеза половых стероидных гормонов в плаценте.
Материалы и методы.Анализ, систематизация и обобщение научной литературы, публикаций и статей в периодических изданиях.
Результаты.В ряде работбыло установлено, что стероид-продуцирующим органом является комплекс плаценты и плода -фетоплацентарный комплекс. Плод, как и плацента, является неполной стероидогенной системой. Однако ферменты, отсутствующие в плаценте, имеются в тканях плода, и наоборот.Начало синтеза одинаково для всех стероидных гормонов в плаценте. Поэтому их образование начинается с отщепления боковой цепи холестерина и формирования ключевого промежуточного продукта синтеза - прегненолона. Ход превращения холестерина сложен, он включает ряд последовательных стадий, в которых боковая цепь холестерина гидроксилируется по атомам С20 и С22, а затем расщепляется под действием десмолазы (фермента, относящегося к классу цитохром Р450-ферментов). Было установлено, что все три последовательные реакции катализируются одной и той же молекулой цитохрома Р450scc, то есть реализуется полуфункциональный катализ, предусматривающий высокую динамичность в области активного центра в процессе превращения исходного субстрата и промежуточных продуктов его окисления. В случае цитохрома Р450scc считается, что строгая последовательность реакций гидроксилирования обеспечивается термодинамическим механизмом стабилизации оксистероидов в активном центре гемопротеида: сродство оксипроизводных холестерина к цитохрому Р450scc значительно выше, чем исходных соединений. Превращение холестерина в прегненолон является лимитирующей стадией биосинтеза стероидных гормонов. Стимуляция активности происходит при участии цАМФ, лютеинизирующего гормона и хорионического гонадотропина. Фосфолипиды выступают в качестве низкоспиновых эффектов холестерин-гидроксилирующего цитохрома Р450 и играют принципиально важную роль в процессе превращение холестерина в прегненолон. Прогестерон синтезируется из прегненолона в две стадии:Холестерин - Прегненолон - Прогестерон.В молекуле прегненолона 3-гидроксигруппа окисляется в 3-оксогруппу, а двойная связь изомеризуется. Выполняет эту работу один фермент - 3Р-гидроксистероиддегидрогеназа I типа. Стимулируется данный процесс хорионическим гонадотропином и хорионическим адренокортикотропином посредством активации цАМФ. Ингибирование стероидогенеза на этой стадии может осуществляется и неконьюгированными предшественниками стероидов.В перфузате плаценты обнаружено большое количество прогестерона. Установлено, что в конце беременности данный орган продуцирует около 300 мгпрогестерона в день, что в десять раз превышает количество гормона, секретируемого во время полового цикла. Основная функция прогестерона - торможение сократительной функции миометрия и преобразование эндометрия.Метаболизм прогестерона происходит по типу, характерному для других Д4-3-кетостероидов. Основным его путем является восстановление кольца А; другим ведущим превращением является восстановление боковой цепи в 20-м положении.Биосинтез эстрогенов со стадии прегненолона может проходить по двум путям: Д4-путь (данный путь преобладает в яичниках) - через прогестерон, 17-оксипрогестерон и андростендион и Д5-путь через 17-ок-сипрегненолон, дегидроэпиандростерон,Д5-андростендиол и/или тестостерон (осуществляется преимущественно в фетоплацентарном комплексе и надпочечниках):
1) Синтез эстрогенов (плод):Прегненолон-17-гидроксипрегненолон-Дегидроэпиандростерон-Дегидроэпиандростеронсульфат;
2) Синтез эстрогенов (плацента): Дегидроэпиандростеронсульфат-Дегидроэпиандростерон –Андростендион-Эстрон.В этих реакциях участвует целый ряд ферментов: цитохром Р450с17, сульфокиназы, сульфатазы Д5-стероидов, дегидроэпиандростерондегидрогеназы (относящейся к классу 3р-гидроксистероиддегидрогеназ), цитохром Р450-ароматазы, 17Р-гидроксистероиддегид-рогеназы I типа. Существовало мнение, что образование из прегненолона и прогестерона С19-стероидов происходит практически только в тканях плода. Как прогестерон, так и прегненолон гидроксилируются плодом в 17а-положении. Однако отщепление боковой цепи у 17а-оксипрогестерона происходит в минимальном объеме, и он используется главным образом для синтеза С21-кортикостероидов в надпочечниках плода. В то же время плод имеет высокоактивную С17-С20-лиазу для Д5-стероидов, в результате чего из 17а-оксипрегненолона образуется дегидроэпиандростерон - в количественном отношении наиболее важный стероид плода. Он не только служит предшественником эстрогенов, но и выполняет самостоятельные физиологические функции. Основное физиологическое действие дегидроэпиандростерона связано с регуляцией различных звеньев репродуктивной системы и участием в процессе дифференцировки структур мозга. Образующийся дегидроэпиандростерон не используется в качестве субстрата 3р-оксистероиддегид-рогеназой плода, но под действием высокоактивной сульфокиназы превращается сульфоформу. Существует предположение, что синтез сульфата в надпочечниках плода происходит на уровне сульфатов ужена стадии прегненолона. Сульфатазная активность в тканях плода очень низка, однако она весьма значительна в плаценте, особенно по отношению к сульфатам Д5-стероидов. В результате большое количество дегидроэпиандростеронсульфата, образующегося в тканях плода, быстро гидролизуется плацентой. Образующийся дегидроэпиандростерон превращается плацентой в анростендион, и основная масса последнего быстро ароматизируется в эстрон и эстрадиол.Одной из характерных черт ферментного набора плаценты является отсутствие в ней 16а-гидроксилирующей активности. В результате плацента может, ароматизируя андростендион, образовывать лишь эстрон и эстрадиол, но не эстриол. Синтез последнего осуществляется при участии печени плода. Однако хорошо известно, что именно эстриол является доминирующим эстрогеном беременности у женщин. Уровень его в крови при беременности возрастает в 510 раз по сравнению с небеременными. Эстриол, нейтрализуя действие эстрона и эстрадиола, снижает сократительную способность матки. Он же и является наиболее активным протектором роста матки. Выдвигалась гипотеза об антиоксидантной функции эстриола на уровне развивающейся центральной нервной системы плода. Опыты с различными предшественниками показали, что может образовывать эстриол только в результате ароматизации 16-окисленных нейтральных предшественников плода и (или) матери. Основными предшественниками при образовании эстриола являются 16а, 17-диоксисоединения: Д5-андростентриол, 16-кето-Д5-андростендиол и 16а-оксиде-гидроэпиандростерон. У плода местом 16-гидроксилирования является в основном печень. Таким образом, значительная часть дегидроэпиандростерона, образующегося в надпочечниках плода, подвергается 16а-гидроксилированию в печени и затем ароматизируется в плаценте с образованием эстриола. 80% эстриола во время беременности синтезируется из дегидроэпиандростеронасульфата плодового происхождения и только 10% - из дегидроэпиандростеронсульфата, образующегося в коре надпочечников матери. Дегидроэпиандростерон-сульфат превращается в эстриол двумя путями. Основной путь включает 16а-гидроксилирование секретируемого фетальными надпочечниками дегидроэпиандростерон-сульфата в печени плода. Образовавшийся 16а-гидроксидегидроэ-пиандростеронсульфат в плаценте десульфатируется и под воздействием 3р-гидроксистероиддегидроге-назно-изомеразной системы трансформируется в 16а-гидроксиандростендион, затем в16а-гидрокситестостерон. Ароматизация последнего приводит к образованию эстриола. Наряду с 16а-гидроксилированными производными дегидроэпиандростеронсульфата в печени плода образуется Д5-андростентриол, который, поступая в плаценту, превращается в эстриол. Кроме «нейтрального» пути, биосинтез эстриола при беременности осуществляется 16а-гидроксилированием (фенольный тип) в печени плода и матери плацентарного эстрона, который, поступая обратно в плаценту, превращается в эстриол. Унебеременной женщины синтез эстриола происходит в печени путем преобразования первичных эстрогенов - эстрадиола 17Р и эстрона.Заключительным и уникальным этапом синтеза эстрогенов является ароматизация С19-стероидов. Эта реакция катализируется целым ферментным комплексом. Результаты опытов по сравнению перехода в эстрогены различных производных андростендиона позволили предположить, что промежуточным этапом при ароматизации нейтральных стероидов является гидроксилирование в 19-м положении. 19-гидроксилирование является лимитирующей реакцией всего процесса ароматизации. Для каждой из трех последовательных реакций смешанного типа (образование 19-оксиандростендиона, 19-кетоандростендиона и эстрона) требуется НАДФН и О2. В опытах на плаценте человека обнаружено, что для превращения 1М андростендиона в 1М эстрона требуется 3М НАДФН и 3М О2. Ключевым ферментом биосинтеза эстрогенов является цитохром Р-450-ароматаза. Она - единственный энзим, катализирующий процессы, приводящие к ароматизации первого кольца стероидного ядра и, следовательно, дающий начало эстрогенам - эстрону, эстрадиолу и эстриолу. Плацентарный цитохром Р450 в комплексе с андростендионом полностью нечувствителен к СО, но обнаруживает значительную чувствительность к окиси углерода с 19-нортестостероном. Метаболизм эстрогеновых стероидов существенно отличается от других стероидных гормонов. Если основные превращения нейтральных стероидов (кортикостероиды, андрогены, прогестерон) заключаются в восстановлении кольца А, то характерной особенностью обмена эстрогенов является сохранение у преобладающей массы их метаболитов ароматического кольца А. Первым этапом метаболизма эстрадиола, по-видимому, является его превращение в эстрон, катализируемое НАД(НАДФ)-зависимой 17Р-гидроксистероиддегидрогеназой. При беременности эстриол становится не только продуктом превращения эстрадиола и эстрона, но и одним из основных гормонов.
Выводы.Таким образом, в данной работе были собраны основные результаты, полученные отечественной и зарубежной наукой при изучении синтеза половых стероидных гормонов и роль ферментов в осуществлении этого процесса в фетоплацентарной системе. Несмотря на значительные достижения в этой области, многое еще остается недостаточно изученным, особенно это касается процессов регуляции биосинтеза во время беременности.
РОЛЬ КАЛЬЦИЯ И КАЛЬЦИЙСОДЕРЖАЩИХФЕРМЕНТОВ В ОРГАНИЗМЕ ЧЕЛОВЕКА
А.М. Киселёва, 3 курс
Научный руководитель-к. б. н., доц. Е.И. Шостак
Кафедра фармацевтической химии
Оренбургский государственный медицинский университет
THE ROLE OF CALCIUM AND CALCIUM-CONTAINING ENZYMES IN THE HUMAN BODY
A. M. Kiselyova, 3 course
Supervisor –Candidate of Biological Sciences, Assistant Professor E.I. Shostak
Department of pharmaceutical chemistry
The Orenburg State Medical University
Аннотация: Кальций и кальцийсодержащий фермент - кальпаин грают важную роль в жизни человека. Кальпаин - член широкого семейства цитозольных Са2+-активируемых цистеиновых протеаз. Она разрезает множество внутриклеточных белков, модифицируя их функции.
Ключевые слова: кальций, микроэлемент, протеаза, кальпаин.
Abstract: Calcium and calcium-containing enzyme-calpain you play an important role in human life. Calpain is a member of a wide family of cytosolic Ca2+-activated cysteine proteases. It cuts through many intracellular proteins, modifying their functions.
Key words: calcium, trace element, protease, calpain.
Кальций–один из важнейших макроэлементов организма человека, участвующих в построении тканей и обмене веществ. Элемент занимает пятое место в списке всех минералов, имеющихся в организме, составляя около 2 % веса человека.
Биологическая роль кальция. Прежде всего, кальций является важнейшим структурным компонентом костей и зубов. Кальций регулирует проницаемость клеточных мембран, инициирует ответы клеток на различные внешние стимулы. Присутствие кальция в клетки или во внеклеточной среде обуславливает дифференцировку клетки, а также сокращение мышц, секрецию и перистальтику. Кальций регулирует активность многих ферментов (включая ферменты систем свертывания крови)и работу некоторых эндокринных желез, обладая десенсибилизирующим и противовоспалительным эффектом.
Основные функции кальция в организме: структурный компонент костей и зубов,участвует в мышечных сокращениях, регулирует проницаемость клеточных мембран, участвует проводимости сигнала по нервным клеткам, регулирует сердечную деятельность, участвует в свертывании крови.
Пищевые источники кальция. Во многих продуктах питания растительного происхождения кальций содержится в виде труднорастворимых соединений (фосфатов, карбонатов, оксалатов), что обуславливает его плохое усвоение из них. Наиболее важным источником кальция является молоко (120мг/100г) и молочные продукты(особенно следует выделить сыр – содержит около 1000мг/100г. Среди растительных продуктов кальцием наиболее богаты ламинария, орехи и семена, как миндаль, лесной орех, кунжут, фисташки, фасоль, инжир, брюква, капуста брокколи, капуста, хрен, петрушка,лук, курага,яблокии др. Суточная потребность в кальции: 1000 мг у мужчин и 1200 мг у женщин.
Кальцийсодержащие ферменты
Кальпаин - член широкого семейства цитозольных Са2+-активируемых цистеиновых протеаз. Она разрезает множество внутриклеточных белков, модифицируя их функции. Она участвует в нейродегенеративных процессах и апоптозе. Она также разрушает белки цитоскелета и другие примембранные белки. Действие этой нейтральной протеазы практически необратимо, что является одной из причин опасности длительного повышения уровня Са2+ вцитозоле. Для большей надежности кальпаин контролируется кальпастином, который не только ингибирует его активность, но также предотвращает его связывание с мембранами.
Кальпаины принадлежат к семейству цитоплазматических кальцийзависимыхпротеиназ с папаиноподобной активностью, которые принимают участие в разнообразных процессах в организме: возрастных изменениях, при функционировании эндотелия и легочной системы, регуляции апоптоза и некроза, развитии различных гипометаболических состояний, артериальной гипертензии, диабете, хронической болезни почек и опухолевом росте.
Сделан вывод, что кальпаины с помощью ограниченного протеолиза своих субстратов играют важную роль в реализации широкого спектра биологических явлений. Их функционирование связано с ответом на кальцийзависимую сигнализацию и с эффектами старения. Угнетение активности кальпаинов способствует торможению развития дисфункции эндотелия, сердечно-сосудистых осложнений, формированию структурных и функциональных изменений в почечных тканях, имеет нейропротекторный эффект, предотвращает саркопению, ослабляет воспалительные реакции, вызванные гипервентиляцией легких.
Необходимо отметить Са2+ КМ-чувствительную аденилатциклазу ( Аденилатциклазы типа AC-I , AC-III и AC-VIII (c) активируются комплексом Са2+и ингибируются b-гамма-субъединицами) и Са2+КМ-чувствительные фосфодиэстеразы.
Регуляторная субъединица фосфатазыкальцинеурин Всвязывает Са2+ с высоким сродством, но для активации фосфатазной активности еще требуется Са2+-КМ в качестве регуляторной субъединицы.
Таким образом, можно сделать вывод о том, что кальцийсодержащие ферменты, такие как кальпаин принимают участия о многих в нейродегенеративных процессах, а также в возрастных изменениях, при функционировании эндотелия и легочной системы, регуляции апоптоза.
БИОСОВМЕСТИМЫЕ МАТЕРИАЛЫ ДЛЯ ПОЛУЧЕНИЯ ФЕРМЕНТ-СОДЕРЖАЩИХ НАДМОЛЕКУЛЯРНЫХ СИСТЕМ, ПРИМЕНЯЕМЫХ В ФАРМАЦИИ
Ю.С.Кондрашова, 2 курс
Научный руководитель - ст. препод. Н.В. Винокурова
Кафедра фармацевтической химии
Оренбургский государственный медицинский университет
BIOCOMPATIBLE MATERIALS FOR PRODUCING ENZYME-CONTAINING SUPRAMOLECULAR SYSTEMS USED IN PHARMACY
Y.S. Kondrashova, 2 course
Supervisor - St. Lectures N.V. Vinokurova
Department of pharmaceutical chemistry
The Orenburg State Medical University
Аннотация. Использование биосовместимых материалов для получения фермент-содержащих систем в фармации является актуальной областью для рассмотрения и изучения на сегодняшний день.При получении фермент-содержащих мультимолекулярных систем, в качестве носителей наиболее широко используются природные материалы.
Ключевые слова: Мультиферментные системы, альгинаты, пектин, аравийская камедь, хитозан, липидные носители, липосомы, биомембраны, холестерол, вязкотропная регуляция.
Annotation. The use of biocompatible materials for the production of enzyme-containing systems in pharmacy is a relevant area for consideration and study today. In the preparation of enzyme-containing multimolecular systems, natural materials are most widely used as carriers.
Key words: Multi-enzyme systems,alginate, pectin, gum Arabic, chitosan, lipid carriers, liposomes, biomembranes, cholesterol, maskatron regulation.
Мультимолекулярные (надмолекулярные)ферментные системы— комплексы, состоящие изразличных по строению ферментов, катализирующихпоследовательные ступени превращения определенного субстрата. Их особенностями является прочность ассоциации ферментов и определенная последовательность прохождения промежуточных стадийво времени, определяемая порядком расположенияферментов в пространстве. Молекулярная масса таких комплексов колеблется от 2,3 × 106 до 10 × 106. Образование подобных систем резко сокращает расстояния, на которые перемещаются молекулысубстратов. Мультимолекулярные ферментные системы могут быть структурно связанными с какой-либоорганеллой (рибосомой, митохондрией) или с биомембраной. К мультиферментным системам относятсяпируватдегидрогеназный и α-кетоглутарат дегидрогеназный комплексы.
Среди основных требований, предъявляемых к фермент-содержащим надмолекулярных системам, предназначенным для применения в фармации, отметим следующие:
1. возможность синтезировать требуемые системы в мягких условиях;
2. возможность контролировать свойства синтезируемых систем (структуры, размера, гидродинамических свойств, прочности);
3. возможность включения целевых биомолекул в мягких условиях;
4. возможность придавать системам желаемые функциональные свойства (например, флуоресцентные или магнитные) путем включения в микро- (нано)капсулы или на их поверхность соответствующих компонентов (например, квантовых точек);
5. биосовместимость и биодеградируемость материалов;
6. стабильность.
Целью работы, является изучение биосовместимые материалов для получения фермент-содержащих надмолекулярных систем, применяемых в фармации.
Методом исследования является анализ научной литературы по данной теме.
Результаты исследования:
Материалы, используемые в качестве носителей при иммобилизации биокатализаторов, чрезвычайно разнообразны. Это могут быть частицы на основе силикагеля, гидрооксида титана, циркония, железа и др., полимерные синтетические и природные материалы. Для синтеза оболочек при инкапсулировании биокатализаторов часто используются полиэлектролиты и полиэлектролитные пары поликатион-полианион. Химическая природа, молекулярный вес и структура полиэлектролитов входящих в состав оболочки капсул определяют свойства синтезируемых капсул, структуру, размер, проницаемость, прочность и др.
Синтетические полимеры обладают рядом преимуществ:
1. четко контролируемые свойства
2. высокая стабильность
3. химическая инертность
Тем не менее, при получении фермент-содержащих надмолекулярных систем предназначенных для применения в фармации, в качестве носителей наиболее широко используются природные материалы:
1. Альгинаты, соли альгиновой кислоты, широко используется для получения микро- и нанокапсул многих биоактивных молекул, ферментов, вакцин, инсулина и цитокинов. Альгинат образует гели с высокой степенью гидратации (высоким содержанием воды), высокой прочности, но относительно мягкой консистенции, что делает гидродинамические свойства геля близки по своим характеристикам к природным тканям. Гель на основе альгината образуется в мягких условиях при комнатной температуре без добавления органических растворителей, гель биодеградируем в физиологических условиях. Уникальные свойства альгината делают его одним из основных белковых носителей для доставки лекарств в организме.
2. Пектин. Среди природных полисахаридов, содержащих отрицательно заряженные группы, помимо альгината, широко распространенным является пектин, который используется в качестве гелеобразующего и влагоудерживающего агента, а также в качестве загустителя в пищевой и фармацевтической промышленности. Взаимодействие пектина с белками лежит в основе его многочисленных практических применениях, в основном для гелеобразования и стабилизации пен и эмульсий в производстве лекарственных средств, пищевых добавок и в пищевой промышленности. Классическим примером является использование пектина для стабилизации казеин-содержащих мицелл в кисломолочных напитках. Благодаря электростатическому взаимодействию отрицательно заряженных групп пектина с положительно заряженными аминогруппами казеина, молекулы пектина адсорбируются на казеиновых мицеллах, тем самым, предотвращая агрегацию в кислых средах.
3. Аравийская камедь. Аравийская камедь - натуральный гидроколлоидный полисахарид. В ее состав входят арабин (кальциевые, калиевые, магниевые соли арабиновой кислоты), глюкуроновая кислота, гиалуроновая кислота, ксилоза, галактоза растворяется в воде с образованием геля. Гуммиарабик отборный, белый, Gummi arabicumelectum, albissimum, употребляется в медицине как средство для похудения, замедляет прохождение пищи по кишечнику, уменьшает всасывание холестерина и жиров, лекарства на основе аравийской камеди обладают смягчающим, болеутоляющим, заживляющим действием. Аравийская камедь - противоожоговое средство для кожи, слизистыхдыхательных путей и ЖКТ. Может использоваться как основное лекарственное средство,а также как компонент для инкапсулирования и доставки лекарств.
4. Хитозан. Одним из наиболее распространенных и широко используемым аминополисахаридом является хитозан. Некоторые N – ацилпроизводные хитозана – хорошие гелеобразователи; при ацилирование хитозана производными дикарбоновых кислот получают поперечносшитые гели, удобные для получения ферментсодержащих систем. На примере ряда ферментов: липазы, целлюлазы, щелочной протеазы, L–аспарагиназы и др. было установлено, что в результате их иммобилизации на хитозане существенно увеличивается термостабильность ферментов. В ряде случаев наблюдается увеличение каталитической активности ферментов. Ферменты могут быть иммобилизованы на хитозане, используя как амино- так и гидроксильные группы, такую иммобилизацию называют “двойной иммобилизацией”. Сначала образуется связь между аминогруппой и глутаровым альдегидом, а затем междугидроксильной группой и карбодиимидом. “Двойная иммобилизация” приводит к дополнительной стабилизации фермента.
5. Липидные носители. Липосомы находят широкое применение в качестве наноносителей для ферментов и лекарственных препаратов, что обусловлено главным образом близостью свойств липидных носителей и природных биомембран.
По своей природе входящие в состав биологических мембран липиды можно разделить на три класса: фосфолипиды, гликолипиды и нейтральные липиды, основным представителем которых является холестерол.
Фосфолипиды составляют значительную часть липидов биомембран. Температура фазовых переходов таких липидов в биомембранах лежит значительно ниже температуры организма, что необходимо для осуществления в мембранах быстропротекающих процессов.
Фазовые переходы в мембранах играют важную роль в протекании не только транспортных процессов, но и функционировании мембранных ферментов и ферментных комплексов. Здесь идет речь о регуляции ферментативной активности при фазовом переходе, т.н. вязкотропной регуляции. Механизм вязкотропной регуляции рассматривает в качестве регулирующего фактора не только фазовое состояние, но и плотность упаковки липидов в мембране, которая определяется насыщенностью и длинной углеводородной цепи. Фосфолипидным составом определяется также проницаемость мембран.
Преимущество природных соединений перед синтетическими полимерами в том, что онибиосовместимы, нетоксичны и биодеградируемы в физиологических условиях.
Вывод: Таким образом, можно сделать вывод, что биосовместимые материалы для получения фермент-содержащих надмолекулярных систем, применяемых в фармации, изготавливаются из природных материалов, а не из синтетических.
ИММОБИЛИЗОВАННЫЕ ФЕРМЕНТЫ
М.Ю. Кравчук, Е.В. Биктеева, 2 курс
Научный руководитель – к.б.н., доц. Л.В. Гирина
Кафедра биологической химии
Оренбургский государственный медицинский университет
IMMOBILIZED ENZYMES
M.Y Kravchuk, E.V. Bikteeva, 2 course
Supervisor – Candidate of Biological Sciences, Assistant Professor L.V. Girina
Department of Biochemistry
The Orenburg State Medical University
Ферменты (от лат.fermentum – закваска), энзимы, специфические белковые катализаторы, присутствующие во всех живых клетках. Почти все биохимические реакции, протекающие в любом организме и в своём закономерном сочетании составляющие его обмен веществ, катализируются соответствующими ферментами. Направляя и регулируя обмен веществ, ферменты играют важнейшую роль во всех процессах жизнедеятельности.
Ключевые слова: ферменты, клетки, обмен веществ, технологии.
Enzymes (from lat. fermentum-ferment), enzymes, specific protein catalysts present in all living cells. Almost all biochemical reactions occurring in any organism and in its natural combination of components of its metabolism, catalyzed by the corresponding enzymes. Directing and regulating metabolism, enzymes play an important role in all processes of life.
Key words: enzymes, cells, metabolism, technologies.
Долгое время в различных пищевых технологиях применялись препараты свободных ферментов, сроки использования которых - один производственный цикл. Однако достижения молекулярной биологии, биохимии привели к тому, что в настоящее время строение и функции многих ферментов изучены очень детально и это позволило создать теоретическую базу для производства иммобилизованных ферментов, т. е. фиксированных или связанных ферментных препаратов.
Иммобилизация ферментов — прикрепление их в активной форме к нерастворимой (обычно это нерастворимый полимерный носитель) основе или заключение в полупроницаемую мембранную систему
Преимущества иммобилизованных ферментов перед нативными предшественниками
1. Гетерогенный катализатор легко отделим от реакционной среды, что даёт возможность остановить реакцию в любой момент, использовать фермент повторно, а также получать чистый от фермента продукт.
2. Ферментативный процесс с использованием иммобилизованных ферментов можно проводить непрерывно, регулируя скорость реакции и выход продукта.
3. Модификация фермента целенаправленно изменяет его свойства, такие как специфичность, зависимость от рН, ионного состава и других параметров среды, стабильность к денатурирующим воздействиям.
4. Можно регулировать каталитическую активность иммобилизованных ферментов путём изменения свойств носителя действием физических факторов, таких как свет и звук.
Существуют два принципиально различных метода иммобилизации ферментов: без возникновения ковалентных связей между ферментом и носителем (физические методы иммобилизации) и с образованием ковалентной связи между ними (химические методы иммобилизации). Каждый из этих методов осуществляется разными способами.
Физические методы иммобилизации ферментов реализуются посредством адсорбции фермента на нерастворимом носителе, путем включения энзимов в поры поперечносшитого геля, в полупроницаемые структуры или двухфазные системы.
При адсорбционной иммобилизации белковая молекула удерживается на поверхности носителя за счет электростатических, гидрофобных, дисперсионных взаимодействий и водородных связей. Эффективность адсорбции молекулы белка на носителе определяется удельной поверхностью (плотностью центров сорбции) и пористостью носителя.
Способ иммобилизации ферментов путем включения в трехмерную структуру полимерного геля широко распространен благодаря своей простоте и уникальности. Метод применим для иммобилизации не только индивидуальных ферментов, но и мультиэнзимных комплексов и даже интактных клеток.
Иммобилизация ферментов в полупроницаемые структуры. Сущность этого способа иммобилизации заключается в отделении водного раствора фермента от водного раствора субстрата с помощью полупроницаемой мембраны, пропускающей низкомолекулярные молекулы субстратов и кофакторов, но задерживающей большие молекулы фермента.
Ферменты, иммобилизованные путем включения в структуру липосом, используют преимущественно в медицинских и научных целях, ибо значительная часть ферментов в клетке локализована в составе липидного матрикса биологических мембран, поэтому изучение липосом имеет большое значение для понимания закономерностей процессов жизнедеятельности в клетке.
Ковалентно связывание при котором молекула фермента ковалентно связывается с нерастворимым полимером. Полимер может быть в виде порошка или в форме пленки. Иногда молекулы фермента соединяются ковалентными связями друг с другом или с каким-либо инертным белком; при этом образуется нерастворимый, но активный полимерный фермент.
Ферментные препараты широко используют в медицине. Ферменты в медицинской практике находят применение в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) средств.
Использование ферментов в качестве терапевтических средств имеет много ограничений вследствие их высокой иммуногенности. Тем не менее энзимотерапию активно развивают в следующих направлениях:
Заместительная энзимотерапия эффективна при желудочно-кишечных заболеваниях, связанных с недостаточностью секреции пищеварительных соков. Например, пепсин используют при ахилии, гипо- и анацидных гастритах. Дефицит панкреатических ферментов также в значительной степени может быть компенсирован приёмом внутрь препаратов, содержащих основные ферменты поджелудочной железы (фестал, энзистал, мезим-форте и др.).
В качестве дополнительных терапевтических средств ферменты используют при ряде заболеваний. Протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран с целью расщепления белков погибших клеток, для удаления сгустков крови или вязких секретов при воспалительных заболеваниях дыхательных путей. Ферментные препараты стали широко применять при тромбозах и тромбоэмболиях. С этой целью используют препараты фибринолизина, стрептолиазы, стрептодеказы, урокиназы.
Ферментные препараты используют при онкологических заболеваниях. Аспарагиназа, катализирующая реакцию катаболизма аспарагина, нашла применение для лечения лейкозов.
Фестал- данное ферментное средство широко известно. Этот препарат включает в себя панкреатин, экстракт желчи, микроэлемент гемицеллюлазу и натрия хлорид. Благодаря данным активным компонентам, Фестал способствует расщеплению белков, жиров и углеводов, лучшему усвоению пищи и всасыванию продуктов пищеварения через стенки кишечника.
Панкреатин – это основное ферментное средство, которое применяется при нарушениях работы ЖКТ и для улучшения пищеварения. Панкреатин почти не имеет противопоказаний. Назначается в случаях несварения, переедания, при сбоях в работе органов пищеварения. Основа панкреатина — это экстракт секрета, выделяемого поджелудочной железой животных.
Дезоксирибонуклеаза - фермент, деполимеризующий дезоксирибонуклеиновую кислоту, подавляет синтез вирусной ДНК и тем самым задерживает размножение ДНК - содержащих вирусов (вирусы группы герпеса, аденовирусы и др.). Препарат вызывает также разжижение гнойного содержимого абсцессов, эмпиэм, осложненных ран.
Химопсин - ферментный препарат протеолитического действия, расщепляет некротическую ткань, не оказывая действия на живую ткань, вследствие наличия в ней специфических антиферментов. Разжижает вязкие секреты и экссудаты.
Панзиформ - ферментное средство. Содержит панкреатические ферменты - амилазу, липазу и протеазы, которые облегчают переваривание углеводов, жиров и белков, что способствует их более полному всасыванию в тонкой кишке. При заболеваниях поджелудочной железы компенсирует недостаточность ее внешнесекреторной функции и способствует улучшению процесса пищеварения.
Кроме того, ферменты используют в качестве специфических реактивов для определения ряда веществ. Так, глюкозооксидазу применяют для количественного определения глюкозы в моче и крови. Фермент уреазу используют для определения содержания количества мочевины в крови и моче. С помощью различных дегидрогеназ обнаруживают соответствующие субстраты, например пируват, лактат, этиловый спирт и другое.
ДНК АБЗИМЫ КАК ВОЗМОЖНЫЕ МОЛЕКУЛЯРНЫЕ ИНСТРУМЕНТЫ В КЛИНИКЕ АУТОИММУННЫХ И ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
К.Е. Кулешов, 2 курс
Научный руководитель – к.б.н., доц. И.В. Карнаухова
Кафедра биологической химии
Оренбургский государственный медицинский университет
DNAABZYMESASPOSSIBLEMOLECULARTOOLSINTHECLINICOFAUTOIMMUNEANDTUMORDISEASES
K.E. Kuleshov, 2 course
Supervisor - Candidate of Biological Sciences , Assistant Professor I.V. Karnauhova
Department of biological chemistry
The Orenburg State Medical University
Природные каталитические аутоантитела (абзимы), обладающие протеолитической (протабзимы) и ДНК-гидролизующей активностью (ДНК-абзимы) выявляются при аутоиммунной патологии в клинике и в эксперименте. Описана каталитическая активность абзимов у больных с различными формами системной (органонеспецифической) и органоспецифической аутоиммунной патологии, а также возможность их использования для мониторинга активности аутоиммунных заболеваний.
Ключевые слова: ДНК-абзимы, аутоантитела.
Natural catalytic autoantibodies (abzymes) posessing proteolytic (protoabzymes) and DNA-hydrolysing (DNA-abzymes) activities are detectable in clinical and experimental autoimmune disorders. Catalytic activity of abzymes is revealed in the patients with different forms of systemic (nonspecific) and organspecific autoimmune pathology. The opportunity of assaying the abzymes for intensity monitoring of autoimmune disease is also described.
Key words: DNA-abzymes, autoantibodies.
Абзимы (отангл. antibodyenzyme — антитело-фермент) – этоприродныекаталитическиеаутоантитела, обладающиепротеолитической (протабзимы) иДНК-гидролизующейактивностью(ДНК-абзимы),которые могут выявляться при аутоиммунной патологии в клинике и в эксперименте.
Абзимы, как правило, представляют собой искуственныемоноклональные антитела. Природные каталитически активные антитела выделены из крови пациентов с различными аутоиммунными (системная красная волчанка, аутоиммунный тиреоидит, рассеянный склероз, астма), инфекционными (вирусными, бактериальными) заболеваниями.
Появление абзимов часто является самым ранним признаком развития аутоиммунных процессов, поэтому тестирование их активности является исключительно перспективным подходом как для ранней диагностики, так и для предсказания обострения хронически текущей болезни и оценки эффективности лечения теми или иными препаратами.
Патогенетическая роль ДНК-абзимов и физиологический смысл их каталитической активности остаются до сих пор невыясненными и требуют фундаментальных исследований, которые могут внести вклад в понимание механизмов развития некоторых форм аутоиммунной и опухолевой патологии, а также найти эффективное применение в клинической диагностике широкого круга заболеваний, сопряженных с аутоиммунными нарушениями. Тем не менее, доказана широкая распространенность ДНК-абзимов при заболеваниях аутоиммунной природы, среди которых особое место занимают системная красная волчанка (СКВ) и ревматоидный артрит (РА).
Установлено, что при СКВ, например, средние уровни каталитической и цитотоксической активности ДНК-абзимов, достоверно коррелируя между собой в достаточно широком диапазоне величин, обнаруживают выраженную зависимость от клинико-иммунологической картины заболевания.
Так, максимальный уровень цитотоксического эффекта ДНК-абзимов отмечен у больных с 3-й степенью активности СКВ, имеющих верхние значения по количественной шкале признаков SLEDAI и выраженную картину иммунопатологических сдвигов. Наоборот, минимальные значения уровня абзимоопосредуемойцитотоксичности обнаружены среди больных с 1-й степенью активности заболевания и стертой картиной иммунопатологии. ДНК-абзимы, полученные из крови больных РА, проявляли в отношении клеток-мишеней заметно меньшую цитотоксичность, а абзимы от больных с системной склеродермией цитотоксических свойств вообще были лишены, что свидетельствовало о доминирующей роли ДНК-абзимов в патогенезе тех групп заболеваний, при которых семейство ДНК-связывающих аутоантител с различными уровнями специфичности и функциональности играет ключевую роль.
Было установлено существование, по меньшей мере, двух различных механизмов реализации цитотоксического потенциала ДНК-абзимов– путем апоптоза и путем прямого цитотоксического эффекта на клетку-мишень, причем характер такого эффекта полностью опровергал сделанное ранее предположение об участии в опосредуемых ДНК-абзимами механизмах цитотоксичности комплемента.
Известно, что апоптотические клетки у больных СКВ и РА - это основные мишени для цитотоксического действия анти-ДНК аутоантител, в связи с чем перекрестно-реагирующие с апоптотическими клетками ДНК-абзимы могут вызывать деградацию этих клеток и, как итог, провоцировать развитие ряда клинических синдромов – в случае кросс-реактивности с эндотелием клубочков и сосудистого русла дермы у больных СКВ – формирование люпус-нефрита и кожного синдрома, а в случае кросс-реактивности с антигенами синовиальной оболочки суставов у больных РА – возникновение суставного синдрома. В пользу первого предположения относительно риска развития нефротического синдрома у больных СКВ, серопозитивных по ДНК-абзимам, свидетельствуют данные о том, что у части таких больных в стадии обострения уровни каталитической и цитотоксической активности ДНК-абзимов, а также их титры снижаются, что коррелирует также с уменьшением сывороточной концентрации ДНК-связывающих аутоантител. Не исключено, что определенная квота из таких «ускользающих» от клинициста ДНК-абзимов формирует в почечных клубочках «депо» ДНК-абзимов, участвующих в индукции апоптоза и, соответственно, запуске нефротического процесса и формировании симптомов люпус-нефрита. Накопленный нами клинический опыт и экспериментальный материал показывают, в частности, что серонегативные в отношении ДНК-абзимов случаи СКВ имеют менее благоприятный прогноз, чем в присутствии таких аутоантител.
Обсуждается возможность использования ДНК-абзимов в качестве молекулярных зондов и диагностических инструментов в практике ведения больных с грибковыми заболеваниями дыхательных путей. Не исключено, что в каталитической активности аутоантител, в частности, ДНК-абзимов запрограммирован, по мнению ряда исследователей, дополнительный энзиматический ресурс, реализация которого связана с особыми условиями метаболизма, например, при формировании аутоиммунного конфликта, на фоне инфекции или в период беременности.
ДНК-гидролизующиеаутоантитела, выделенные из мочи больных миеломой, в отличие от обычных для миеломы аутоантителаБенс-Джонса также цитотоксичны, обнаруживая при этом заметную негативную корреляцию с тяжестью клинической картины заболевания. Высокие уровни каталитической и цитотоксической активности ДНК-абзимов, коррелирующие с тяжестью заболевания и степенью выраженности клинической симптоматики, установлены также для ряда заболеваний лимфопролиферативной природы, протекающих с формированием признаков аутоиммунного конфликта.
Обладая уникальными каталитическими и цитотоксическими свойствами, ДНК-абзимы способны выступать в роли мощного регулятора апоптоза и других механизмов цитотоксичности при системных аутоиммунных и опухолевых заболеваниях, претендуя при этом на роль дополнительного инструмента в диагностике, в частности, СКВ и, возможно, РА. Не исключено, что в ближайшем будущем на основе ДНК-абзимов будут созданы иммунодиагностикумы нового поколения, позволяющие давать количественную оценку абзимоопосредованномуапоптозу и интерпретировать полученные данные в рамках нерешенных клинических задач.
Было показано, что природные ДНК-абзимы, помимо аутоиммунной и опухолевой патологии, встречаются также и у здоровых лиц. Это не удивительно, ибо природные ДНК-связывающие аутоантитела (в том числе, с каталитическими и цитотоксическими свойствами), обнаруживаемые у 1+2% клинически здоровых доноров, могут быть сопряжены с развитием ранних аутоиммунных конфликтов, скрытых от глаз клинициста. Формирование на этом латентном этапе дисбаланса в процессах физиологического апоптоза может стать в дальнейшем одной из причин развития клинической картины заболевания. При этом кандидатами на роль одного из индукторов аутоиммунного процесса могут служить ДНК-абзимы, способные вносить нарушения в изначально сбалансированный уровень физиологического апоптоза или же просто стимулировать деградацию иммуногенной ДНК в составе комплексов с нуклеосомами. Поэтому продемонстрированный ранее факт прямой зависимости степени тяжести и активности СКВ от уровней каталитической и цитотоксической активности ДНК-абзимов не противоречит другим работам, в которых на различных экспериментальных моделях СКВ четко отслежена зависимость аутоиммунного процесса и его клинической картины от степени дисбаланса в механизмах апоптоза.
Таким образом, будучи каталитически активными, ДНК-абзимы, относящиеся к семейству ДНК-связывающих аутоантител, могут играть при заболеваниях аутоиммунной природы весьма существенную роль в регуляции иммунного гомеостаза с одной стороны и представлять практическую ценность при разработке современных методов иммунодиагностики и иммунотерапии.
ОСНОВНЫЕ ЖЕЛЕЗОСОДЕРЖАЩИЕ ФЕРМЕНТЫ И СУБСТРАТЫ ОРГАНИЗМА
Л.В. Меркулова, 3 курс
Научный руководитель - к. б. н., доц. Е.И. Шостак
Кафедра фармацевтической химии
Оренбургский государственный медицинский университет
THEMAINIRON - CONTAININGENZYMESANDSUBSTRATES OF THE ORGANISM
L. V. Merkulova, 3 course
Supervisor -Candidate of Biological Sciences, Assistant Professor E.I. Shostak
Department of pharmaceutical chemistry
The Orenburg State Medical University
Аннотация. Железосодержащиеферменты (Гемоглобин, Миоглобин, Каталаза, Цитохром, Пероксидаза, Ферритин, Гемосидерин) играютважную роль в жизни человека. Основные функции железосодержащих ферментов: транспорт кислорода, транспорт и депонирование кислорода в мышцах, разложение перекиси водорода, тканевое дыхание, окисление веществ с помощью перекиси водорода, транспорт железа, тканевое депонирование железа.
Ключевые слова: железо, гемоглобин, миоглобин, железосодержащие ферменты.
Annotation.Iron containing enzymes (Hemoglobin, Myoglobin, Catalase, Cytochrome, Peroxidase, Ferritin, Hemosiderin) play an important role in human life. The main functions of iron-containing enzymes: transport of oxygen, transport and deposition of oxygen in the muscles, decomposition of hydrogen peroxide, tissue respiration, oxidation of substances with hydrogen peroxide, transport of iron, tissue deposition of iron.
Key words: iron, hemoglobin, myoglobin, iron-containing enzymes.
Железо является одним из самых важных микроэлементов для поддержания комфортной жизнедеятельности организма и протекания в нем различных химических процессов. Основная его часть находится в крови — 60%. Печень, селезенка, мышцы и костный мозг содержат около 20%, оставшиеся 20% уходят на синтез клеточных ферментов. Суточная норма железа различна: женщины – 15-20 мг, мужчины – 10 мг. Во время беременности суточная доля должна составлять30-35 мг. Железо принимает участие в сложных метаболических процессах, происходящих в живом организме.
Соединения железа в клетке обладают характерной только для них функциональной активностью и биологической ролью для организма. В свою очередь их можно подразделить на 4 группы:
1. гемопротеины, основным структурным элементом которых является гем (гемоглобин, миоглобин, цитохромы, каталаза и пероксидаза);
2. железосодержащие ферменты негеминовой группы (сукцинат-де- гидрогеназа, ацетил - коэнзим А - дегидрогеназа, НАДН, -цитохром С-редуктаза и др.);
3. ферритин и гемосидерин внутренних органов;
4. железо, рыхло связанное с белками и другими органическими веществами.
Гемоглобин, содержащийся в эритроцитах, выполняетважную для организма газотранспортную функцию – переноситэкзогенный кислород и эндогенный углекислый газ. Эритроцит поотношению к гемоглобину играет роль буферной системы, способнойрегулировать общую величину газотранспортной функции.Дыхательный пигмент крови - сложный белок, состоящийиз белковой молекулы – глобина и небелковой -гема. Глобин состоит из 2 пар полипептидных цепочек, каждаяиз которых содержит 141-146 аминокислот. Гем, составляющий 4% весамолекулы гемоглобина, содержит железо в центре порфиринового кольца.
Миоглобин- дыхательный белок сердечной искелетной мускулатуры. Он состоит из единственной полипептиднойцепочки, содержащей 153 аминокислоты и соединенный сгемпростетической группой. Основной функцией миоглобинаявляется транспортировка кислорода через клетку и регуляция егосодержания в мышце для осуществления сложных биохимическихпроцессов, лежащих в основе клеточного дыхания. Миоглобин депонирует кислород во времясокращения мышц, а при их поражении он может попадать в кровь ивыделяться с мочой.
Железосодержащие ферменты и негеминовоежелезоклетки находится главным образом в митохондриях. Наиболее изученными и важными для организма ферментамиявляются цитохромы, каталаза и пероксидаза.
В организме человека содержатся следующие цитохромы:а1, аз, в, в5, с, с1, Р450. Они представляют собой липидные комплексыгемопротеинов и прочно связаны с мембраной митохондрии. Однако,цитохромы в5 и Р450 находятся в эндоплазматическом ретикулюме,а микросомы содержат НАДН- цитохром С - редуктазу. Основной биологическойролью большинства цитохромов является участие в переносеэлектронов, лежащих в основе процессов терминального окисления втканях.
Цитохромоксидазаявляется конечным ферментоммитохондриального транспорта электронов –электронотранспортнойцепочки, ответственным за образование АТФ при окислительномфосфолировании в митохондриях.
Каталаза, как и цитохромоксидаза, состоит из единственной полипептиднойцепочки, соединенной с гем - группой.Она является одним из важнейших ферментов, предохраняющихэритроциты от окислительного гемолиза. Каталаза выполняетдвойную функцию в зависимости от концентрации перекисиводорода в клетке. При высокой концентрации перекиси водородафермент катализирует реакцию ее разложения, а при низкой - и вприсутствии донора водорода (метанол, этанол и др.) становитсяпреобладающей пероксидазная активность каталазы.
Пероксидазасодержится преимущественно в лейкоцитах и слизистой тонкогокишечника у человека. Она такжеобладает защитной ролью, предохраняя клетки от их разрушенияперекисными соединениями.
К железосодержащим относятся и флавопротеиновые ферменты,в которых железо не включено в геминовую группу и необходимо только дляреакций переноса.Наиболее изученной является сукцинатдегидрогеназа,которая наиболее активна в цикле трикарбоновых кислот. Митохондриальныемембраны свободно проницаемы для субстрата фермента.Негеминовое железо, локализующееся главнымобразом в митохондриях клетки, играет существенную роль в дыханииклетки, участвуя в окислительном фосфолировании и транспортеэлектронов при терминальном окислении, в цикле трикарбоновыхкислот.
Ферритин– запасноесоединение железа в клетке, находящееся главным образом вретикулоэндотелиальной системе печени, селезенки и костногомозга. Приблизительно одна треть резервного железа организмачеловека, преимущественно в виде ферритина, падает на долюпечени. Запасы железа могут быть при необходимостимобилизованы для нужд организма и предохраняют его оттоксичного действия свободно циркулирующего железа.
Печень является основнымкомпонентом ретикулоэндотелиальной системы. В концежизнедеятельности эритроциты фагоцитируются макрофагами этойсистемы, а освобождающееся железо или оседает в печени в видеферритина (гемосидерина), или возвращается в плазму крови изахватывается в паренхиматозных клетках печени и мышц, а такжев макрофагах ретикулоэндотелиальной системы печени, селезенки и костного мозга.
Гемосидеринявляется вторым запаснымсоединением железа в клетке и содержит значительно большежелеза, чем ферритин. В отличие от ферритина он нерастворим вводе. Преобразование ферритина в гемосидерин происходит путемпостепенного перенасыщения ферритиновой молекулы железом споследующим ее разрушением и образованием зрелогогемосидерина.
Железо входит в состав многих соединений в организме человека. Его необходимость заключается в том, что это биологически активное вещество входит в состав эритроцитов (красных клеток крови), транспортирует в связанном состоянии кислород к органам и тканям, участвует в метаболизме и энергетическом обмене, регулирует процессы тканевого дыхания, обеспечивает поддержание работы большинства ферментных систем.Дефицит железа в организме приводит к уменьшению синтеза железосодержащих и железозависимых ферментов, участвующих в процессах тканевого дыхания (миоглобина, цитохрома С, цитохромоксидазы, пероксидазы, сукционатдегидрогеназы). Недостаток этих ферментов и гемоглобина вызывает развитие гемической и тканевой гипоксии, следствием которой становятся дистрофические и атрофические процессы в различных тканях и органах, особенно в слизистой оболочке полости рта, желудка.
ENZYMES IN FOOD BIOTECHNOLOGY
Ndimbirwe R. M., 2st year, Mashiku G. B., 2st year, Nemes N. D., 2st year
Supervisor – Associate prof MD PhD E. V. Popova Department of Biochemistry
St. Joseph University in Tanzania,
St. Joseph College of Health Science Dar essalaam Tanzania
Introduction: Food enzymes are mainly used by several food-processing industries to improve flavor, texture, digestibility, and nutritional value . They can be grouped into food processing aid and addictive enzymes in terms of regulation. For food-processing enzymes (>99%) are usedduringfood stuffs preparation, while food additives are used to maintain or improve the freshness, taste, safety, texture, or appearance of food.
Enzymal application in food-processing industries
1) Enzymal application in diary product industries
In dairy products industries enzymes are used to improve the quality of product in terms of flavor, stability, composition, appearance, structure and colour. Also in producing lactose-low or lactose-free products for lactose intolerant people by using β-amylase or lactase, which give out glucose and galactose.
a) Enzymal application in chees making
In chees manufacturing, acid proteases eg.chymosinis used as coagulants. They hydrolyze the peptide bond of casein proteins of milk and lead to curd formation. Furthermore, during ripening, proteinase is added to accelerate hydrolysis of protein, whichhelp to improve texture and flavor of cheese. Lipases also can be added during ripening to improve flavor as it hydrolyses triglycerides, diglycerides, monoglyceridesto free fatty acids.
b) Production of fermented milk
In fermentation of milk, proteinases from proteolytic system of lactic acid bacteria are usedtobreakdownpeptidesinto smaller ones and amino acids. Furthermore, ladle acid bacteria have a proteolytic system that enables them to convert milk casein to free amino acids and peptides Meat processing industries
During meat processing, protease from Aspergillusoryzae and Bacillus subtilis and plant (papain, bromelain, and ficin) are added so breakdown the proteins in muscle and hydrolyze collagen and elastin, which helps in meat tenderization.
Transglutaminaseimprove nutritional values. Furthermore, it improves texture, firmness, elasticity, emulsifies and standardizes meat products such as sausages leading higher quality and more varieties .
3) Application of enzymes in baking industrial
Enzymes in baking industries are added to improve flavor, softness, longer freshness and crunchy cover in bread. Lipoxygenasesis added to whiten flour and provides viscoelastic properties in the dough. While, α-amylase, laccase, xylanase, protease and lipases improve elasticity and quality of dough by forming similar and fine structure. In addition, they provide colour, crumb, softness, freshness, shelf life, and decrease off-flavour of the final product. Sulfhydryl proteases improve elasticity and firmness of dough as well as gas retention and thermoset properties of baking products. Furthermore, pentosanasesare added to improve quality of bakery products as it hydrolyses pentosans. Also it may be used to breakdown long cellulose in high-fiber bakery products so as to improvetheir eating quality.
4) Application of enzymes inWine production
In wine production enzymes are aimed at improving its quality and stability, easy must clarification and filtration and for better skin maceration and improvement of colour. These objectives were achieved by the use of pectinases, b-glucanases and hemicellulases enzymes. Pectinase improves juice extraction, reduces the clarification time and it minimize the methanol released during wine production. ATrichodermab-glucanase hydrolyses b-glucan and glucans from yeast, which causes severe problems during wine filtration and clarification of wine. In additional to three enzymes b-glucosidase is used to improve the aroma of wines by modifying naturally present glycosylated precursor.
5) Application of enzymes in Beer brewing
Enzymes used in beer brewing industries includes microbial b- glucanasescommonly from Penicilliumemersonii, Aspergillusniger, Bacillus subtilis and Trichodermareeseiwichare used to hydrolyse b-glucan and reduce the viscosity of the wort added either during mashing or primary fermentation.
6) Extraction and clarification of fruit and vegetable juices
In this field,enzymes are used in extraction, clarificationand stabilization of fruit and vegetable juices. The enzymes used include the combination of pectinases, cellulases and hemicellulases-collectively called macerating enzymes, which are used in extraction and clarification of fruit and vegetable juices. Furthermore, theycatalyze breaking down of heteropolysaccharides like cellulose and pectine into simple sugar hence increases yield and processing performance.
Laccasesare added to decrease juice off- flavours while undesirable colours and flavours in juice are removed by peroxidase. Transglutaminases helps to maintain shelf life and freshness for more time as they facilitate formation of protein films that act as a barrier on fruits and vegetables. Bitterness in citric juice is antioxidant properties .
7) Enzymal application in Extraction of olive oil
Extraction of high quality oil is achieved by the use of macerating enzymes as they increase extraction under cold processing, better centrifugal fractionation of the oily muss and overall improvement in plant efficiency. Furthermore, they increase anti-oxidant and vitamin E in extra-virgin olive oil and reduce the induction of rancidity and low oil content in the wastewater.
8) Animal feed biotechnology
Cellulases and hemicellulases are mainly used inproduction of both monogastric and ruminant feed.
a) Role of cellulases and hemicellulases in monogastric feed
In monogastric feed hydrolase enzymes are added so as to remove anti- nutritional factors presented in grains or vegetables, to breakdown cereal components so as to improve its nutritional value, or to supplement animals’ own digestive enzymes (e.g. proteases, amylases and glucanases) and whenever they inadequate during post-weaning periode.g. in broilers and piglets.
B-Glucanases, xylanases are added so as to hydrolyse non-starchy polysaccharides, in additional with rabinoxylans they improves digestion and absorptionand a result they enhance weight gain, prevent poor feed conversion rate and sticky droppings by young animals e.g. chicks.
b) Role of cellulases and hemicellulases in ruminant feed
Cellulase and hemicellulose are added to improve nutritive quality, the feed utilization, milk yield, body weight gain by ruminants.
9) Production of nutritive Sweeteners
Amylases (Bacillus licheniformis and B. stearothermophillus) play a major role in production of nutritive sweeteners as they hydrolyseamilium into water-soluble product with low molecular weight such as glucose, fructose, which can be used to manufacture of high fructose syrup. In addition, it is used in manufacturingof high fructose corn syrup (nutritive sweetener).
Conclusion:The application of enzymes in food production lead to improvement in food quality and makes nutrients to readily available for consumers.
ПРИМЕНЕНИЕ ПРЕПАРАТОВ НА ОСНОВЕ ГИАЛУРОНИДАЗЫ В ЛЕЧЕНИИ РУБЦОВ И РУБЦОВЫХ ПОРАЖЕНИЙ КОЖИ
А.Р. Никогосян, С.С. Тейхриб, 3 курс
Научный руководитель – к.м.н., доц. С . В . Сердюк
Кафедра фармакологии
Оренбургский государственный медицинский университет
APPLICATION OF PREPARATIONS ON THE BASIS OF HYALURONIDASE IN THE TREATMENT OF SCARS AND CICATRICIAL SKIN LESIONS
A.R. Nikogosyan, S. S. Teichrib, 3 course
Supervisor – Candidate of Sciences in Medicine, Assistant Professor S. V. Serdyuk
Department of pharmacology
The Orenburgstatemedicaluniversity
Аннотация.Вопросы появления келоидных и гипертрофических рубцов на месте операционного шва являются одной из сложных проблем современной медицины, интересующей специалистов многих профилей – дерматологов, косметологов, иммунологов, пластических хирургов. Опубликовано значительное число статей по ведению больных с патологическими рубцами, но пока отсутствует единый подход к терапии данного заболевания. В качестве фармакологических корректоров применяют лекарственные препараты: протеолитические ферменты, кортикотропные гормоны, лекарственные формы на основе силикона и др.
Ключевые слова: рубец, рубцовое поражение, гиалуронидаза, «Лонгидаза».
Annotation.The emergence of keloid and hypertrophic scars at the site of the surgical suture is one of the difficult problems of modern medicine, which is of interest to many specialists - dermatologists, cosmetologists, immunologists, plastic surgeons. A significant number of articles on the management of patients with pathological scars have been published, but so far there is no unified approach to the treatment of this disease. Medicines are used as pharmacological correctors: proteolytic enzymes, corticotropic hormones, silicone-based dosage forms, etc.
Key words: scar, cicatricial injury, hyaluronidase, "Longidase".
Актуальность проблемы рубцов как косметического недостатка подтверждается значительным количеством пациентов, обращающихся в различные косметологические учреждения.
Появление патологических рубцов после хирургических операций – достаточно частая проблема современной медицины. Согласно статистике аналитического отдела ВОЗ, ежегодно во всем мире оперативным вмешательствам разного уровня сложности подвергается более 100 млн человек, из которых от 4 до 10 % склонны к образованию келоидных и гипертрофических рубцов. Такая высокая цифра заболеваемости обусловлена тем, что заранее предсказать возникновение патологических рубцов у конкретного пациента невозможно в связи с недостаточным пониманием причин и механизмов развития данного рода осложнений. При этом доказано, что повышенную склонность к образованию келоидов имеют анатомические области тела с замедленным протеканием репаративных процессов, а также с высоким натяжением кожи такие как: передняя стенка грудной клетки, молочные железы, мочки уха, углы нижней челюсти, лопатки, локти, коленки.Также к формированию гипертрофических рубцов предрасполагают следующие факторы: большие размеры раневого дефекта и постоянная травматизация, особенно если рубцы расположены параллельно направлению сокращения мышц. Подобные кожные дефекты могут привести не только к изменению психоэмоционального статуса реконвалесцента, в том числе снижению уровня его самооценки и психической адаптации, но и к нарушению функций опорно-двигательного аппарата: сгибательно-разгибательным контрактурам, а также деформации пальцев, стоп и кистей.
Стоит отметить, что на данном этапе развития медицины недостаточно эффективных методов профилактики появления патологических рубцов. Современные стратегии коррекции этого заболевания строятся на рациональном сочетании оперативных и консервативных вмешательств. Широкую популярность приобрели физические и физиотерапевтические методы (использование окклюзивных повязок, компрессионной и лазерной терапии, криохирургии, электрофореза и т.д.), лучевая терапия с целью предотвращения рецидива, а также косметические процедуры, направленные на внешнюю коррекцию дефекта и не несущие какой-либо терапевтической цели (пилинг, мезотерапия, дермабразия). Учитывая тот факт, что хирургическое лечение келоидных рубцов (наиболее сложного варианта развития патологического рубцевания) в 50–100 % случаев приводит к еще более тяжелым рецидивам, особую роль приобретают методы их фармакологической коррекции. Современный арсенал лекарственных средств, которые используются в терапии патологических рубцов, представлен препаратами различных фармакологических групп, воздействующих на конкретные звенья патогенеза рубцовой ткани. Так, основой терапии на данный момент остается внутрирубцовое введение кортикостероидов, тормозящих синтез медиаторов воспаления и пролиферацию фибробластов, что, в свою очередь, уменьшает образование глюкозаминогликанов и коллагена в процессе заживления ран. Для лечения патологических рубцов кожи в настоящее время также активно применяются ферментные препараты (коллагеназы и гиалуронидазы), обеспечивающие гидролиз коллагена и гликозаминогликанов в рубцовоизмененных тканях с последующим восстановлением нормального состава и структуры внеклеточного матрикса. Классическим средством вот уже многие годы остаются препараты протеолитического фермента гиалуронидазы: «Лидаза» и «Ронидаза». Гиалуронидаза расщепляет основной компонент межуточного вещества соединительной ткани — гиалуроновую кислоту, являющуюся цементирующим веществом соединительной ткани, и, таким образом, повышает тканевую и сосудистую проницаемость, облегчает движение жидкостей в межтканевых пространствах; уменьшает отечность ткани, размягчает и уплощает рубцы, предупреждает их формирование. На сегодняшний день созданы принципиально новые ферментные препараты: «Лонгидаза» (сочетает в себе ферментативную активность гиалуронидазы с иммуномодулирующими, антиоксидантными и умеренными противовоспалительными свойствами полиоксидония), его назначают при генетической предрасположенности или отягощенном анамнезе с 14-го дня травмы, а также при глубоких поражениях в составе комплексной терапии. Эффективное лечебное и профилактичесое действие оказывает препарат Лонгидаза 3000 МЕ, представляющий собой конъюгат протеолитического фермента гиалуронидазы с высокомолекулярным носителем из группы производных ISSN 1818-460X. Препарат обладает высокой гиалуронидазной (хелатирующей, антиоксидантной, противовоспалительной и иммуномодулирующей) активностью. Клинический эффект конъюгированного препарата значительно выше, чем нативнойгиалуронидазы, так как отмечается его высокая устойчивость к действию ингибиторов, что увеличивает его активность и обеспечивает пролонгированное действие. Коньюгатгиалуронидазы входит в состав крема Имофераза, который может применяться как в последовательной схеме (после основного курса), так и в виде монотерапии при «свежих» рубцах. Также используют «Ферменкол», который содержит в своем составе 9 коллагенолитических протеаз, осуществляющих редукцию избыточного внеклеточного матрикса в рубцовой ткани.
Таким образом, перечисленные свойства препаратов на основегиалуронидазысвидетельствуют о перспективах ихприменения и необходимости дальнейших исследований.
РОЛЬ СЕЛЕНА В ЖИЗНЕДЕЯТЕЛЬНОСТИ ОРГАНИЗМА
Л.И. Сайфуллина, А.А.Швецова 2 курс
Научный руководитель - к. б. н.. доц. М.М. Павлова
Кафедра биологической химии
Оренбургский государственный медицинский университет
THE ROLE OF SELENIUM IN THE VITAL ACTIVITY OF THE ORGANISM
L.I. Sayfullina, A.A.Shvetsova 2 course
Supervisor -Candidate of Biological Sciences, Assistant Professor M.M. Pavlova
Department of Biological Chemistry
The Orenburg State Medical University
Аннотация. В статье рассматривается влияние селена на жизнедеятельность организма в виде ферментных систем: глутатионпероксидазы, тиоредуксинредуктазы, йодтирониндейодиназы, селенопротеина P и W, которые активно участвуют в обменных процессах организма человека.
Ключевые слова: Селен, микроэлемент, активный центр, ферментные системы, глутатионпероксидаза, тиоредуксинредуктаза, йодтирониндейодиназа, сленпротеин P и W, антиоксидант, обменные процессы.
Annotation.The article discusses the effect of selenium on the vital activity of the body in the form of enzyme systems: glutathione peroxidase, thioreduxine reductase, iodotyronine neiodinase, selenoprotein P and W, which are actively involved in the metabolic processes of the human body.
Key words: Selenium, microelement, active center, enzyme systems, glutathione peroxidase, thioreduxinreductase, iodothyronineneudinase, slenprotein P and W, antioxidant, metabolic processes.
Актуальность. Селен (Se), 34-й элемент Периодической системы, является жизненно необходимым фактором для нормальных процессов жизнедеятельности. Элемент открыт в 1817 И. Берцелиусом (название дано от греч. selene — Луна). Недостаточность поступления приводит к нарушениям обменных процессов организма, норма которых составляет 70 мкг/сут для мужчин, 55 мкг/сут для женщин.
Задача.Обобщение литературных данных о роли селена в организме.
Цель. Дать оценку биологическим соединениям, включающим этот элемент в свой состав.
Введение. Из литературных источников известно, что селен, входит в состав активных центров многих ферментных систем: глутатионпероксидазы, тиоредуксинредуктазы, йодтирониндейодиназы, селенпротеина Р и W.
Первым открытым селенспецифическим ферментом является глутатионпероксидаза (GPX) эритроцитов (1957 год Д. Миллс). Наиболее высокая активность фермента в тканях печени, почках, эритроцитах. Фермент имеет две активные формы: селензависимые (утилизирует перекись водорода и органические гидроперекиси) и селеннезависимые. Селензависимая утилизирует в качестве субстратов перекись водорода и органические гидроперекиси, контролирует поддержание стационарной концентрации Н2О2в различных типах клеток.
В состав активного центратиоредуксинредуктазы, наряду сселеноцистеином, входит простетическая группа ФАД. Биологическая функция этого фермента заключается в синтезе дезоксирибонуклеотидовиз рибонуклеотидоввместе со вторым ферментом –рибонуклеотидредуктазой.Тиоредуксинредуктаза способна проявлять свойства дегидроаскорбатредуктазы, участвующей в регенерации активной формы витамина С.
Семейство селеносодержащихферментов представлено тремя типами йодтирониндейодиназ (D1, D2, D3). Ферменты были открыты в 80-е годы 20 века. Йодтиронин -5'- дийодиназа активирует процесс образования Т₃ из Т₄, они обладают тканевой и органной специфичностью.
Селенопротеин P открытый в 1977 году, участвует в транспортировке селена в разные ткани, главным образом в ткани головного мозга. Биологической функцией этих белков является защита организма от воздействия перекисей, и выступает в роли агента, способствующего нейтрализации токсического действия тяжелых металлов (Pb, Hg). Белок селенпротеин W, связываясь с восстановленным глутатионом, обладает функцией антиоксиданта на тканевом уровне в мышцах.
Токсичной дозой селена для человека считается 5 мг/сут. Высокие концентрации селена ингибируют ферменты, нарушают синтез метионина и рост опорно-покровных тканей, вызывают анемию.
Выводы. Селен представляет собой физиологически важный микроэлемент, незаменимый в питании человека, основной биологической ролью которого является участие в синтезе и активности селенсодержащих ферментов.
СИНТЕЗ ДОФАМИНА И КАТЕХОЛАМИНОВ И СВЯЗАННЫЕ С ЭТИМ НАРУШЕНИЯ
К.А. Самойленко, 2 курс
Научный руководитель – к.б.н., доц. И.В. Карнаухова
Кафедра биологической химии
Оренбургский государственный медицинский университет
SYNTHESIS OF DOPAMINE AND CATECHOLAMINES AND RELATED DISORDERS WITH IT
K.A. Samoylenko, 2 course
Supervisor –Candidate of Biological Sciences, Assistant Professor I.V. Karnaukhova
Department of Biological Chemistry
The Orenburg State Medical University
Аннотация .В данной статье рассмотрен синтез дофамина и катехоламинов, а также проанализированы болезни к которым приводят нарушения в синтезе этих веществ. Выявлено и обосновано чем именно продуцируются катехоламины и какие ферменты необходимы для синтеза дофамина. Показано, что отклонение показателей катехоламинов от нормы вызывает нервно-психические заболевания. На основе проведенного исследования автором предлагаются способы восстановления запасов катехоламинов.
Ключевые слова: катехоламины, дофамин, синтез, нарушение синтеза, синдром Паркинсона.
Annotation. This article discusses the synthesis of dopamine and catecholamines, as well as the diseases that are impaired in the synthesis of these substances are analyzed. It is revealed and justified what exactly catecholamines are produced and what enzymes are necessary for the synthesis of dopamine. It was shown that deviation of catecholamine indices from the norm causes neuropsychic diseases. Based on the study, the author suggests ways to restore catecholamine reserves.
Keywords:catecholamines, dopamine, synthesis, impaired synthesis, Parkinson's syndrome.
Актуальность.Катехоламины- этофизиологическиактивныевещества, которыеявляютсямедиаторамиигормонами. Все высшие формы поведения человека связаны с жизнедеятельностью нервных клеток, синтезирующих катехоламины. Нейроны используют катехоламины в качестве нейромедиаторов, осуществляющих передачу нервного импульса.Нарушение синтеза катехоламинов может вызывать различные нервно-психические заболевания, причём патологические отклонения наблюдаются как при снижении, так и при увеличении их количества.
Цель и задачи.Рассмотреть синтез дофамина и катехоламинов, нарушение синтеза и соответствующие заболевания.
Материалы и методы. Анализ научной литературы по проблеме исследования.
Результаты.Основные гормоноидные катехоламины в значительной степени продуцируются хромаффинной тканью животного организма. Из хромаффинных клеток состоят мозговой слой надпочечников, параганглии, расположенные возле симпатических узлов, и цепочки особых образований около брюшной аорты и в районе отхождения от нее нижней брыжеечной артерии.Мозговой слой надпочечников продуцирует соединение далекой от стероидов структуры. Они содержат 3,4-диоксифенильное ядро и называются катехоламинами. К ним относятся адреналин, норадреналин и дофамин бета-окситирамин.
Последовательность синтеза катехоламинов достаточно проста: тирозин → диоксифенилаланин (ДОФА) → дофамин → норадреналин → адреналин. Тирозин поступает в организм с пищей, но может и образовываться из фенилаланина в печени под действием фенилаланингидроксилазы. Конечные продукты превращения тирозина в тканях различны. В мозговом слое надпочечников процесс протекает до стадии образования адреналина, в окончаниях симпатических нервов - норадреналина, в некоторых нейронах центральной нервной системы синтез катехоламинов завершается образованием дофамина.
Превращение ДОФА в дофамин катализируется ферментом ДОФА-декарбоксилазой, который относительно неспецифичен и декарбоксилирует и другие ароматические L-аминокислоты. В некоторых нейронах отсутствуют ферменты дальнейшего превращения дофамина, и именно он является конечным продуктом.
Нарушение синтеза катехоламинов может вызывать различные нервно-психические заболевания, причём патологические отклонения наблюдаются как при снижении, так и при увеличении их количества.
Рассмотрим нарушения синтеза дофамина. При его недостаточном синтезе происходит нарушение двигательной функции — синдром Паркинсона. Так как снижена активность тирозингидроксилазы, ДОФА-декарбоксилазы. Депрессивные состояния часто связаны со снижением в нервных клетках содержания дофамина и норадреналина.
Резкое повышение экскреции дофамина и его метаболитов с мочой наблюдается при гормонально-активных опухолях. Также при гиповитаминозе витамина В6 в тканях головного мозга увеличивается содержание дофамина, появляются его метаболиты, которые отсутствуют в норме.Гиперсекреция дофамина в височной доле мозга наблюдается при шизофрении.
Вывод.От активности синтеза и выделения катехоламинов зависят такие сложные процессы, как запоминание и воспроизведение информации, сексуальное поведение, агрессивность и поисковая реакция, уровень настроения и активность в жизненной борьбе, скорость мышления, эмоциональность, уровень общего энергетического потенциала и т.д. Соответственно, если нарушен их синтез, все контролируемые ими процессы подвергнуться изменениям. Есть несколько способов восстановления резервов катехоламинов в нервных клетках:
• Введение малых доз катехоламинов;
• Введение в организм предшественников катехоламинов;
• Препараты, усиливающие синтез катехоламинов в ЦНС;
• Ноотропные средства;
• Адаптогены.
ПАПАИН И ДРУГИЕ СУЛЬФГИДРИЛЬНЫЕ ПРОТЕОЛИТИЧЕСКИЕ ФЕРМЕНТЫ
И.А. Столяр, 4 курс, А.Е. Меркулова, А.Б. Бердбеков, 2 курс
Научный руководитель – к.б.н., доц. И.В. Карнаухова
Кафедра биологической химии
Оренбургский государственный медицинский университет
PAPAINANDOTHERSULFHIDRILPROTEOLETICENZYMES
I.A. Stolyar, 4 course, A.E. Merkulova, A.B. Berdbekov, 2 course
Supervisor –Candidate of Biological Sciences, Assistant Professor I.V. Karnaukhova
Department of Biological Chemistry
The Orenburg State Medical University
В настоящее время в современной медицине активно используют биологически активные вещества растительного происхождения. Однако, огромное количество продуктов растительного происхождения обладают выраженным протеолитическим действием. Например, папайя, киви, ананас. Очень многие фрукты обладают этим свойством.
Ключевые слова: папайя, протеолитические ферменты, расщепление, биохимические реакции.
Currently, biologically active substances of plant origin are actively used in modern medicine. However, a huge number of products of plant origin have a pronounced protolithic route. For example, papaya, kiwi, pineapple. A lot of fruits have this their
Key words: papaya, protolithic enzymes, cleavage, biochemical reactions.
Плоды экзотической папайи содержат латекс, который имеет в своем составе несколько ферментов. Она содержит два основных протеолитических фермента – папаин и химопапаин. Оба фермента относятся к группе протеолитических растительных ферментов, которым для активности требуется сульфгидрильная группа.
Папаин – является простым белком, содержащим аминокислоты и лишенный углеводов. В нем присутствуют все основные аминокислоты, кроме метионина. В структуре папаина не присутствуют хромофорные группы, кроме включающих в его состав аминокислот. Больше всего в нем присутствуют тирозина и триптофана. Молекула папаина состоит из одной свернутой полипептидной цепи из 212 остатков. Определение последовательности этих остатков является примером взаимного взаимодействия чисто химических и рентгеновских методов. Из-за многих трудностей, которые папаин представлял химикам, только предварительная последовательность смогла быть опубликована в 1964 году.
Механизм действия папаина очень схож с фицином, химопапаином и бромелаином. Данные ферменты содержат тиольные группы, которые определяют активность этих веществ и активируются соединениями SH и цианидом, инактивируются мягкими окислителями.
Папаин может катализировать ряд реакций, а именно: промежуточный ацил-фермент, гидролиз, трансферазное действие и специфичность.Протеолитический фермент папаин, расщепляет пептидные связи в белках и обладает болеутоляющим эффектом. Эту особенность используют в Аюрведе для симптоматического лечения спондилоартрозов и радикулитов.
При употреблении папайи в пищу возможно возмещение её ферментами недостаточности собственных протеолитических ферментов, которые помогают нормально расщеплять белки, жиры и углеводы. Ферменты папайи расщепляют белки даже в условиях нейтральной среды, поэтому папайю советуют использовать для улучшения переваривания тяжелой пищи, особенно при пониженной кислотности желудка и ферментативной недостаточности поджелудочной железы. Папайя стимулирует синтез желчных кислот, препятствуя камнеобразованию и застою в желчевыводящей системе печени. Она активизирует работу ферментов цитохром 450, отвечающих за нейтрализацию токсинов, проникающих в организм или образующихся в нем.
Медики выявили и используют уникальные свойства папайи в лечении онкологических заболеваний, так как она содержит алкалоид, способный подавлять жизнедеятельность и размножение злокачественных клеток. Поскольку папайя сейчас широко культивируется в Юго-Восточной Азии, современная Аюрведа использует ее для лечения амебиаза, дисбактериоза и при глистных инвазиях. Папайя подавляет жизнедеятельность аскарид, лямблий, нематод и целого ряда других паразитов распространенных также на территории Европы и Сибири.
Фицин - это растительный фермент класса гидролаз, катализирующий гидролиз пептидов, амидов и сложных эфиров. Извлекается из растений рода Ficus, латекс которых проявляет протеолитическую активность.
Фицин относится к группе папаиназ и содержит в своей молекуле, по крайней мере, две сульфгидрильные группы, из которых только одна находится в каталитическом участке фермента. Кроме того, фицин содержит одну дисульфидную группу, которая не является существенной для его активности. По своему действию на белки фицин напоминает пепсин, так как катализируемое им расщепление белков доводится только до стадии полипептидов, имеющих отношение аминного азота к общему 25%.
Фицин осаждается спиртом, ацетоном и (NH4)2SO4 при 50% насыщения и частично адсорбируется на Аl(ОН)3. Температурный оптимум действия фицина находится при 63° С. Полная инактивация наблюдается в процессе нагревания при 75° С в течение 1 ч или при 80—85° С в течение 30 мин.
Указанное соединение имеет индустриальное применение, аналогичное папаину. Отмечается способность фицина воздействовать на белковые компоненты как мышечной, так и соединительной тканей, что делает приготовленные из него препараты высокоценными для улучшения качества мяса.
Бромелаин - протеолитическийфермент, имеющийся у растений семейства бромелиевых, в частности ананаса. Присутствует во всех органах ананаса, но стебель является наиболее распространенным источником. Коммерческие препараты бромелаина гетерогенны и содержат по крайней мере четыре различные цистеиновые протеазы, очищенные методом аффинной хроматографии. Выделенная из сока стеблей ананаса протеаза называется бромелаином из стеблей (stembromelain), а фермент, полученный из плодов, — бромелаином из плодов ананаса (fruitbromelain).
Бромелаин обладает противовоспалительным действием, ускоряет процессы репарации тканей в результате деполимеризации межклеточных структур и модификации проницаемости сосудов. Противовоспалительное и антиагрегантное действия бромелаина обусловлены его способностью изменять метаболизм арахидоновой кислоты.
Получение пищевых ферментов из растительного сырья является одним из интенсивно развивающихся направлений в биотехнологии. В пищевой промышленности для тендеризации (размягчения) мясных продуктов используют протеиназы растительного происхождения: папаин (из плодов папайи), бромелаин (из стеблей, плодов ананаса), фицин (из фигового дерева). Также отмечено, что папаин улучшает переваривания тяжелой пищи, особенно при пониженной кислотности желудка и ферментативной недостаточности поджелудочной железы, афициниспользуется в фармацевтической промышленности в качестве добавки к зубным пастам для удаления зубного налета.
ZINC DEPENDENT ENZYMES
D. S.Fomenko, M.V. Shamakina,, 2 course
Supervisor – Ass. E.I. Glushihina
Department of Biochemistry
The Orenburg State Medical University
Аннотация. В данной статье рассматривается роль цинка в энзимологии организма. Представленыферменты, всоставкоторыхвходит цинк или является их активатором или ингибитором.
Ключевые слова:цинк, цинкзависимые ферменты, эссенциаальный микроэлемент, алкогольдегидрогеназа, карбонатдегидратаза, автофосфорилирование.
Abstract. This article discusses the role of zinc in the enzymology of the organism. Presents enzymes, which include zinc or is their activator or inhibitor.
Keywords: zinc, zinc-dependent enzymes, essential trace element, alcohol dehydrogenase, carbonate dehydratase, autotransferase.
Цинк является одним из основных эссенциальных микроэлементов в организме человека и вторым элементом по распространенности после железа.
Биологическая роль цинка была установлена около 150 лет назад благодаря изучениям Е.Ундервуда (1971) недостатка цинка на животных.
Состояния человека, вызванные недостатком цинка, были впервые распознаны как синдром гипогонадизма и карликовости у молодых иранцев – болезнь Прасада (А.С. Прасад, 1961).
В сутки организм взрослого здорового человека должен получать от 9 до 11 мг цинка, дети – чуть меньше, от 2 до 8 мг, в период беременности и кормления грудью потребность в Znвозрастает – от 11 до 13 мг.
В настоящее время цинк обнаружен во всех тканях и органах, однако его количество находится в широких пределах: от 0,15 до 3,3 ммоль на 1 кг сырой ткани (Р.И. Хэнкин, 1971). Скелетные мышцы наиболее богаты цинком, на их долю приходится 63% от всего количества этого микроэлемента (Г.А. Шрэдер, 1967).
По последним данным цинк является компонентом более чем 2700 ферментов в организме, включая гидролазы, трансферазы, оксидоредуктазы, лигазы, изомеразы и лиазы.
В качестве примера можно привести фермент алькогольдегидрогеназу, которая участвует в окислении спиртов (Рис.1).

Рис.1. Алкогольдегидрогеназа
Большое значение имеет карбонатдегидратаза (карбонатдегидратаза, карбонатгидролиаза). Этот фермент участвует в процессах безопасной транспортировки углекислого газа в организме. Благодаря наличию этого фермента в эритроцитах происходит быстрая утилизация углекислого газа (Рис.2).
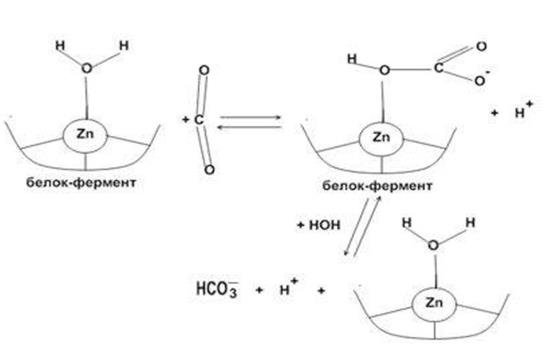
Рис.2. Карбоангидраза (электрофильная атака)
Цинк входит также в состав различных фосфатаз, дегидрогеназ и участвует таким образом в процессах клеточного дыхания. Его присутствие в таких ферментах, как протеиназы и пептидазы, обуславливает влияние элемента на синтез РНК, ДНК, метаболизм белковых веществ. Также он необходим для всех процессов, связанных с усиленным клеточным делением (рост, заживление ран, сперматогенез), активно участвует в метаболизме нуклеиновых кислот и синтезе белков: входит в состав ДНК- и РНК-полимеразы, тимидинкиназы – фермента, катализирующего синтез ТМФ из АТФ, оказывает ингибирующее действие на рибонуклеазу, НАДФ-оксидазу, снижает активность АТФ-азы в макрофагах, индуцирует биохимические реакции, действуя сам как фермент, расщепляя фосфодиэстеразные мостики РНК, стабилизируя структуру ДНК. Он необходим для всех фаз клеточного цикла. Микроэлементу цинку отводят важную роль в структуре и функции биомембран. Он обладает стабилизирующим действием на мембраны эритроцитов, снижает их хрупкость, уменьшая оксидантные повреждения эритроцитов.
Кроме того цинк играет важную роль в работе инсулина, т.к. биосинтез и его хранение регулируется ионами цинка и кальция.
Также цинк оказывает влияние на иммунную систему и включает вирус-рецепторные взаимодействия, активацию разных видов лимфоцитов, уменьшение апоптоза и корректировку секреции цитокинов.
Сражение иммунной системы с вирусными инфекциями требует иммунокомпетентных активных Т-лимфоцитов, число и активность которых в значительной степени зависит от уровня цинка. Среди иммунных клеток страдающих от недостатка цинка, Т-лимфоциты имеют наиболее высокую чувствительность. На молекулярном уровне цинк стимулирует автофосфорилирование белка тирозинкиназыLck через взаимодействия с цитоплазматическими петлями CD4 и CD8, что приводит к активации Т-клеток, которые затем атакуют вирусные частицы.
Роль цинка в организме неоценима. Недостаток данного микроэлемента ведет к ферментативной недостаточности, что вызывает нарушение ферментативных процессов. Важнейшим метаболическимнарушением вследствие недостатка цинка и соответственно цинкосодержащих энзимов, является нарушение обмена белков и нуклеиновых кислот, что приводит к быстрой гибели организма.
ТЕЛОМЕРНАЯ ТЕОРИЯ СТАРЕНИЯ
Е.В. Хайбулина, 2 курс
Научный руководитель - асс . Н.В.Зобкова
Кафедра биологической химии
Оренбургский государственный медицинский университет
TELOMER THEORY OF AGING
E.V.Haibulina,2 course
Scientific advisor – Ass. N.V.Zobkova
Department of Biochemistry
The Orenburg State Medical University
Старение есть одно из основных свойств всех живых организмов. При всей спорности вопроса о сущности этого процесса в конечном итоге он проявляется определенными изменениями функциональных способностей как отдельных клеток, так и организма в целом. Остается вопрос, обусловлены ли возникающие в отдельных клетках и органах изменения старением самих клеток и органов, или же они являются следствием общего процесса старения всего организма.
Ключевые слова:теломеры,теломераза, теломерная теория старение, репликация
Aging is one of the basic properties of all living organisms. With all the controversial issues about the nature of this process, in the end, it is manifested by certain changes in the functional abilities of both individual cells and the organism as a whole. The question remains whether the aging of the cells and organs themselves causes the changes occurring in individual cells and organs, or they are a consequence of the general aging process of the whole organism.
Key words:telomeres, telomerase, telomer theory of aging, replication
Механизмы старения организма являются многообразными и сложными для понимания. На данный момент существует множествопротивоположных теорий, которые отчасти оспаривают друг другу, а отчасти – дополняют. Проблема старения находится под бдительным вниманием современной биологии, появляются новые факты, позволяющие понять различные аспекты старения глубже.
Одну из теорий представил выдающийся российский ученый Алексей Оловников в 1971 г. В 1961 году американский геронтолог Л. Хейфлик установил, что «в пробирке» клетки кожи – фибробласты – могут делиться не более 50 раз. В 1971 г. научный сотрудник Института биохимической физики РАН А.М. Оловников предложил гипотезу, по которой «предел Хейфлика» объясняется тем, что при каждом клеточном делении укорачиваются теломеры – концевые участки хромосом. Поэтому после некоторого количества делений клетка больше делиться не может. А. Оловников сформулировал проблему концевой недорепликации линейных молекул ДНК, поскольку ДНК-полимераза не может реплицировать несколько нуклеотидов на 3'-конце матрицы ДНК. Он же высказал мысль о том, что должен существовать особый биологический механизм, предотвращающий этот эффект.
Открытие в 1985 г. фермента теломеразы, достраивающего укороченные теломеры в половых клетках и клетках опухолей, обеспечивая их бессмертие, стало блестящим подтверждением теории Оловникова. Правда, предел в 50-60 делений справедлив далеко не для всех клеток: раковые и стволовые клетки теоретически могут делиться бесконечно долго даже в культуре, в живом организме стволовые клетки могут делиться не десятки, а тысячи раз, но связь старения клеток с укорочением теломер является общепризнанной.
Теломеры обязательны для начала репликации (удвоения) ДНК: к ним прикрепляется РНК-затравка, с которой на каждой из нитей двойной спирали ДНК начинается синтез второй нити, комплементарной первой. После каждого деления клетки часть концевых нуклеотидов на каждой из вновь образованных хромосом безвозвратно теряется вместе с РНК-затравкой. Когда рано или поздно хромосома израсходует все нуклеотиды своих теломер, клетка не сможет делиться и через некоторое время погибает.
Предложено несколько гипотетических моделей, объясняющих, каким образом клетка «определяет» длину своих теломер и в определенный момент запускает механизм блока пролиферации. Возможно, определяется общее количество ТТАGGG повторов благодаря учету специфически связывающегося с ними белка. Другая модель исходит из того, что длинные теломеры молодых клеток представляют собой гетерохроматиновые блоки. Предполагается, что ген, супрессирующий программу клеточного старения, локализован в субтеломерном районе. По мере укорачивания теломер всё больше субтеломерной ДНК подвергается гетерохроматинизации. Гетерохроматинизация гена-супрессора приводит к его инактивации и запуску механизма клеточного старения. Обнаружено, что в соматических клетках, делящихся в организме, длина теломер со временем уменьшается. Укорочение теломер наблюдается также по мере старения фибробластов в культуре. Более того, оказалось, что длина теломер лучше предсказывает способность клетки к делению, чем возраст донора клеток. Предположительно, теломеры укорачиваются в результате того, что механизм, ответственный за удвоение ДНК в процессе клеточногоделения, делает характерную ошибку: в каждой новой копии ДНК элиминируется маленький участок каждой теломеры. Из этого следует, что теломеры могут быть теми часами, которые определяют в клетках потерю способности к пролиферации. Интересно, что длина теломер сохраняется или даже немного увеличивается в сперматозоидах и в трансформированных («бессмертных») клетках. Такое постоянство помогает объяснить, каким образом половые и злокачественные клетки не утрачивают способности к делению.
Серьезным подтверждением основополагающей роли укорочения теломер в старении человека служат исследования клеток людей, страдающих прогериями – очень редкими болезнями преждевременного старения. Здесь четко прослеживается корреляция между старением на молекулярном, клеточном и организменном уровнях. Известны всего несколько подобных заболеваний истинного преждевременного старения: синдром Хатчинсона-Гилфорда, синдром Вернера и атаксия-телеангиэктазия, иначе называемая синдромом Луи-Бар. Патогенез всех этих болезней разный, но во всех случаях теломеры в клетках таких больных оказались от рождения, либо в первые годы жизни, резко укороченными (в разной степени при разных формах прогерий), лимит Хейфлика – существенно ограниченным, и фенотипические проявления старения – атеросклеротические изменения сердца и сосудов, возрастные изменения в других органах, истончение и морщинистость кожи, пресбиопия, поседение и потеря волос и другие симптомы старения – развиваются у таких больных значительно раньше, чем у лиц, стареющих с нормальной скоростью. Таким образом, причинная связь естественного старения организмов с репликативным старением клеток в подобных случаях сомнений не вызывает.
Данные о механизмах ускоренного старения при прогериях представляются очень существенными для понимания механизмов естественного старения человека.
ЭНЗИМОДИАГНОСТИКА
Оценка уровня активности аминотраНСфераз в крови детей, рожденных путем кесарева сечения
А.А. Абдурахманов, 4 курс
Научный руководитель –асс. А.И. Онощенко
Кафедра оперативной хирургии и топографической анатомии
Гродненский государственный медицинский университет, Беларусь
ASSESSMENT OF THE LEVEL OF ACTIVITY OF AMINOTRASPFERASES IN THE BLOOD OF CHILDREN BORN BY THE CAESARIAN SECTION
A. А . Abdurakhmanov, 4 course
Supervisor - Ass. A.I. Onoshchenko
Department of Operative Surgery and Topographic Anatomy
TheGrodno State Medical University, Belarus
Несмотря на широкое распространение, кесарево сечение относят к разряду сложных операций с высокой частотой осложнений
Аннотация. Оценить уровень активности АлАТ и АсАТ в крови детей, рожденных путем кесарева сечения как одного из метаболических показателей постнатальной адаптации.
Методы. проведено ретроспективное сравнительное исследование. Обследовали детей, рожденных путем кесарева сечения (n = 103). Комплексное обследование включало оценку ряда показателей: клинического, биохимического анализа крови.
Результаты. Среднее значение исследуемых показателей: АлАТ — 15,75±9,30; АсАт — 43,2±24,22. У 12% детей после кесарева сечения в раннем периоде адаптации отмечен повышенный уровень АсАт, что свидетельствует о нарушениях со стороны миокарда, и возможном развитии метаболической дезадаптации.
Заключение. Выявление нарушений метаболических процессов в раннем неонатальном периоде необходимо для своевременного начала коррекционной терапии с целью предотвращения развития заболеваний в более отдаленные периоды жизни ребенка.
Ключевые слова: новорожденные, кесарево сечение, ферменты, метаболизм, аминотрансферазы, адаптация.
Annotation. Despite widespread use, caesarean section is classified as a complex operation with a high incidence of complications. The purpose of the study: to evaluate the level of activity of AlAT and AsAT in the blood of children born by caesarean section as one of the metabolic parameters of postnatal adaptation. Methods: a retrospective comparative study. Examined children born by caesarean section (n = 103). Comprehensive examination included an assessment of a number of indicators: clinical, biochemical analysis of blood. Results: The average value of the studied parameters: AlAT — 15.75 ± 9.30; AcAt — 43.2 ± 24.22. In 12% of children after cesarean section in the early period of adaptation, an increased level of AsAt was observed, which indicates violations of the myocardium and the possible development of metabolic maladjustment. Conclusion: Detection of metabolic disturbances in the early neonatal period is necessary for the timely start of corrective therapy in order to prevent the development of diseases in more distant periods of a child's life.
Key words: newborns, cesarean section, enzymes, metabolism, aminotransferases, adaptation.
Возросший интерес неонатологов, педиатров, врачей смежных специальностей к проблемам детей, рожденных оперативным путем, связан прежде всего с исключением естественного биомеханизма родов и, следовательно, онтогенетически запрограммированных процессов адаптации к внеутробному существованию. В связи с этим следует учитывать, что постнатальная адаптация включает в себя перестройку метаболических процессов новорожденного, нарушение которых может вначале привести к дисфункции органов и систем, а в последующем — к развитию заболеваний.
Цель настоящего исследования: оценить уровень активности АлАТ и АсАТ в крови детей, рожденных путем кесарева сечения как одного из метаболических показателей постнатальной адаптации.
Методы: проведено ретроспективное сравнительное исследование. Обследовали детей, рожденных путем кесарева сечения (n = 103). Источник данных — стационарные карты новорожденных УЗ «Гродненский областной клинический перинатальный центр», г. Гродно, Беларусь. Комплексное обследование включало оценку ряда показателей: клинического, биохимического анализа крови. Критерии включения: доношенные дети, рожденные путем кесарева сечения. Критерии исключения: родовая травма, синдромальная патология, пороки развития органов и систем, инфекционные болезни, гемолитическая болезнь новорожденных.
Результаты.Одним из важнейших аспектов адаптации является адекватное течение метаболических процессов. Ферментный статус является объективным отражением изменений, происходящих во всем организме, в т. ч. при хроническом стрессе, к которому относятся плацентарные нарушения. Доказана высокая кардиоспецифичность креатинфосфокиназы, лактатдегидрогеназы, аспартатаминотрансферазы и их диагностическая значимость при гипоксически-ишемических поражениях миокарда. Индукция щелочной фосфатазы происходит при хроническом стрессе, указывает на стимуляцию системы гипофиз–кора надпочечников.
Активность аминотрансфераз, являясь маркером состояния печени и миокарда, часто используется в неонатальной неврологии. Для новорожденных младше пяти дней их уровень: АлАт < 49, АсАт < 97; от пяти дней до шести месяцев: АлАт < 57, АсАт < 77.
У новорожденных обследуемой группы средние значения активности аминотрансфеераз составили:АлАТ — 15,75±9,30 (минимум - 4,1; макс – 78,8); АсАт — 43,2±24,22(минимум - 8,5; макс – 145).
У 12 % новорожденных зарегистрирована высокая ферментативная активность АсАТ крови что свидетельствует о нарушениях со стороны миокарда, и возможном развитии метаболической дезадаптации.
Заключение. Выявление нарушений метаболических процессов в раннем неонатальном периоде необходимо для своевременного начала коррекционной терапии с целью предотвращения развития заболеваний в более отдаленные периоды жизни ребенка.
ФЕРМЕНТЫ В ДИАГНОСТИКЕ ИНФАРКТА МИОКАРДА
А.А Ахметгареева, А.Г. Янгурчина, Ю.Г. Янгурчина, 3 курс
Научный руководитель – к.м.н., доц. М.А. Белова
Кафедра клинической лабораторной диагностики
Оренбургский государственный медицинский университет
ENZYMESINTHEDIAGNOSISOFMYOCARDIALINFARCTION
A.A. Akhmetgareeva, A.G. Yangurchina, Y.G.Yangurchina, 3 course
Supervisor – Candidate of Sciences in Medicine, Assistant ProfessorM.A. Belova
Department of clinical laboratory diagnostics
The Orenburg State Medical University
Аннотация. В настоящее время уделяется большое внимание изучению ферментативной диагностике инфаркта миокарда. В ходе работы был проведен анализ научной литературы по данной теме и сопоставлено диагностическое значение ферментов (КФК – креатинфосфокиназа; АсАТ – аспартатаминотрасфераза; ЛДГ - лактатдегидрогеназа) и других лабораторных маркеров некроза миокарда (миоглобин, сердечные тропонины).
Ключевые слова: ферменты, ферментативная диагностика, маркеры некроза, креатинфосфокиназа, аспартатаминотрансфераза,миоглобин,лактатдегидрогеназа, сердечные тропонины.
А nnotation.Much attention is paid to the study of the enzymatic diagnosis of myocardial infarction today.An analysis of the scientific literature on this topic were carried out during of this work.The diagnostic value of enzymes was matced (CPK — creatine phosphokinase; AsAT — aspartate aminotransferase; LDH — lactate dehydrogenase) and other laboratory markers of myocardial necrosis (myoglobin, cardiac troponins) were compared.
Key words: enzymes, enzyme diagnostics, necrosis markers, aspartate aminotransferase, creatine phosphokinase, myoglobin, lactate dehydrogenase,cardiac troponins.
Актуальность темы вызвана социальной значимостью инфаркта миокарда (ИМ): он имеет тенденцию квсе большему распространению в мире, отличается сложностью диагностики и высоким процентом диагностических ошибок, является одной из основных причин инвалидности во взрослом возрасте.
У больных острым инфарктом миокарда происходит разрушение кардиомиоцитов и выход высвобождающихся клеточных ферментов в кровь, это и служитосновной причиной повышения активности и содержания ферментов в сыворотке крови, что является важным диагностическим показателем.
Идеальный биохимический маркер должен обладать наивысшей специфичностью и чувствительностью в отношении некроза миокарда, в течение короткого времени после начала симптомов ИМ достигать в крови диагностически значимого уровня, этот уровень должен сохраняться в течение многих дней. В настоящее время маркера, полностью отвечающего всем этим требованиям, не существует, поэтому для диагностики ИМ рекомендуется параллельно использовать два маркера — "ранний" и "поздний". Содержание "раннего" маркера при ИМ диагностически значимо повышается в крови в первые часы заболевания, "поздний" —достигает диагностически значимого уровня только через 6—9 часов (ч.), но обладает высокой специфичностью в отношении некроза миокарда.
К ранним диагностическим маркерам относятся миоглобин и сердечная форма креатинфосфокиназы (МВ-КФК).
Миоглобин — дыхательный пигмент, широко представленный в мышечной ткани человека. Молекулярная масса его составляет 18 кДа. Содержание миоглобина при ИМ повышается в сыворотке крови наиболее рано — в пределах 2 ч после возникновения симптомов. Он в неизмененном виде выводится мочой и к 24-му часу с момента начала симптомов исчезает из кровотока. Существуют методики, позволяющие определить концентрацию миоглобина в крови в течение 10 минут (мин.). Наиболее целесообразно применение миоглобина для суждения об успехе тромболитической терапии. У больных с успешной реканализацией артерии, кровоснабжающей зону ИМ, концентрация миоглобина в сыворотке крови нарастает уже через 60—90 мин после начала введения фибринолитика.Большое содержание миоглобина в скелетной мускулатуре и зависимость его концентрации от функции почек делают его неспецифичным в отношении некроза миокарда и ограничивают его применение для диагностики ИМ.
КФК — фермент, широко представленный в мышечной ткани человека. Изолированное определение в крови общей КФК в настоящее время большинством экспертов признано нецелесообразным для диагностики ИМ из-за высокого содержания этого фермента в скелетной мускулатуре и низкой специфичности в отношении некроза миокарда . MB-изоформа КФК — это гетеродимер с молекулярной массой 86 кДа. Скелетные мышцы содержат мышечную форму КФК (ММ-КФК) и менее 3% сердечной формы (МВ-КФК). МВ-КФК при ИМ появляется в сыворотке крови через 3—4 ч после начала симптомов и достигает диагностически значимого уровня к 4—6-му часу. Повышенный ее уровень сохраняется 48—72 ч. Доля МВ-КФК среди общей КФК, превышающая 5—6%, является специфичным признаком некроза миокарда. Однако хроническая почечная недостаточность, травматичные операции, гипотиреоз, некоторые онкологические заболевания, инсульты, миастении могут привести к повышенному уровню МВ-КФК в крови и гипердиагностике ИМ. При использовании MB-КФК для диагностики ИМ необходимо повторно определять концентрацию этого маркера в крови. Экспертами Европейского кардиологического общества (ЕКО) в настоящее время считается предпочтительным для диагностики ИМ определять массу МВ-КФК, а не активность этого фермента в крови.
К поздним диагностическим маркерам ИМ относятсялактатдегидрогеназа (ЛДГ), аспартатаминотрансфераза (АсАТ), сердечные тропонины I и Т.
ЛДГ — цитозольный белок с молекулярной массой 135 кДа, использующийся в клинической практике на протяжении четырех десятилетий. ЛДГ имеет пять изоэнзимов. В сердечной мышце содержится преимущественно изоэнзим ЛДГ-1. При ИМ концентрация ЛДГ начинает превышать нормальный уровень через 14—48 ч после начала симптомов, достигает максимального значения на 3—6-е сутки заболевания и возвращается к норме на 7—14-е сутки. ЛДГ-1 была обнаружена также в эритроцитах, почках, мозге, желудке, повышение концентрации этого белка в крови больных далеко не всегда связано с некрозом миокарда. Отношение ЛДГ-1/ЛДГ-2, превышающее 0,76, обладает 90% специфичностью при выявлении некроза миокарда. Это соотношение может увеличиваться и в случае отсутствия ИМ, если у больного имеются массивный гемолиз, мегалобластическая анемия, распространенное повреждение скелетных мышц, тяжелое заболевание печени. Из-за позднего повышения концентрации ЛДГ в сыворотке крови этот маркер не применяется для ранней диагностики ИМ и суждения об успехе тромболитической терапии, однако ЛДГ длительно использовалась для диагностики ИМ в поздние сроки заболевания.
АсАТ несколько десятилетий используется для диагностики ИМ. У больных ИМ уровень АсАТ превышает норму через 8—12 ч после начала боли, достигает максимального значения к 24—З6-му часу и возвращается к норме за 3—4 дня. Большое количество этого фермента содержится в тканях печени, что сильно снижает его специфичность в отношении некроза миокарда. АсАТ неудобна как для ранней, так и для поздней диагностики ИМ, она используется только в сочетании с более чувствительными и специфичными маркерами. Низкая специфичность в отношении некроза миокарда послужила причиной того, что использование этого маркера, как и ЛДГ, для диагностики ИМ в настоящее время также признано нецелесообразным.
Тропониновый комплекс, регулирующий процесс мышечного сокращения в кардиомиоцитах, состоит из трех субъединиц: Т, I и С . Сердечные тропонины и тропонины скелетных мышц имеют различную аминокислотную последовательность, что позволяет создавать высокоспецифичные диагностикумы для определения концентрации сердечных тропонинов Iи Т (сТн)в сыворотке крови. Молекулярная масса сТн Т составляет 37 кДа, сТн I —23,8 кДа. Сердечные тропонины при ИМ обычно достигают в крови больных диагностически значимого уровня через 6 ч после начала симптомов, повышенный их уровень сохраняется в дальнейшем в течение 7—14 суток, что делает их удобными для поздней диагностики ИМ. Из-за высокой специфичности и чувствительности определение сердечных тропонинов стало "золотым стандартом" в биохимической диагностике ИМ.
Таким образом, наибольшее значение в диагностике инфаркта миокарда имеют ферменты КФК и ЛДГ, появление вышеперечисленных ферментов в крови является важным диагностическим признаком. Другие лабораторные маркеры (миоглобин, тропонины) имеют ряд преимуществ, но имеют и свои ограничения. В связи с этимнеобходимо продолжение поиска более ранних и специфичных маркеров.
Дата добавления: 2019-07-17; просмотров: 666; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
