Стойкость бетона и железобетона в условиях эксплуатации в различных средах
Долговечным является материал (бетон, железобетон), который в течение многих лет эксплуатации в условиях, предназначенных для данного сооружения, не утрачивает своих прочностных свойств и не подвергается разрушению. Рассмотрим один из самых распространенных видов воздействия окружающей среды на бетон – знакопеременное изменение температуры.
5.1. Морозостойкость бетона
Замораживание и оттаивание бетона – это одна из основных проблем долговечности. Долговечность многих транспортных сооружений зависит от морозостойкости бетона, т.к. он в процессе эксплуатации подвергается многократному замораживанию, причем нередко в водонасыщенном состоянии. Примером таких сооружений являются плотины, бетонные покрытия дорог, опоры мостов, причальные сооружения и др. За осенне-зимне-весенний период в условиях нашего региона может быть 100 и более циклов перехода температуры воздуха через нулевую отметку. В результате фазового перехода воды в лед внутри бетона возникают внутренние напряжения, которые могут привести к разрушению структуры.
Для того, чтобы повреждение имело место, необходимо практически полное насыщение бетона водой. Вода в бетоне может замерзать только в крупных порах и капиллярах. Микропоры цементного геля слишком малы, и лед в них может образовываться только при очень низких температурах (~ ниже -78оС).
Можно выделить следующие факторы, которые в основном определяют морозостойкость бетона:
|
|
|
1. Минералогический состав и вид цемента.
2. Водоцементное отношение бетонной смеси.
3. Условия твердения бетона.
4. Химические добавки в бетонную смесь.
Минералогический состав цемента. Работы С.В. Шестоперова, В.М. Москвина, Г.И. Горчакова и многих других исследователей доказывают, что состав цемента значительно влияет на морозостойкость бетона. Наиболее стойкими при действии мороза являются продукты гидратации алита – C3S и белита C2S. Значительно ослабляет морозостойкость наличие в клинкере цемента трехкальциевого алюмината – С3А.
Содержание С3А в цементе для получения бетонов повышенной морозостойкости не должно превышать 5%.
Наиболее стойкими при замораживании являются бетоны, приготовленные на сульфатостойком, гидрофобном и пластифицированном портландцементе. Бетоны на таких цементах обладают большей плотностью, а также более высокой степенью гидратации минералов цемента.
Бетоны на шлакопортландцементе обладают достаточной морозостойкостью при содержании шлака до 45% и В/Ц ≤ 0,5.Благодаря наличию кремниевых соединений в шлаке при твердении бетона, особенно при тепловой обработке, происходит связывание свободного гидроксида кальция Са(ОН)2 в низкоосновные гидросиликаты. При этом структура бетона получается более плотной и стойкость материала повышается.
|
|
|
Водоцементное отношение бетонной смеси (В/Ц). Этот фактор является наиболее значимым. Чем выше В/Ц, тем больше пор в бетоне. Размер их также может значительно увеличиваться. Следовательно, больше воды содержится в поровом пространстве бетона при его водонасыщении. Для бетонов высокой морозостойкости В/Ц не должно превышать 0,5. При содержании в бетоне большого количества воды при его замерзании образуется много льда, возникают большие напряжения и бетон быстро разрушается.
Условия твердения бетона .Оптимальные условия твердения бетона – это положительная температура воздуха 10-15оС, относительная влажность 90…100%. При таких условиях, исключающих испарение или замерзание воды затворения, особенно на ранних сроках твердения, достигается высокая степень гидратации минералов цемента. При этом повышается прочность и морозостойкость бетона в марочном возрасте (28 суток).
“Холодные” бетоны, т.е. бетоны с противоморозными добавками (в основном, хлоридами), обладают более низкой морозостойкостью. При замораживании таких бетонов в порах может кристаллизоваться не только лед, но и кристаллы соли CaCl2·6H2O и др., что дополнительно увеличивает кристаллизационное давление в структуре бетона.
|
|
|
Если бетон подвергается тепловлажностной обработке, то это приводит к увеличению пористости и снижению морозостойкости. Для уменьшения пористости и получения более плотной структуры необходимо выбирать более “мягкие” режимы пропаривания. Например, увеличением времени выдержки бетона перед пропариванием или снижением скорости нагрева пропарочной камеры (не более 15оС в час).
Химические добавки в бетонную смесь. К ним относятся:
1. Пластифицирующие добавки. Например, суперпластификаторы типа С-3. Введение таких добавок в бетонную смесь резко увеличивает ее подвижность. В результате применения добавок можно получить, по крайней мере три положительных эффекта:
а) не изменяя состав смеси за счет увеличения ее пластичности можно получить более плотные бетоны при меньших затратах на уплотнение смеси. Иногда можно получить литые бетоны, отказавшись от виброуплотнения или укатки. Прочность бетона может при этом и не возрастать, но морозостойкость увеличивается за счет уменьшения общей пористости (в основном за счет уменьшения объема крупных пор);
|
|
|
б) сохраняя первоначальную подвижность смеси, можно уменьшить количество воды в смеси, т.е. понизить показатель В/Ц. Вследствие этого получают бетоны большей прочности и морозостойкости;
в) сохраняя В/Ц, можно уменьшить расход цемента при сохранении первоначальной подвижности смеси. Прочность бетона, скорее всего, не изменится, а за счет уменьшения объема цементной связки снижается общая пористость бетона, что должно привести к возрастанию морозостойкости бетона.
2. Гидрофобные добавки. К ним относятся мылонафт, асидол, кремнийорганические жидкости ГКЖ-10, ГКЖ-11 и др. (табл.2). Они придают поверхности пор гидрофобность, возрастает водонепроницаемость бетона за счет ухудшения смачиваемости бетона водой. Морозостойкость бетона должна возрастать.
3. Воздухововлекающие и газообразующие добавки. Это добавки СНВ, ЦНИПС-1, ГКЖ-94, алюминиевая пудра и др. (табл.2). Они создают структуру бетона с равномерно распределенными пузырьками газа или воздуха. При превращении воды в лед в поровом пространстве бетона эти пузырьки являются своеобразным буфером, снижающим кристаллизационное давление льда и способствующим релаксации внутренних напряжений в структуре. Морозостойкость бетона с данными добавками значительно возрастает.
Таким образом, химические добавки являются эффективным средством для увеличения морозостойкости бетона, особенно в дорожном строительстве.
Далее рассмотрим некоторые вопросы механизма и кинетики коррозионных процессов при протекании химических реакций между средой и компонентами цементного камня.
5.2. Коррозия цементного камня в бетоне
5.2.1. Коррозия I вида
Сущность процесса этого вида коррозии заключается в растворении и выносе из бетона при его омывании водой или при фильтрации воды через него соединений, входящих в состав цементного камня. Растворимость продуктов гидратации цемента в этом случае определяет возможность и скорость коррозии цементного камня в бетоне.
Наиболее растворимым компонентом цементного камня является гидроксид кальция, содержание которого в портландцементном камне достигает ~ 20% массы цемента. Растворимость Са(ОН)2 в дистиллированной воде при 20оС равна 1,18 г/л (в пересчете на СаО), поэтому наиболее опасна чистая (мягкая) вода, фильтрующаяся через бетон. К ним относятся воды оборотного водоснабжения, конденсат, дождевые и болотные воды и др. Присутствие других веществ в поровой жидкости бетона оказывает значительное влияние на растворимость гидроксида кальция. Если в растворе присутствуют одноименные ионы Са++ и ОН-, то растворимость уменьшается. Другие ионы, такие как SO4--, Cl-, Na+ повышают растворимость гидроксида кальция.
При омывании или фильтрации воды через бетон происходит уменьшение концентрации Са(ОН)2 в поровой жидкости. Это сопровождается перекристаллизацией и разложением других продуктов гидратации цемента (гидросиликатов кальция). Выщелачивание Са(ОН)2 в количестве 15…30% вызывает снижение прочности на 40…50%. Выщелачивание можно заметить по появлению белых потеков, состоящих из продуктов обменных реакций, на поверхности конструкций.
Меры борьбы с коррозией I вида включают следующие мероприятия:
1) ограничение содержания в цементе трехкальциевого силиката C3S, образующего наибольшее количество гидроксида кальция, до 50%.
2) Введение в состав портландцемента активных минеральных добавок, связывающих гидроксид кальция в нерастворимые соединения (гидросиликаты кальция). Если в цемент вводить гидравлические добавки типа молотого металлургического шлака, то в результате химической реакции Са(ОН)2 с аморфным кремнеземом, содержащимся в шлаке, будут образовываться гидросиликаты кальция. растворимость которых значительно ниже, чем гидроксида кальция. Интенсивность коррозии I вида резко уменьшится. Это один из основных способов защиты от коррозии бетона при выщелачивании Са(ОН)2 .
3) Обработка поверхностного слоя цементного камня веществами, образующими на поверхности пленку из нерастворимых продуктов, например, углекислым газом. Этот процесс протекает на воздухе и сопровождается образованием на поверхности конструкций пленки из нерастворимого карбоната кальция.
Са(ОН)2 + СО2 = СаСО3 ↓ + 2Н2О
Необходимо отметить, что многочисленные экспериментальные исследования и теоретические расчеты показывают, что разрушение конструкций в результате коррозии бетона I вида могут происходить крайне редко. Однако для высоконапорных тонкостенных сооружений например, бетонной отделки тоннелей эксплуатирующихся длительные сроки вопросы защиты бетона от коррозии этого вида могут быть весьма значимыми и актуальными.
Особенное внимание следует уделить долговечности сооружений, если имеется возможность фильтрации воды по трещинам, рабочим швам бетонирования и другим дефектам, возникающим в бетоне гидротехнических сооружений.
5.2.2. Коррозия II вида
Коррозия бетона этого вида обусловлена химическим взаимодействием между водой-средой и компонентами цементного камня. В результате обменных реакций усиливается вынос из бетона растворимых компонентов цементного камня, нарушается прочность кристаллизационных контактов структуры. К веществам, вызывающим коррозию II вида, прежде всего относятся кислоты и магнезиальные соли, образующие при реакции с составляющими цементного камня хорошо растворимые в воде соединения.
Кислотная коррозия бетона II вида. Она достаточно часто встречается в природных условиях. Чаще всего коррозионные процессы протекают при действии на конструкции углекислых вод. При строительстве объектов в болотистой местности на бетон могут воздействовать гуминовые кислоты. При освоении месторождений руды, например, медносернистых залежей, подземные воды имеют ярко выраженный кислотный характер. В частности, шахтные вода Сибайского медно-серного рудника часто имеют показатель рН < 2 и сильно агрессивны по отношению к бетону на портландцементе и его производных.
В промышленных условиях кислоты могут попадать в грунтовые воды в результате проливов при нарушении технологических процессов, утечек из систем канализации и других причин. Конечно, в большинстве случаев это происходит на предприятиях химии и нефтехимии, однако и на предприятиях дорожного комплекса также имеются производства, на которых возможно загрязнение грунтовых и сточных вод кислотами. Например, кислоты используются при приготовлении катионных битумных эмульсий, на станциях технического обслуживания автомобилей, при использовании серы для приготовления дорожно-строительных материалов и т. п. Таким образом, такой вид коррозии достаточно распространен, в том числе и в дорожном строительстве.
При действии кислоты на бетон цементный камень полностью разрушается. Продукты коррозии частично растворяются, оставшаяся часть остается на месте химической реакции.
Кислота вступает в химическое взаимодействие с гидроксидом кальция цементного камня, при этом образуются растворимые соли, или соли, обладающие невысокой растворимостью, но осыпающиеся с поверхности конструкций.
Са(ОН)2 + 2НС l = C аС l 2 + 2Н2О
Са(ОН)2 + Н2 SO 4 = C а SO 4 + 2Н2О
Углекислотная коррозия развивается при действии на цементный камень воды, содержащей свободную СО2 в виде слабой угольной кислоты. Реакция протекает в две стадии. На первой цементный камень не разрушается, а даже дополнительно упрочняется создаваемой карбонатной пленкой.
Са(ОН)2 + СО2 = СаСО3 ↓ + 2Н2О
На второй стадии избыточная двуокись углерода разрушает карбонатную пленку вследствие образования хорошо растворимого бикарбоната кальция
СаСО3 + СО2+ Н2О = Са(НСО3)2
Рассмотрим схематически процесс кислотной коррозии на примере действия азотной кислоты:
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
Разрушение начинается с поверхности бетона, которая находится в контакте с водной средой. Далее фронт коррозии перемещается вглубь бетона. Продукты коррозии могут осыпаться с поверхности конструкции, например, если она эксплуатируется в объеме раствора, а могут и оставаться на месте их образования, в частности, при эксплуатации сооружений в грунтах. В первом случае скорость коррозии будет постоянной во времени и описываться формулой
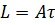 (2)
(2)
где L – толщина прокорродированного слоя, см;
А – коэффициент, определяющий скорость коррозии, и имеющий размерность см/с;
τ - время воздействия среды, с.
Необходимо отметить, что такой процесс в реальных условиях встречается редко. Например, при действии на бетон достаточно концентрированных растворов серной кислоты (рН < 2). При такой концентрации кислоты образующийся в результате реакции сернокислый кальций выпадает в осадок в поровом пространстве, а затем растущие кристаллы гипса разрушают прокорродировавший слой бетона. Если конструкция эксплуатируется в объеме раствора, то продукты коррозии осыпаются с поверхности бетона, обнажая новые неповрежденные слои материала.
Значительно чаще продукты коррозии остаются на месте их образования, например, если конструкция эксплуатируется в грунтах. Слои продуктов коррозии замедляют доступ агрессивной среды к неповрежденным слоям бетона, и скорость коррозионного процесса будет определяться скоростью диффузии агрессивной воды-среды через слой новообразований, толщина которого возрастает во время эксплуатации. Кинетика процесса будет описываться уравнением
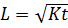 (3)
(3)
где К – константа скорости процесса, имеющая размерность коэффициента скорости диффузии, см2/с;
Магнезиальная коррозия II вида. Она имеет место при воздействии на гидроксид кальция магнезиальных солей, которые встречаются в растворенном виде в грунтовых водах, и всегда содержатся в большом количестве в морской воде. Разрушение цементного камня вследствие протекания обменных реакций происходит следующим образом.
Са(ОН)2 + Mg С l 2 = C аС l 2 + Mg (ОН)2
Са(ОН)2 + MgSO 4 = C а SO 4 + Mg (ОН)2
В результате этих реакций образуется или легкорастворимая соль хлорида кальция CаСl2, или труднорастворимая, но не связанная с цементным камнем и механическим путем удаляемая с его поверхности соль сульфата кальция - Cа SO4.
Меры борьбы с коррозией II вида включают в себя следующие мероприятия:
1) Ограничение содержания в цементе трехкальциевого силиката до 50%.
2) Введение в состав цемента активных минеральных добавок, связывающих гидроксид кальция в нерастворимые соединения (гидросиликаты кальция).
3) В случае кислотной коррозии устройство на поверхности конструкций защитных слоев из кислотостойких материалов (кислотостойкого кирпича или плитки, материалов на основе жидкого стекла и др.).
5.2.3 Коррозия III вида
В этом случае основной причиной коррозии бетона является накопление в поровом пространстве кристаллов солей, образующихся в результате взаимодействия внешней воды-среды с компонентами цементного камня. Выпадение в осадок кристаллов новой фазы и их рост вызывают значительные растягивающие усилия в стенках пор и капилляров, которые в конечном итоге могут привести к разрушению бетона.
На начальном этапе коррозии из-за процесса отложения солей в поровом пространстве бетона происходит уплотнение его структуры, и прочность материала возрастает. Только после возникновения значительных напряжений в стенках пор вследствие роста кристаллов новообразований происходит разрушение структуры цементного камня и наблюдается падение его прочности.
Наиболее распространенный случай коррозии III вида – это коррозия бетона при действии сульфатов. Сульфатные соли встречаются в большинстве природных вод. Если в реках и озерах содержание сульфат-ионов невелико (не более 100 мг/л), то в грунтовых водах оно значительно выше и может превышать безопасные концентрации по отношению к бетону, установленные нормами проектирования. Анализ грунтовых вод показывает, что на территории Республики Башкортостан примерно каждая девятая строительная площадка расположена в зоне нахождения грунтовых вод, содержащих сульфатные соединения в количестве, опасном для бетона, поэтому требуется предпринимать специальные меры для обеспечения долговечности подземных конструкций.
Развитие процесса коррозии бетона в жидкой сульфатной среде напрямую зависит от вида и свойств цемента, а также от состава агрессивной среды. Основная гипотеза, объясняющая причины разрушения структуры бетона при действии сульфатной среды - это гипотеза кристаллизационного давления. Согласно этой гипотезе, в порах цементного камня в зависимости от концентрации сульфат-ионов в среде, кристаллизуются гидросульфоалюминаты кальция (ГСАК) или гипс. Особенно интенсивно процесс сульфатной коррозии протекает, если в порах бетона кристаллизуется ГСАК в трехсульфатной модификации – 3CaO·Al2O3·3CaSO4·31H2O.
3СаО Al 2 O 3 ·6 Н2О + 3Са SO 4 + 25Н2О = 3СаО· Al 2 O 3 ·3Са SO 4·31Н2О
В природе такое соединение встречается и носит название эттрингит. В процессе сульфатной коррозии бетона оно образуется в результате взаимодействия гидроалюмината кальция С3АН6 с сульфат-ионами содержащимися ы количестве, превышающем 250мг/л. Образование в порах цементного камня гидросульфоалюмината кальция сопровождается увеличением объема в сравнении с первоначальным ~ в 1,8 раза. Это первичный процесс коррозии III вида.
При концентрации сульфат-ионов более 1500 мг/л в результате реакции сульфатных соединений с гидроксидом кальция выпадают в осадок и растут кристаллы двуводного гипса CaSO4·2H2O. При выпадении кристаллов гипса из раствора объем исходной твердой фазы увеличивается в 2,24 раза, что и вызывает нарастание внутренних напряжений, и, в конечном итоге, разрушение структуры. Это вторичный процесс коррозии III вида.
Са(ОН)2 + М gSO 4 + 2Н2О = CaSO 4 ·2 H 2 O + М g (ОН)2
В обоих случаях развивающееся в порах цементного камня кристаллизационное давление снижает его прочность, в конечном счете приводя к растрескиванию цементного камня изнутри.
Если в клинкере портландцемента содержание трехкальциевого алюмината превышает 8%, то полное разрушение структуры бетона, эксплуатирующегося в жидкой сульфатной среде, следует ожидать на стадии первичного процесса. Эксплуатация конструкций из бетона на таком цементе в сульфатных средах не рекомендуется.
При гидратации в клинкере с содержанием С3А менее 8% объем продуктов коррозии, образующихся на стадии первичного процесса, недостаточен для возникновения внутренних напряжений в структуре, которые бы вызвали ее полное разрушение. Имеет место лишь частичное ослабление кристаллизационного каркаса. Для полного разрушения необходимо развитие вторичного процесса.
Меры борьбы с коррозией III вида включают в себя следующие мероприятия:
1) Ограничение содержания в цементе трехкальциевого алюмината до 7-8%.
2) Использование в средах с высоким содержанием сульфатных солей специального сульфатостойкого портландцемента, содержащего пониженное количество С3S (до 50%) и С3А (до 5%).
Дата добавления: 2019-07-15; просмотров: 288; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
