Алканы ряда метана, их общая формула. Метан, электронное и пространственное строение, химические свойства (горение, реакция замещения)
Алканы (предельные, насыщенные) – это нециклические углеводороды, в молекулах, которых атомы углерода связаны друг с другом только простыми (σ-связями). Алканы имеют общую формулу CnH2n+2 , не присоединяют водород и другие элементы.
Строение молекулы метана
Простейшим представителем предельных углеводородов является метан.
СН4 – молекулярная формула (качественный, количественный состав).
Молекула метана не имеет плоского строения. Молекула метана в действительности имеет формутетраэдра. Тетраэдр – это пирамида, в основании которой лежит равносторонний треугольник. Вцентре тетраэдра находится атом углерода, а атомы водорода – в вершинах тетраэдра.
Вывод: молекула метана в пространстве имеет тетраэдрическое строение.
1) Для метана характерны главным образом реакции замещения атомов водорода на атомы галогенов:
2)
СН4 + Cl2 →CH3Cl + HCl - хлорметан
СН3Cl + Cl2 →CH2Cl2 + HCl - дихлорметан
СН2Cl2 + Cl2 →CHCl3 + HCl – трихлорметан (хлороформ)
СНCl3 + Cl2 →CCl4 + HCl – тетрахлорметан (четыреххлористый углерод)
Метан с кислородом: реакция горения
Процесс горения метана — это взаимодействие метана с кислородом. В результате реакции образуется вода, двуокись углерода и много энергии. Уравнение реакции горения метана:
CH₄[газ] + 2O₂[газ] → CO₂[газ] + 2H₂O[пар] + 891кДж
ВОПРОС №7
Алкены ряда этена (этилена), их общая формула. Этилен, его химические свойства (горение, реакции присоединения и полимеризации)
Алкены – нециклические углеводороды с одной двойной связью и общей формулой С n Н2 n
Двойная связь – сочетание прочной σ–связи и непрочной π –связи.
Электронное строение молекулы этилена
Атомы углерода в составе молекулы алкена связаны между собой двойной связью. Эти атомы находятся в состоянии sp2-гибридизации. Двойная связь между ними образована из двух пар обобществленных электронов, т.е. это четырехэлектронная связь. Она сочетанием ковалентных σ-связи и π-связи. σ-Связь образована за счет осевого перекрывания sp2-гибридных орбиталей, а π-связь – за счет бокового перекрывания негибридизованных p-орбителей двух атомов углерода (рис. 1).
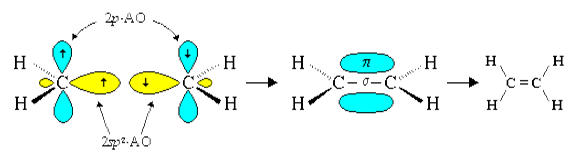
Рис. 1. Строение молекулы этилена.
Пять σ-связей двух sp2-гибридизованных атомов углерода лежат в одной плоскости под углом 120o и составляют σ-скелет молекулы. Над и под этой плоскостью симметрично расположена электронная плотность π-связи, которую можно изобразить также в виде плоскости, перпендикулярной σ-скелету.
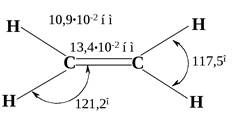
При образовании π-связи происходит сближение атомов углерода, потому что межъядерное пространство в двойной связи более насыщено электронами, чем в σ-связи. Это стягивает атомные ядра и поэтому длина двойной связи (0,133 нм) меньше одинарной (0,154 нм).
Рис. 4.3. Молекула этена:
а - боковое перекрывание 2р-орбиталей (p-перекрывание);
б - p-связь состоит из двух электронных облаков, одно из которых лежит над, а другое – под плоскостью молекулы
Таким образом, двойная углерод-углеродная связь построена из более прочной s-связи (347 кДж/моль) и менее прочной p-связи (260 кДж/моль). p-Связь делает невозможным вращение одного атома углерода относительно другого вдоль связи углерод-углерод. С этим связано явление геометрической изомерии.
Двойная углерод-углеродная связь в этене короче, чем простая связь в этане.
Реакции присоединения.
а) Взаимодействие с водородом (гидрирование)
СН2=СН2+Н2→СН3-СН3
этен этан
б) Взаимодействие с галогенами (галогенирование)
СН2=СН2+Br2 → СН2Br-СН2Br (1,2-дибромэтан)
обесцвечивание бурой окраски раствора брома в воде служит качественной реакцией на наличие двойной связи.
в) Взаимодействие с галогеноводородами
СН2=СН2+НСl→СН3-СН2Cl (хлорэтан)
г) Взаимодействие с водой (гидратация)
СН2=СН2+Н2O→СН3-СН2OH (этанол)
Реакции полимеризации.
Полимеризация – соединение небольших молекул мономера в гигантские молекулы полимера:
n СН2=СН2 → (-СН2-СН2-)n
этилен полиэтилен
Дата добавления: 2019-07-15; просмотров: 3585; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
