Гены и наследственные болезни 5 страница
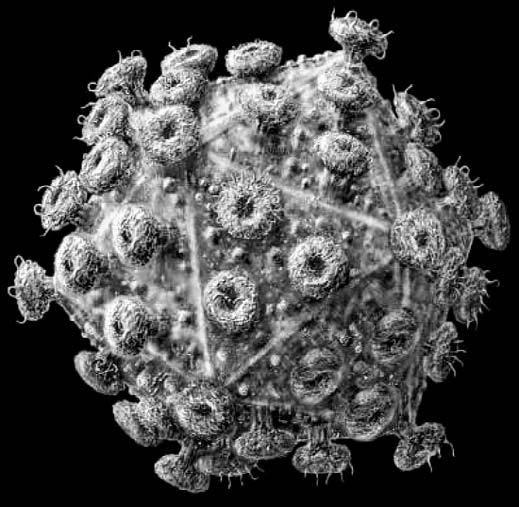
Вирус иммунодефицита человека под микроскопом
Итак, даже относительно крупные и сложно организованные вирусы несопоставимо примитивнее любой клетки и гораздо меньше ее по размерам. Но тогда немедленно возникает вопрос: почему живая клетка, это воплощение гибкости и неприхотливости, замечательно умеющая выживать в горячих водах термальных источников и на арктическом льду, уникальная миниатюрная фабрика по бесперебойному синтезу белков и ферментов, так легко сдается на милость победителя? Почему она не в силах успешно противостоять столь незначительному врагу, которого и живым-то назвать можно с очень большой натяжкой? Чтобы разрешить этот парадокс, необходимо как следует разобраться в механизме репродукции убийц-невидимок.
На заре вирусологии ученые договорились считать, что вирусы – просто очень маленькие бактерии, размножающиеся вполне традиционно, посредством элементарного поперечного деления, когда из одной клетки образуются две, из них – четыре, и т. д. Наибольшая скорость деления, доступная бактериальным клеткам, исчисляется тремя удвоениями в час, и если бы вирус вел себя аналогично, то его потомство за три часа последовательных удвоений составило бы не более тысячи вирионов.
Но когда ученые сумели наконец вычислить истинный темп накопления вирионов в клетке, от стандартной модели не осталось и следа. Опыты с бактериофагами показали, что вирионы размножаются в 100 тысяч раз быстрее бактерий, давая уже через три часа потомство в 100 миллионов вирусных частиц. Стало ясно, что механизм репродукции вирусов не имеет ничего общего с «пополамным» делением бактерий.
|
|
|

Д. И. Ивановский
Ученым пришлось вплотную заняться изучением жизненного цикла вирусов. Выяснилось, что на стадии вириона (или вироспоры ), то есть до проникновения в клетку, вирус не обнаруживает никаких признаков жизнедеятельности. В связи с этим в науке до сих пор нет единого мнения о том, можно ли вирусы на этой стадии считать живыми. Более того, некоторые вирусы способны к кристаллизации (например, кристаллы вируса табачной мозаики впервые обнаружил еще Д. И. Ивановский), но стоит им только проникнуть в клетку, как они немедленно «оживают».
Дмитрию Иосифовичу Ивановскому (1864–1920), профессору ботаники Петербургского университета, принадлежит честь открытия вирусов. На протяжении нескольких лет он изучал так называемую мозаичную болезнь табака и в 1892 году обнародовал результаты своих исследований.
Мозаичная болезнь табака – это инфекция, поражающая табачные листья с образованием бурых пятен различной формы. Примерно за десять лет до работ Ивановского немецкий ученый А. Мейер показал, что сок больных растений вызывает такую же болезнь у здоровых, но выделить возбудитель инфекции ему не удалось. Тем не менее, он был убежден, что виновником мозаичной болезни табака является микроб, поскольку сок больного растения, процеженный через двойной слой фильтровальной бумаги, терял свои инфекционные свойства.
|
|
|
Д. И. Ивановский повторил опыты Мейера и обнаружил, что фильтрование через бумагу ровным счетом ничего не дает. Более того, даже пропускание сока через свечи Пастера – Шамберлена, сделанные из мелкопористой глины, которая удаляет из раствора любые видимые в микроскоп бактерии, не давало обеззараживающего эффекта. А вот кипячение делало его не опасней дистиллированной воды.
Ивановский справедливо заключил, что мозаичная болезнь табака вызывается некими патогенными агентами, размеры которых много меньше всех известных (в ту пору) микроорганизмов. Впоследствии из-за способности проходить сквозь бактериальные фильтры их стали называть фильтрующимися вирусами или просто вирусами (от лат. virus – «яд»).
Таким образом, вирусы представляют собой «переходный этап» между миром живых организмов и миром мертвой органики, а вироспора – лишь одна из форм существования вируса.
|
|
|
После соприкосновения с клеткой в жизненном цикле вирусов можно выделить следующие несколько фаз: фаза адсорбции (прикрепления вируса к клетке), фаза внедрения, латентная фаза, фаза образования нового поколения вирусов, фаза выхода вироспор.
Процесс начинается с избирательной адсорбции вируса на особых рецепторах, расположенных на поверхности клетки. При этом одни вирусы, имеющие в своем арсенале специальный фермент проникновения (наподобие нейраминидазы у вируса гриппа), активно внедряются внутрь, растворяя клеточную стенку мишени, а другие ведут себя пассивно и не торопят события: клетка проглотит их сама, приняв за вкусную и здоровую пищу.
Оказавшись внутри, вирус перестает существовать – это как раз и есть латентная фаза. Он истаивает, как призрак, бесследно исчезает в буквальном смысле этого слова, и отныне уже никакими самыми чувствительными методами в клетке не удается обнаружить ни цельной вирусной частицы, ни отдельных ее компонентов. Эта фаза его жизненного цикла настолько необычна, что даже получила особое название – эклипс (от греч. ekleipsis – «исчезновение, затмение»). Кажущееся исчезновение вируса объясняется просто: просочившись в клетку, вирион сбрасывает толстую белковую оболочку и освобождает свою нуклеиновую кислоту. Весьма примечательно, что процедуру «разоблачения» осуществляет сама клетка – с помощью набора ферментов, которые атакуют вирусную частицу с целью лизировать (растворить) и скушать питательный белок. По окончании «трапезы» клетка встречается лицом к лицу с вирусной нуклеиновой кислотой, и это определяет всю последовательность дальнейших событий.
|
|
|
Когда вирус проникает в клетку, великолепно отлаженная схема белкового синтеза немедленно дает сбой, поскольку все процессы внутриклеточного обмена ставятся под неусыпный контроль вирусной нуклеиновой кислоты. Вместо того чтобы синтезировать белки, необходимые для собственной нормальной жизнедеятельности, клетка начинает усердно тиражировать вирусные частицы. Все ресурсы, имеющиеся в наличии, пускаются на бессмысленное производство сотен тысяч вирионов, и клетка, по сути дела, превращается в автоматическую фабрику по сборке своих убийц, так как многочисленное потомство внедрившегося вируса, стремясь выйти наружу, расплавляет клеточную стенку.
Дело в том, что информация, закодированная в вирусной РНК (или ДНК, в данном случае это роли не играет), является для клетки приказом столь жестким и непреложным, что клетка не принимает во внимание сопротивление собственных нуклеиновых кислот. В ходе недавних исследований было установлено, что вскоре после проникновения вируса в клетку начинается синтез особого белка-ингибитора, который подавляет нормальное функционирование клеточной ДНК. В результате передача информации, необходимой для внутриклеточных процессов биосинтеза, сразу же приостанавливается. Практически одновременно с этим рождается фермент, бесповоротно разрывающий полисомные комплексы, где шла белковая сборка, а еще один фермент под названием полимераза (или синтетаза) окончательно берет под контроль процесс снятия копий с внедрившейся вирусной РНК.
Известный вирусолог А. А. Смородинцев отмечает:
Предполагают, что молекулы нуклеиновой кислоты для будущих вирусных частиц строятся в ядре зараженной клетки, а белковые футляры – в цитоплазме. Затем происходит формирование «полного», то есть зрелого, вируса. На внутренней поверхности клеточной оболочки завершается объединение вирусной нуклеиновой кислоты (ДНК или РНК) с белковым чехлом. Этот процесс идет одновременно во многих участках и заканчивается созреванием большой массы высокозаразных частиц.
Иногда в клетках образуется больше молекул одного биополимера, чем другого. Тогда после сборки всех полноценных вирионов вирусного потомства может остаться некоторый избыток вирусной РНК или вирусного белка. Если в зараженной клетке сформировался избыток вирусного белка, его молекулы образуют оболочку вируса, не начиненную РНК (которой для этого просто не хватило). Эти структуры, называемые «неполный» вирус, выходят из клетки, и их можно увидеть в электронном микроскопе. Они похожи на бублик с дыркой посередине. Естественно, что такой «неполный» вирус не обладает инфекционными свойствами, которые полностью зависят только от РНК.
Но бывает, что вирусы выкидывают и куда более сложные коленца. Например, семейство ретровирусов, к числу которых относятся возбудители некоторых лейкозов, так называемых медленных инфекций и знакомый всем вирус СПИДа, довело тактику скрадывания до немыслимого совершенства. Когда вирус СПИДа проникает в клетку, он сбрасывает защитный белковый чехол, а на его РНК начинается синтез другой нуклеиновой кислоты – ДНК. Все шиворотнавыворот! Этот процесс называется обратной транскрипцией (его поддерживает специальный фермент – обратная транскриптаза , или ревертаза ).
Новоиспеченная вирусная ДНК встраивается в хромосому хозяйской клетки. В такой латентной (скрытой) форме она, никак себя не обнаруживая, может пребывать неограниченно долго – вплоть до естественной смерти зараженного. Но предсказать заранее, как именно поведет себя внедрившийся вирус, невозможно. Из латентной формы он с легкостью переходит в активную фазу и начинает деятельно реплицироваться. Теперь РНК синтезируется на матрице ДНК (это уже механизм прямой, а не обратной транскрипции), а на базе РНК, в свою очередь, собираются вирусные белки. Через короткое время вирус созревает и, покрывшись оболочкой, выходит в кровь. При низком уровне размножения существование паразита в организме больного только поддерживается (таких больных называют вирусоносителями), а при высоком – развивается СПИД в классической форме, рано или поздно неизбежно приводящий к смерти.
Итак, инфекционные свойства вируса связаны с его нуклеиновой кислотой, что поначалу специалистами было встречено с недоверием. Многие ученые долгое время полагали, что истинными виновниками патологического процесса являются не нуклеиновые кислоты как таковые, а белки оболочки вируса. Потребовались годы и десятилетия кропотливых экспериментов, чтобы понять, как все происходит на самом деле. Белковый чехол помогает вирусу проникнуть в клетку, и на этом его функция исчерпывается, а вот репродукция вирионов – целиком и полностью заслуга вирусной нуклеиновой кислоты. Другое дело, что в естественных условиях «голая» РНК никогда не сумеет проникнуть через неповрежденную клеточную стенку (такая задача по плечу только цельной вирусной частице), но управляет всем именно она. Причем в корне неверно рассматривать внутриклеточную репродукцию вируса в качестве самостоятельной работы клетки, хотя на первый взгляд может показаться, что дело именно так и обстоит. Но это всего лишь иллюзия, ибо в действительности всем цитоплазматическим хозяйством командует вирус, а биосинтетические системы клетки подчиняются ему, расходуя строительный материал.
Тем не менее многоклеточные организмы сумели выжить (чему примером служит наше с вами существование), значит, в клетке имеются надежные механизмы противодействия вирусной инфекции. В противном случае неутомимые агрессоры, умеющие размножаться в сотни тысяч раз быстрее любой бактерии, давным-давно истребили бы все живое на планете.
Как же работает этот загадочный механизм и какое он имеет отношение к хорошо изученным иммунным реакциям типа «антиген – антитело»?
Примерная схема работы антимикробного иммунитета в общих чертах ясна и выглядит следующим образом. Когда бактерия проникает в наш организм, ее белки распознаются иммунной системой как «не свои», чужеродные, потому что любая клетка (бактериальная или клетка нашего тела – роли не играет) несет на своей поверхности индивидуальные метки – так называемые антигенные детерминанты. Рисунок этих маркеров уникален для каждого организма, даже если они принадлежат к одному виду (единственное исключение – однояйцевые близнецы, поскольку они являются генетическими двойниками). Таким образом, бактерия-агрессор выступает в качестве антигена – вещества, стимулирующего иммунную систему к выработке антител – особых белковых молекул, которые атакуют и уничтожают эту бактерию. Это и есть реакция «антиген – антитело».
Образовавшиеся антитела в высокой степени специфичны, то есть направлены против той инфекции, которая вызвала их продукцию. Поскольку вирус заключен в белковый чехол, он тоже является антигеном, поэтому резонно предположить, что иммунная система будет отвечать на его внедрение аналогично. И действительно, человек, переболевший корью (а корь – это вирусная инфекция), никогда не заражается ею повторно, так как приобретает по отношению к ней стойкий иммунитет.
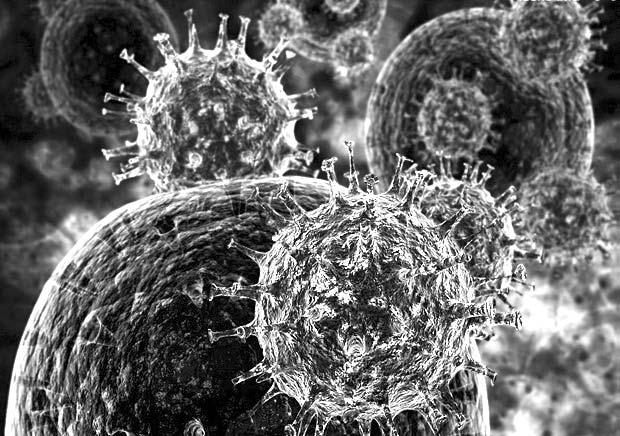
Вирус гриппа, атакующий здоровую клетку организма
Поэтому ученые долгое время считали, что и при вирусных инфекциях выздоровление обеспечивается в первую очередь специфическим иммунитетом, за счет классической реакции «антиген – антитело». Однако при этом напрочь игнорировались два весьма важных факта, которые буквально бросаются в глаза.
Во-первых, хорошо известно, что антитела образуются и поступают в кровь только через несколько дней после заражения, так как иммунной системе необходим определенный срок, чтобы идентифицировать вирус и выработать достаточное количество антител.
Но темп репродукции вируса многократно превышает скорость размножения бактериальных клеток. Картина складывается удручающая: в первые два-три дня болезни несметные полчища вирионов успевают «заселить» едва ли не все клетки потенциальной жертвы, а иммунная система безнадежно опаздывает. Антител будет слишком мало, и они просто-напросто не сумеют нейтрализовать вирус.
Во-вторых, антитела могут связывать вирус только в том случае, если он локализован вне клетки – в крови или лимфе. Проникнуть в зараженную вирусом клетку им не под силу, хотя они вполне успешно препятствуют его внедрению в чувствительную ткань.
Итак, мало того, что популяция антител оказывается весьма немногочисленной, они вдобавок должны успеть перехватить вирус в тот момент, пока он еще находится в сосудистом русле. Если вирус уже обосновался в клетке, иммунная система бессильна.
Но тогда немедленно возникает вопрос: коль скоро реакция «антиген – антитело» не поспевает за вирусом, как же наш организм побеждает инфекцию?
Все мы не по одному разу болели гриппом и, слава богу, живы-здоровы. Да что там грипп! Даже при таких тяжелейших вирусных заболеваниях, как натуральная оспа, клещевой энцефалит или желтая лихорадка, погибают далеко не все инфицированные. Очевидно, должен существовать некий механизм, который в первые часы после заражения оперативно перехватывает вирус и тормозит его внутриклеточную репродукцию, пока образование специфических антител только-только начинает набирать обороты.
Такой механизм вскоре действительно удалось обнаружить. В 1930-х годах группа американских ученых, работавших с вирусом желтой лихорадки, обратила внимание на весьма примечательный факт. Если обезьяне незадолго до заражения желтой лихорадкой ввести какой-нибудь другой, малоопасный, вирус (он может быть вирусом совершенно иного типа), то болезнь не развивается вовсе. Эксперименты на других животных – рыбах, птицах, рептилиях и млекопитающих (на человеке в том числе) – дали тот же результат.
Сомнений больше не оставалось: в клетках нашего организма присутствует некий «фактор икс», таинственный противовирусный агент с широким спектром действия, способный при инфицировании вирусом одного типа вызывать устойчивость к вирусу другого типа (даже неродственному). В медицине появился новый термин – интерференция , позаимствованный из точных наук[13].
Если классическая реакция «антиген – антитело» отличается высокой избирательностью (при заражении корью антитела направлены только против вируса кори, но никак не против эпидемического паротита или ветряной оспы), то феномен интерференции, наоборот, предельно неспецифичен: инфицированная клетка начинает продуцировать низкомолекулярный белок, подавляющий репродукцию любых вирусов.
Однако идентифицировать этот белок удалось далеко не сразу, поэтому многие ученые настаивали на том, что загадочный феномен объясняется элементарной конкуренцией, когда один вирус отбирает у другого захваченную территорию.
Только в 1957 году английские ученые А. Айзекс и Д. Линденман, работавшие с вирусом гриппа, сумели наконец выделить «фактор икс» в чистом виде. Оказалось, что синтез интерферона (так назвали новый белок) напрямую связан с вирусной агрессией, поскольку в интактных (неинфицированных) клетках его обнаружить не удалось.
Синтез интерферона начинается сразу же после внедрения вируса в клетку и занимает всего лишь от двух до шести часов, так что вирусному потомству при всем желании за ним не угнаться. Кроме того, небольшие молекулы интерферона без труда проникают через клеточную оболочку. Таким образом, пока вирус еще только готовится приступить к делу, легкие молекулы успевают созреть, покинуть клетку, выйти в межклеточное пространство и просочиться в соседние клетки. Интерферон работает на опережение и напоминает группу быстрого реагирования или бдительную погранзаставу, которая первой принимает удар на себя и ведет бой, дожидаясь подхода основных сил.
Но что является непосредственным толчком к началу синтеза интерферона?
Когда вирус разоблачается, сбрасывая белковый чехол и освобождая свою нуклеиновую кислоту, клетка воспринимает эти действия как сигнал тревоги. Дело в том, что вирусная двунитевая РНК в клетке представляет собой чужеродный объект, поскольку собственные клеточные РНК, как мы помним, всегда построены из одной-единственной цепочки. Как только вирусная нуклеиновая кислота превращается в матрицу, готовую для снятия новых копий вирионов, клетка реагирует незамедлительно. Получив сигнал опасности, она включает так называемый ген-оператор, который запускает образование информационной (матричной) РНК, и на внутриклеточных полисомах – органеллах, отвечающих за синтез белка, – начинается сборка легких молекул интерферона. В дальнейшем события развиваются по описанному выше сценарию: синтез молекул интерферона значительно опережает темп репродукции вируса, и непрошеному гостю приходится несладко.
Молекулы интерферона
Теперь посмотрим, как интерферон расправляется с вирусом.
Антитела, как известно, просто находят и уничтожают пришельца, а вот механизм действия интерферона принципиально иной, что и было установлено в специальных исследованиях. Этот белок не вступает в прямой контакт с паразитом, он воздействует на синтетический аппарат клетки таким образом, что тот становится непригодным для репродукции вируса.
Полной ясности в этих вопросах пока нет. Вероятно, интерферон запускает группу «спящих» генов, отвечающих за синтез особых матричных РНК, с помощью которых клетка строит антивирусный белок. Когда этот белок присоединяется к рибосоме, ее конфигурация меняется таким образом, что становится непригодной для сборки новых поколений вирионов. При этом все синтетические процессы, необходимые для нормального функционирования самой клетки, полностью сохраняются. Одним словом, клетка превращается в своеобразную ловушку, куда вирус без особого труда проникает, но произвести на свет потомство оказывается не в состоянии.
Молекула антитела
Весьма примечательно, что молекулы интерферона напрочь лишены какого-либо побочного действия и подавляют размножение практически всех известных вирусов, чем выгодно отличаются от самых эффективных антибиотиков. Антибиотики широкого спектра действия оказывают влияние на очень многие возбудители бактериальной природы, но против вирусов они бессильны. В первые часы и дни после внедрения вирусных частиц за дело принимается именно интерферон, что весьма важно в тех случаях, когда организм встречается с каким-либо вирусом впервые и потому не имеет к нему готовых антител.
Дата добавления: 2019-02-13; просмотров: 255; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
