Практичне заняття 7 Рівновага в розчинах електролітів
Мета – сформувати сучасні уявлення про йонні рівноваги в розчинах слабких електролітів
Підготовка до заняття
| Що необхідно зробити | | Що необхідно знати і вміти | |||
| 1 | 2 | ||||
| - вивчити закон розведення Оствальда, константу рівноваги електролітичної дисоціації – константу дисоціації, фактори, від яких вона залежить | - проводити розрахунки за законом розведення Оствальда, за табличними значеннями констант дисоціації порівнювати силу електролітів, складати вираз константи дисоціації для конкретних електролітів, пояснювати вплив різних факторів на зміщення рівноваги в розчинах слабких електролітів | ||||
| - вивчити поняття йонного добутку води, водневого показника (рН) розчину, добутку розчинності важкорозчинних сполук | - вміти розраховувати водневий показник (рН) розчину, складати вираз добутку розчинності важкорозчинних сполук; - прогнозувати можливість випадіння осаду, користуючись табличними значеннями добутку розчинності | ||||
| 1 | 2 | ||||
| - вивчити різні випадки гідролізу солей, фактори, що впливають на нього, випадки необоротного гідролізу, кількісні характеристики гідролізу - ступінь і константу | - заформулою солі прогнозувати можливість перебігу реакції її гідролізу і передбачати реакцію середовища в її розчині, складати рівняння реакцій гідролізу в йонному та молекулярному вигляді, пояснювати випадки необоротного гідролізу
| ||||
| - ознайомитися з алгоритмами і прикладами виконання типових завдань;: - обдумати відповіді на запропоновані до заняття запитання; - виконати домашні завдання (1-5 у переліку завдань), переглянути завдання (6-10 у переліку завдань), які будуть розглядатися під час практичного заняття | - виконувати типові завдання | ||||
Запитання до практичного заняття
1 Сформулюйте закон розведення Оствальда.
2 Від яких чинників залежить константа дисоціації? Яка характеристика щодо сили електроліту є більш інформативною: ступінь чи константа дисоціації? Відповідь поясніть.
3 Що називається гідролізом солей? Які солі підлягають гідролізу, а які ні? Наведіть приклади.
4 Які фактори впливають на гідроліз?
5 Як можна посилити гідроліз солі, який відбувається за катіоном?
6 Яка реакція середовища встановлюється в розчині солі, що гідролізується за аніоном?
7 Якими є умови випадіння і розчинення осаду важкорозчинного електроліту?
Завдання
1 Визначте,при якій концентрації розчину (моль/л) ступінь дисоціації 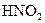 становитиме 20% (
становитиме 20% ( 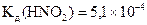 )?
)?
2 Розрахуйте ступінь дисоціації фторидної кислоти  , якщо масова частка кислоти становить 2% (
, якщо масова частка кислоти становить 2% ( 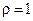 г/см3), а
г/см3), а 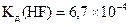 .
.
3 Розрахуйте добуток розчинності барій карбонату, якщо розчинність солі становить 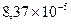 моль/л при 250С.
моль/л при 250С.
|
|
|
4 Для таких солей: а) кальцій нітрит; б) хром(ІІІ) нітрат; в) натрій сульфід; г) купрум(ІІ) хлорид складіть рівняння гідролізу за першим ступенем у молекулярному та йонному вигляді і назвіть реакцію середовища.
5 При змішуванні розчинів хром(ІІІ) сульфату та натрій сульфіду утворюється осад хром(ІІІ) гідроксиду. Складіть рівняння цієї хімічної реакції у молекулярному та йонному вигляді.
6 При якій концентрації розчину (моль/л) ступінь дисоціації кислоти становитиме 3%? Константа дисоціації кислоти дорівнює 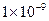 .
.
7 Розрахуйте концентрацію катіонів Гідрогену (моль/л) у 0,02 М розчині сульфітної кислоти ( 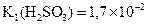 ), дисоціацією кислоти за другим ступенем можна знехтувати.
), дисоціацією кислоти за другим ступенем можна знехтувати.
8 Чи утвориться осад при змішуванні 0,005 М розчину 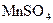 та 0,003 М розчину
та 0,003 М розчину 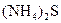 однакових об`ємів? Добуток розчинності
однакових об`ємів? Добуток розчинності 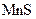 дорівнює
дорівнює 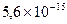 .
.
9 Для таких солей: а) алюміній сульфат; б) цинк хлорид; в) калій карбонат; г) амоній ціанід складіть рівняння гідролізу за першим ступенем у молекулярному та йонному вигляді і назвіть реакцію середовища.
10 При змішуванні розчинів алюміній хлориду та амоній сульфіду утворюється осад алюміній гідроксиду. Складіть рівняння цієї хімічної реакції у молекулярному та йонному вигляді.
|
|
|
Дата добавления: 2019-02-13; просмотров: 148; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

