Практичне заняття 6 Електролітична дисоціація
Мета – сформувати сучасні уявлення про розчини електролітів
Підготовка до заняття
| Що необхідно зробити | | Що необхідно знати і вміти | |||
| 1 | 2 | ||||
| - вивчити (повторити) поняття: «електроліт», «неелектроліт», «електролітична дисоціація», «ступінь дисоціації», - вивчити основні положення ТЕД | - визначати електроліти і неелектроліти, складати рівняння електролітичної дисоціації солей, кислот, лугів, пояснювати механізм дисоціації | ||||
| 1 | 2 | ||||
| - розглянути елементи теорії сильних електролітів, поняття: «йонна атмосфера», «активність», «коефіцієнт активності» | - визначати сильні і слабкі електроліти, пояснювати поведінку сильних електролітів у розчині, знати їх формули | ||||
| - вивчити (повторити) загальні властивості кислот, солей, основ у світлі ТЕД | - складати рівняння реакцій, які характеризують загальні властивості кислот, солей, основ у світлі ТЕД у молекулярному та йонному вигляді, складати молекулярні рівняння реакцій за наведеними йонними рівняннями, знати умови перебігу реакцій йонного обміну до кінця | ||||
| - ознайомитися з визначеннями кислот та основ у світлі теорій Бренстеда і Льюїса | - пояснювати кислотно-основні властивості сполук у світлі теорій Бренстеда і Льюїса | ||||
| - ознайомитися з алгоритмами і прикладами виконання типових завдань; - обдумати відповіді на запропоновані до заняття запитання; - виконати домашні завдання (1-5 у переліку завдань), переглянути завдання (6-10), які будуть розглядатися під час практичного заняття
| - виконувати типові завдання | ||||
Запитання до практичного заняття
1 Сформулюйте основні положення ТЕД.
2 Наведіть визначення кислот, солей, основ у світлі ТЕД.
3 Як можна розрахувати ступінь дисоціації? Які чинники впливають на неї? Як класифікують електроліти за ступенем дисоціації?
4 Якими є умови повного перебігу реакцій йонного обміну?
5 Які загальні властивості характерні для кислот, солей, основ?
6 У чому полягає відмінність у механізмі дисоціації речовин із ковалентним та йонним зв’язком?
7 Як визначають кислоти та основи з позиції теорій Бренстеда-Лоурі та Льюїса?
Завдання
1 Складіть рівняння повної електролітичної дисоціації для сильних електролітів та ступінчастої – для слабких: а) сульфатної кислоти; б) кальцій гідроксиду; в) ортофосфатної кислоти; г) алюміній сульфату; д) карбонатної кислоти.
2 Складіть рівняння хімічних реакцій, які можуть відбутися при зливанні розчинів таких речовин:
а) 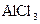 і
і 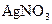 ; б)
; б) 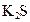 і
і  ; в)
; в) 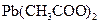 і
і  ; г)
; г) 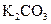 і
і 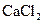 ; д)
; д) 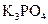 і
і 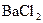 .
.
3 Складіть молекулярні рівняння хімічних реакцій за наведеними скороченими йонними:
|
|
|
а)  ; б)
; б)  ;
;
в) 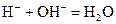 ; г)
; г)  .
.
4 Чи можливе одночасне перебування у розчині таких пар речовини: а) 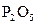 і
і 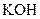 ; б)
; б) 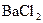 і
і 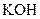 ; в)
; в)  і
і 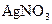 ; г)
; г)  і
і 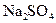 ? Відповідь поясніть.
? Відповідь поясніть.
5 Складіть молекулярні та йонні рівняння реакцій взаємодії купрум(ІІ) хлориду з представниками таких класів неорганічних речовин: а) кислот; б) лугів; в) солей.
6 Складіть рівняння електролітичної дисоціації таких електролітів: 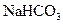 ,
, 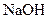 ,
, 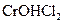 ,
, 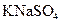 ,
,  ,
, 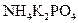 ,
, 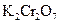 .
.
7 Складіть рівняння хімічних реакцій, які відбуваються між такими речовинами: а) 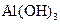 і
і  ; б)
; б) 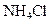 і
і 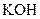 ; в)
; в) 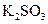 і
і 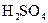 ; г)
; г) 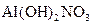 і
і  .
.
8 Складіть молекулярні рівняння хімічних реакцій за наведеними скороченими йонними:
а) 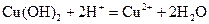 ;
;
б)  ;
;
в)  ;
;
г)  .
.
9 Складіть молекулярні та йонні рівняння реакцій взаємодії барій гідроксиду з представниками таких класів неорганічних речовин: а) кислот; б) амфотерних гідроксидів; в) кислотних оксидів; г) солей.
10 Складіть молекулярні та йонні рівняння реакцій взаємодії хлоридної кислоти з представниками таких класів неорганічних речовин, як: а) луги; б) амфотерні гідроксиди; в) метали; г) солі; д) основні оксиди.
Дата добавления: 2019-02-13; просмотров: 126; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

