Основные положения статистической термодинамики
Название «термодинамика» происходит от греческих слов «therme» — теплота и «dynamics» — сила и расшифровывается как «наука о силах, связанных теплом» (а не о движении тепла). Предметом термодинамики является исследование процессов, для описания которых требуется ввести понятие температуры. Феноменологическая термодинамика изучает связь между макроскопическими величинами, характеризующими систему, например между давлением, температурой и энергией, без описания микроскопических (атомных, молекулярных) явлений. Она опирается на строгие определения принятых понятий, прежде всего температуры и тепла, а также на несколько весьма общих аксиом, называемых законами термодинамики, установленных опытным путем. Статистическая термодинамика исходит из того, что большое число частиц в макроскопических телах приводит к появлению статистических закономерностей в поведении тел.
Тело и фаза. Тело — вещество, заполняющее определенный объем (вода, воздух, железо и т. д.), характеризующееся упругостью, плотностью, степенью нагретости и другими физическими признаками. Если эти признаки одинаковы, то тело физически однородно, неоднородность формулируется по определенному признаку (плотности, нагретости и т. д.). Если тело представляет смесь (а не химическое соединение), то говорят, что тело химически неоднородно. Воздух как смесь газов химически неоднороден. Химически неоднородное тело может иметь однородный состав, если во всех его участках разные вещества в смеси содержатся в одинаковой пропорции. Вследствие постоянства солевого состава морская вода может рассматриваться как двухкомпонентная смесь: чистая вода и соль.
|
|
|
Все признаки, характеризующие тело и имеющие объективную меру, называюттермодинамическими параметрами состояния тела. Состояние тела может быть изменено нагреванием, охлаждением, сжатием и т. п.
Физически однородное тело или совокупность нескольких тождественных по составу тел, находящихся в тождественных равновесных состояниях, обозначают термином «фаза». Тело называют фазой, если, разделив тело любым способом на произвольное число частей, можно обнаружить их тождественность. Лед, плавающий в воде — это две фазы. Одно и то же вещество (например, вода) может иметь несколько фаз, отличающихся кристаллической структурой (например, пар – вода – лед, 7 модификаций льда). Отметим, что существует 4 агрегатных состояния (жидкое, газообразное, твердое, плазменное), а фаз может быть множество (например, нефть в воде, обе жидкие).
Простейшие параметры : масса, объем, давление. Общая масса тела для термодинамики несущественна (она является основной для механики), и ее связывают с плотностью, под которой понимают отношение массы тела к его объему, т. е. массу, содержащуюся в единице объема. В термодинамике наибольший интерес вызывает изменение плотности (как результат сжатия, нагревания и т. д.), при этом масса остается прежней, а меняется объем тела. Следовательно, более удобен удельный объем, т. е. объем, занятый единицей массы (величина обратная плотности). Масса характеризует свойства инертности и проявляется при изменении состояния движения. В термодинамике вместо принятой в механике единицы массы (грамм, килограмм), чаще всего используется химическая единица массы — моль. Молемили грамм-молекулой называют количество вещества в граммах, совпадающее с молекулярным весом. Моль любого вещества содержит NA = 6,0247 *1023 молекул (число Авогадро). Для химически неоднородного вещества вводят средний (гармонический) молекулярный вес. Например, воздух (76% азот, 23% кислород, 1% аргон) имеет молекулярный вес 28,9.
|
|
|
В термодинамике при изучении систем подвижных тел рассматривают действующие на них силы, уравновешенные вокруг центра тяжести. Напряженность внешних сил измеряют давлением, которое силы производят на единицу поверхности тела.
|
|
|
В статистической термодинамике давление Р определяют как среднюю силу воздействия молекул на единичную площадку поверхности, окружающей объем.
Физические закономерности, возникающие в ансамблях однородных объектов (атомов, молекул), называются статистическими. Термин «газ», происходящий от слова «хаос», возник еще в XVII в. на основе атомистических представлений древних. В том же веке экспериментально был установлен закон Бойля — Мариотта:
Для данной массы газа при постоянной температуре произведение объема V на давление есть величина постоянная:
Р V = const (1)
Даниил Бернулли в 1730 г. сумел вывести этот статистический закон теоретически.
Предположим, что газ находится в ящике, одна стенка которого представляет поршень, способный перемещаться. Газ состоит из атомов, хаотически перемещающихся со скоростью U; составляющие вектора U обозначают через ux, uy, uz. Импульс — это произведение массы m на скорость U, и, по второму закону Ньютона, скорость изменения со временем количества  движения (импульса) пропорциональна силе F.
движения (импульса) пропорциональна силе F.
Пусть в объеме V заключено N атомов, а в единичном объеме
n = N/V атомов (2)
За одно соударение поршню сообщается импульс 2mux (удвоение произошло, так как частица отражается, следовательно, импульсы к поршню и от поршня равны mux). За время t ударят лишь те частицы, которые в начальный момент были расположены не дальше, чем на расстоянии uxt.
|
|
|
Пусть площадь поршня S, тогда атомы, которые ударят по поршню, занимают объем Suxt, число атомов — nuxSt, а за 1 с — nuxS.
Сила F = nuxS · 2 mux, а давление P = F/S= 2nmux2. Каждая молекула, ударяясь в поршень, вносит свой вклад; осредняя их, получим
P = nm < ux 2 > (3)
Отметим, что при осреднении (обозначаемом угловыми скобками) необходимо учесть 1/2 в ux2, так как нас интересуют лишь положительные ux. Исходя из того, что <ux2> = <uy2> = <uz2> получим
 |
 |
Теперь (3) будет иметь вид
где множитель K — кинетическая энергия молекул. Вспоминая (2), имеем (4).
Таким образом, исходя из простейших предпосылок:
— физические законы движения молекул (второй и третий законы Ньютона),
— стохастичность движения молекул газа,
теоретически выведен закон Д. Бернулли (1) и обоснована константа. Поскольку скорость движения молекул зависит только от температуры газа и так как в правой части (4) стоит кинетическая энергия, то и она должна быть функцией температуры.
Тепловое равновесие и температура. Температура является важнейшим термодинамическим параметром. Своим существованием температура как величина обязана статистической закономерности, господствующей над молекулярными явлениями. Законы статистики обусловливают особый вид равновесия — тепловое равновесие тел, а оно влечет представление о температуре. При теплообмене без теплового равновесия происходит изменение, по меньшей мере, одного из параметров состояния, не считая температуры. Если взять сколько угодно и каких угодно тел, обеспечить возможность теплообмена между ними и изолировать их от посторонних воздействий, то рано или поздно между ними установится тепловое равновесие. В процессе взаимного приспособления тел к тепловому равновесию их состояние меняется тем резче, чем меньше масса одного по сравнению с массой другого.
В физике приняты три всеобщих (но произвольных) эталона — сантиметр, грамм и секунда. Исходя из (4) нет необходимости во введении еще одной единицы (эталона) — градус (не уточняя Цельсия, Фаренгейта, Реомюра, Кельвина, Делиля), достаточно ввести условное вещество — идеальный газ. Например, температуре Т можно придать весьма простой физический смысл — она равна 2/3 средней кинетической энергии <K>:
 |
Из (5) видно, что Т — величина статистическая (для отдельной молекулы она не имеет смысла). Хотя Д. Бернулли не пытался выразить Р V через температуру, но в его работе уже содержится фраза «теплота есть движение молекул».
Учение о теплоте очень долгое время развивалось независимо от статистической физики, лишь в конце XIX в. получило обоснование. В 1877 г. международный комитет мер и весов установил нормальную шкалу эмпирической температуры: в качестве термометрического вещества — водород, в качестве термометрического параметра — давление, в качестве единицы измерения — градус Цельсия.
Термодинамика идеальных газов. Для разреженных газов справедливы законы Бойля, Гей-Люссака и Джоуля. По закону Бойля при изотермическом сжатии или расширении газа давление изменяется обратно пропорционально объему (1). По закону Гей-Люссака нагревание газа на 1ºС при постоянном давлении Р влечет за собой его расширение на 1/273,15 часть того объема V0, который он занимает при 0ºС и при том же давлении Р. Совместно эти законы дают уравнение Клайперона — Менделеева:
PV = νRT, (6)
где ν — число молей, содержащихся в объеме V, R — универсальная газовая постоянная, Т — абсолютная температура.
Числовое значение R зависит от выбора единиц для Р, V , T
при 0ºС (T0 = 273,15), Р0 в 1 атмосферу, V0 = ν · 22,41 л:
R = (Р0V0/273,15) = 0.08206 атм · л /град г · моль.
Теплоемкость системы — количество тепла dQ, которые надо сообщить замкнутой системе, чтобы увеличить ее температуру Т на один градус. Обычно рассматривают теплоемкость Ср при постоянном давлении и теплоемкость С v при постоянном объеме:
для одноатомных газов С V = 3/2 R » 3 кал;
для двухатомных газов С V = 5/2 R » 5 кал;
для многоатомных газов С V = 3 R » 6 кал. (7)
Для газов любой атомности справедливо уравнение Р. Майера:
С P - CV = R. (8)
К реальным газам применяют уравнение состояния:
(р + a / V 2 )( V – b ) = RT, (9)
предложенное в 1873 г. голландским физиком Ван-дер-Ваальсом. Оно отличается от (6) двумя поправками — объемной b и внутренним давлением a / V 2; для химических веществ а и b различны. Существует много других уравнений вида (9).
Первое начало термодинамики. Существует факт, управляющий всеми явлениями природы, — закон сохранения энергии. Он утверждает, что имеется определенная величина, называемая энергией, которая не изменяется ни при каких превращениях, происходящих в природе. В механике различают 4 формы передачи энергии: тяга, удар, волновая передача, конвекция. Под конвекцией понимают перенос веществом любого вида энергии.
Энергия разделяется на потенциальную энергию (тяготения), кинетическую (движения) и внутреннюю (тепловую).
В термодинамике передаваемая энергия разделяется на 2 части: на тепло и работу. Работа (в термодинамическом понимании) — это любая макрофизическая форма передачи энергии, а теплота представляет собой совокупность микрофизических передач энергии. Работа расширения — элементарная работа δА, выполняемая телом в процессе равновесного расширения. Она всегда равна произведению давления P на элементарное приращение объема dV:
δА = Р dV
Когда выполняется работа, имеется 2 тела: одно, развивающее силы и совершающее работу, другое, к которому эти силы приложены. Работа всегда совершается за счет запасов энергии и всегда на что-то затрачивается, т. е. вызывает какие-либо изменения в некотором другом теле. Первое тело отдает энергию, второе получает. Сам процесс работы есть процесс перехода энергии от одного тела к другому.
Точно также, когда проявляется теплота, имеется 2 тела: одно отдает энергию, другое получает. Внутренняя энергия тела является единственным видом энергии, имеющей статистическую основу, поэтому конвекция внутренней энергии всегда должна рассматриваться как перенос тепла.
Теплота и работа являются двумя единственно возможными формами перехода (способами передачи) энергии от одного тела к другому.
Теплота и работа — неравноценные формы передачи энергии. Работа непосредственно направлена на пополнение запаса любого вида энергии; теплота непосредственно (без промежуточного преобразования в работу) направлена на пополнение запаса только внутренней энергии.
Формы движения и виды энергии. Вид энергии — термин физики; форма движения — философское понятие (включая и биологию, и социальные науки). В области физики рассматривается неупорядоченное молекулярное (тепловое) движение, и ему соответствует особый вид энергии — внутренней.
В механике различают следующие виды энергии:
— энергия движения тел (поступательного, вращательного, колебательного);
— энергия положения тел в поле сил (электрических, магнитных, потенциальная энергия в поле тяготения);
— энергия упругой деформации тел (деформация растяжения, сжатия, сдвига).
В термодинамике различают внешнюю и внутреннюю энергии тел. Для внешней энергии различают следующее виды:
— энергия движения тела как целого;
— энергия положения тела в поле сил (с оговоркой, что термодинамическое состояние тела при перемещении в поле сил не изменяется).
Если же термодинамическое состояние при этом меняется, то определенная часть энергии положения при этом уже будет входить в состав внутренней энергии тела.
Внутреннюю энергию в термодинамике разбивают на две термодинамические составляющие:
— связанная энергия;
— свободная энергия.
Мерой связанной энергии является теплота, отдаваемая в изотермическом процессе. Мерой свободной энергии является работа, производимая телом при изотермическом процессе.
В прикладной физике различают механическую энергию, потенциальную энергию тяготения, внутреннюю энергию нагретых тел, акустическую энергию, лучистую энергию (подразделяя ее на энергию света, тепловое излучение, фотохимическую, рентгеновских лучей, космических лучей), электрическую энергию.
Внутренняя энергия. По закону Джоуля внутренняя энергия ε идеального газа пропорциональна абсолютной температуре:
ε=νС V Т (10)
где С V — теплоемкость при постоянном объеме, не зависящая ни от температуры, ни от плотности газа.
В слабо сжатых газах, где взаимодействие между молекулами проявляется лишь в их соударении, внутренняя энергия слагается из поступательного и вращательного движения молекул, а также и внутриатомной энергии.
В 1870 г. Максвелл вывел закон распределения по скоростям, а позднее — Больцман — по кинетическим энергиям.
Распределение Максвелла.
 |
Допуская, что проекции скорости молекул (ux , uy , uz) независимы, следовательно, их вероятности перемножаются
 |
Максвелл вывел законы одной (12) и трех (13) проекций скорости
где

Этот результат был проверен и экспериментально, используя разреженный газ и вращающиеся сосуды. В терминах распределения (13) формулируется понятие статистического равновесия (не меняющегося со временем).
Распределение Больцмана. Двухатомные молекулы (N2, H2, O2) имеют не только переносное движение, но и вращение вокруг центра тяжести. Поэтому их энергия
Е = Кпер + Квращ.
Для баланса энергии при столкновении молекул с энергиями Е1 и Е2 до удара и Е3, Е4 после удара необходимо, чтобы
Е1 + Е2 = Е3 +Е4
или с учетом (13)

где В коэффициент, нормирующий вероятность
Кинетическая энергия молекул и внутриатомная энергия от плотности газа почти не зависят и являются функцией одной лишь температуры. Это следует из закона равномерного распределения энергии по степеням свободы (Максвелл, 1860). Под числом степеней свободы подразумевают число независимых движений или число координат, которые определяют положение тела в пространстве.
Каждый одноатомный газ (аргон, гелий) имеет 3 степени свободы при независимых движениях в направлении трех взаимно перпендикулярных координат; каждая молекула трехатомного газа (пары воды) и многоатомного газа — 6 степеней свободы. Это является обоснованием соотношений (7).
 |
По закону Максвелла, каждая степень свободы движения молекулы (независимо от характера движения и химической природы вещества) в среднем обладает энергией
где k = R / NA = 1,38·10–16 эрг/град. — половина постоянной Больцмана, NA — число Авогадро.
В состав внутренней энергии входит часть гравитационной энергии, обусловленная внутренними силами тяготения молекулы, кроме того, входит лучистая энергия, обеспечивающая тепловое равновесие между отдельными участками тела.
Второе начало (закон деградации энергии). Невозможен процесс, имеющий единственным своим результатом превращение тепла в работу. В природе и технике превращение тепла в работу встречается столь же часто, как и переход работы в теплоту. На поверхности земного шара ветры, дожди, реки, водопады производят непрестанно работу за счет теплоты, которое доставляет Солнце.
Когда происходит преобразование A в Q, то можно ограничиться изменением термодинамического состояния только лишь в теплополучающем теле (например, нагревание путем трения). Когда происходит преобразование Q в A, то наряду с охлаждением теплоотдающего тела непременно происходит изменение термодинамического состояния еще одного или нескольких тел (оно называется компенсацией превращения Q в A).
Процесс, происходящий при постоянной температуре, называется изотермическим; процесс, происходящий в теплоизолированном цилиндре, когда сжатие и расширение происходит без теплообмена с окружающей средой и без нарушения теплового расширения газа, называют адиабатическим. Термин «адиабатический» образован от трех греческих слов а (не) + dia (сквозь) + bai - nein (проходить), в физике он употребляется в разных смыслах. Поэтому требуется всегда уточнить его смысл.
Давление и температура определены путем усреднения молекулярных микроскопических величин. Давление есть средний импульс, переданный стенке при ударах отдельных молекул, температура связана со средней энергией молекул. Начиная с первых шагов кинетической теории механические явления рассматривались как первичные, а термодинамические — как вторичные. Клаузиус в 1865 г. придал феноменологической термодинамической теории завершенную форму, введя новую функцию состояния — энтропию (от греческого «эволюция»).Он осознал, что в основу тепловых явлений необходимо положить два принципа, один из которых выводится из эквивалентности механической и тепловой энергий, а второй — из необратимости процессов превращения тепла в механическую работу. Все так называемые необратимые процессы в природе типа
— теплопроводности (выравнивание разности температур),
— вязкости(выравнивание разности скоростей),
—диффузии (выравнивание разности плотностей)
сопровождаются рассеянием механической энергии.
Изменение энтропии в замкнутой системе есть мера необратимости свершившихся в ней процессов. Посредством энтропии h температура Т связана с количеством тепла dQ, получаемым системой при обратимых процессах, соотношением
dQ = Tdh;
для необратимых процессов справедливо соотношение в форме неравенства
dQ £ Tdh.
Клаузиус сформулировал второе начало термодинамики в форме следующих утверждений:
— энтропия является однозначной функцией состояния.
— элемент тепла при равновесном процессе, деленный на абсолютную
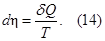 |
температуру тела, является полным дифференциалом энтропии
Фундаментом кинетической теории явилось представление об атомах и молекулах с их механическими свойствами, все же физические явления- это результат сложных взаимодействий многоатомных систем. Для вывода теории тепловых процессов потребовалось предположение о распределении вероятностей событий на атомно-молекулярном уровне. Это стало очевидным лишь в результате установления Больцманом фундаментальной связи между термодинамической энтропией и вероятностью реализации термодинамического состояния, выраженной через число микросостояний.
Функции распределения систем взаимодействующих частиц. Динамическое состояние каждой частицы определяется заданием ее координаты q и импульса р, где под q и p понимается совокупность трех декартовых координат и проекций импульса, а состояние системы — заданием совокупности координат q1…qN и импульсов р1…р N всех частиц, или точкой в 6N-мерном фазовом пространстве.
Динамическая эволюция системы определяется уравнениями
 |
Функция Н называется функцией У. Гамильтона (1834) или обобщенной полной энергией. Следуя Гиббсу, рассматривают совокупность большого (в пределе — бесконечного) числа копий, т. е. вводят статистический ансамбль, «представляющий» макроскопическое состояние системы. Каждая макроскопическая величина G(x, y, z) в трехмерном физическом пространстве может быть представлена как результат усреднения динамических функций g(p, q) координат фазового пространства. Больцман рассматривал макроскопические величины, измеряемые в конечные интервалы времени, т. е.
 |
В дальнейшем задача усреднения по траектории привела к проблеме устойчивости траекторий динамических систем и развитию эргодической теории. Решение этих задач потребовало использования понятия меры конечной области фазового пространства (меры Лебега). Концепция меры m в эргодической теории и в теории вероятностей позволила интерпретировать g как случайную переменную.
Множество комбинаций конфигураций и скоростей g(p, q) называется ансамблем с плотностью f(p, q), а мера области в фазовом пространстве интерпретируется как вероятность нахождения системы в данной области. Теперь макроскопическая динамическая величина определяется как среднее значение
 |
В эргодической теории усреднение по времени (15) может быть заменено усреднением по энергетической поверхности ансамбля (16).
Поскольку (16) можно рассматривать как первичное определение G, то ансамбль G не требует дополнительного обоснования. Дальнейшая эволюция распределений строго определяется законами гамильтоновой механики:
 |
где […] символ, названный «скобками Пуассона».
Решение (17) записывается в виде

где оператор U определяет преобразование.
В результате последовательных канонических преобразований exp[–(H)t] временная зависимость от функций g(p, q, t) переходит к функции распределения f(p, q), так как f(p, q, t) = exp[–(H)t] f(p, q),
Теперь (16) можно переписать в виде
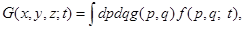
где зависимость от времени определяется эволюцией состояния системы, тогда как динамические функции заданы и постоянны во времени.
Записав уравнение эволюции функции распределения в виде

получим основное уравнение статистической механики — уравнение Лиувилля.
Любая функция гамильтониана Н, а также любая функция интегралов движения системы типа полного импульса, полного момента количества движения дает стационарное решение уравнения (18).
Системы, значение энергии которых строго фиксировано, а движение их в фазовом пространстве происходит по поверхности постоянной энергии, описывается микроканоническим ансамблем. Этот ансамбль дает удобный способ построения равновесного ансамбля, исходя из принципа одинаковых априорных вероятностей.
Простейшей системой является изолированная, которая не взаимодействует с окружающим миром и характеризуется постоянной энергией, точнее полная энергия, заключена между значениями Е и Е + DЕ, причем Е >> DЕ. Эта система имеет конечный объем V и число частиц N весьма велико (порядка 1023). Основной постулат равновесной статистической механики состоит в том, что этим условиям отвечает огромное число собственных состояний и у нас не имеется никаких доводов, чтобы отдать предпочтение какому-нибудь одному из них — т. е. все такие состояния одинаково хорошо совместимы с имеющейся информацией о системе. Принцип равенства априорных вероятностей (Толмен, 1938) состоит в том, что каждое из собственных состояний с равной вероятностью является реализацией макроскопического состояния системы. Число таких возможных состояний обозначим через W, т. е.
W = W(E; dE; N, V)= W(E; dE),
параметры N, V, как правило, явно не записывают. Значения Е и DЕ определены через гамильтониан Н.
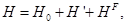 |
В общем случае
где первый член — свободное движение частиц, второй — взаимодействие между частицами, третий — воздействие внешнего поля.
Канонический ансамбль соответствует системам, находящимся во взаимодействии со своим окружением либо посредством обмена различными формами энергии
(механической и тепловой), либо посредством обмена веществом (в этом случае используют терминбольшой канонический ансамбль).
Энергия Е состоит из
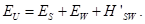
В левой части — энергия «вселенной» U, в правой части слагаемые обозначают энергию подсистемы S, «окружения» W и взаимодействия систем S u W.
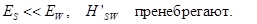
Большинство систем этого ансамбля группируется в окрестности <E>.
Если допустить, что вся «вселенная» U представлена микроканоническим ансамблем, то подсистема S с вероятностью pm находится в m состоянии, характеризуемом значением энергии Em, зависящем от Vs и Ns.
 |
Внешний мир W находится в любом из многочисленных состояний с энергией
 |
Число таких состояний равно
Эта величина совпадает с числом конфигураций всей «вселенной» U, в которых подсистема S находится в состоянии m с энергией Em. Тогда в силу постулата о равных вероятностях, все конфигурации, учитываемые в WW, равновероятны и

Замена Е S на Е m позволяет разложить числитель в (19) или, для лучшей сходимости, его логарифм, в окрестности Е U, оставив лишь линейный член:

Следовательно,

 |
или, с учетом
 |
Статистическая сумма Z явным образом зависит от b, а также от числа частиц N и объема V системы — через значения энергетических уровней Е m.
Исходя из (23) классическое каноническое распределение записывается в виде

Связь между статистической механикой и термодинамикой осуществляется путем построения специального термодинамического процесса, который позволяет вычислить некоторую функцию A(T, V, N) через статистическую сумму Z:

Функция А(·) имеет смысл свободной энергии и является термодинамическим потенциалом, через который можно вычислить все остальные термодинамические функции.
Большой канонический ансамбль. Рассмотрим изолированную систему с энергией EU и с числом частиц NU. Вероятность нахождения подсистемы, содержащей N частиц, в квантовом состоянии m с энергией EMn:
 |
 |
Если подсистема мала, EmN << EU, N << NU, то допустимо разложение

Следовательно, распределение pmN имеет вид (26), функция X, зависящая от параметров b, m, а также (неявно) от V, представляет собой обобщение статистической суммы Z и ее называют большой статистической суммой:

 |
Большой канонический ансамбль соответствует открытой системе, в которой число частиц может меняться. В термодинамике условие равновесия между открытыми системами требует равенства не только температур, но и химических потенциалов m. Химический потенциал — интенсивная величина, определяемая через свободную энергию А и наблюдаемое число частиц <N>

Функция m<N> представляет собой свободную энтальпию (энергия Гиббса) G.
Статистическое истолкование энтропии. Самопроизвольное превращение работы в теплоту, сопровождающее неравновесные процессы, связано с переходом упорядоченного организованного движения частиц системы в беспорядочное хаотическое движение. Это дает возможность установить связь энтропии и степенью беспорядка в системе.
Беспорядочное движение, когда в каждый момент времени для каждой частицы все направления движения в равной мере возможны, является более вероятным движением, чем организованное, вызванное определенными условиями. Поэтому организованное движение стремится перейти в неорганизованное и соответственно изолированная система стремится перейти из менее вероятного состояния, при котором возможно организованное движение, в более вероятное.
 |
Пусть ei — внутренняя энергия системы в микросостоянии i (полная механическая энергия частиц); вероятность этого состояния — рi; данному макросостоянию термодинамической системы соответствует конечное число W возможных микросостояний. Тогда внутренняя энергия

Пусть рk — дискретное распределение вероятностей событий.
 |
Информационной (шенноновской) энтропией называется величина
Максимальный беспорядок при pk = 1/W, тогда
h = k ln W,
идеальный порядок, когда pk = 1, ln pk = 0 и h = 0.
Больцман подсчитал вероятность различных состояний исходя из относительного числа способов, которыми могут быть реализованы эти состояния. Фазовое пространство делится на очень большое число ячеек равной величины, и предполагается, что нахождение молекулы в любой такой ячейке равновозможно. Каждая из N молекул газа обладает квантованным значением энергии 0, e, 2e, …, рe. Пусть w0, w1, …, wр — число молекул, обладающих энергией re, r = 0, .. .p. Вероятность термодинамическая есть число
 |
Наиболее вероятным будет
 |
Преобразуя эти выражения по формуле Стирлинга, получим
Связь между энтропией и вероятностью состояния для идеального газа установил в 70-х годах XIX в. Больцман. Общее статистическое обоснование термодинамики — это заслуга Дж. У. Гиббса.
Гиббсовской энтропией называют средний логарифм функции распределения
 |
со знаком минус, т. е. среднее значение h:
Подходы Больцмана и Гиббса различаются исходными принципами в подсчете W, так как рассматриваются в методе
— Больцмана — 6-мерное пространство координат и импульсов, в котором точка изображает состояние отдельной молекулы тела;
— ансамблей Гиббса — многомерное фазовое пространство и движение точки в этом пространстве, изображающей состояние системы.
Макросостояние равновесной системы массы m полностью определяется заданием ее внутренней энергии  , объема V и масс mk различных веществ.
, объема V и масс mk различных веществ.
 |
Параметрами равновесной термодинамической системы является температура системы Т и химические потенциалы µ отдельных компонентов системы:
Пусть теперь внешние условия медленно меняются, характерное время этих изменений значительно больше времени релаксации системы (время перехода в равновесное состояние). Такие процессы называют равновесными или обратимыми:
 |
Это соотношение Гиббса, одно из основных в термодинамике.
 |
Из (14) и ( 32) следует, что
Термодинамические потенциалы
В 1902 году Гиббс Дж. Виллард (1839-1908) пишет работу "Основные принципы статистической механики", в которой он систематизировал результаты, обосновал свойства ансамблей, ввел понятие вероятности системы. Им же развит метод потенциалов.
Состояние термодинамической системы определяется совокупностью всех физических величин, характеризующих свойства макроскопической системы ; их называют термодинамическими параметрами – внешними и внутренними.
Внешние – это параметры, зависящие только от обобщенных координат внешних тел, с которыми взаимодействует система (объем системы, напряженность силового поля).
Внутренние – это параметры (величины), определяемые как совокупным движением и распределением в пространстве входящих в систему частиц, так и значениями внешних параметров . т.к. пространственное расположение атомов и молекул зависит от обобщенных координат внешних сил ( пример, плотность, давление, энергия и др.)
Внутренние делят на
- Интенсивные, не зависящие отмассы и изменяющиеся от точки к точке ( давление, температура, вязкость);
- Экстенсивные – пропорциональные массе и характеризующие систему как целое (энергия, энтропия, энтальпия и др.).
Всякое изменение в термодинамической системе означает, что в ней протекает термодинамический процесс. Процесс перехода из неравновесного состояния в равновесное называют релаксацией. Необратимый процесс есть переход системы из менее вероятного к более вероятному состоянию.
Функцией состояния является любая величина, значение которой зависит только от состояния системы. Различают экстенсивные и интенсивные функции состояния. Экстенсивные величины, отнесенные к единице количества вещества системы называют удельными.
Удельные экстенсивные величины являются интенсивными величинами.
Физические величины, изменяющие свое значение при наличии обмена энергией в определенной форме и сохраняющие свое значение при отсутствии этой формы обмена энергией (даже если обмен энергией в других формах и происходит) называются координатами состояния обобщенными координатами) системы. Изменение соответствующей координаты состояния является признаком наличия взаимодействия данного рода. Координаты состояния являются экстенсивными величинами.
Другая группа физических величин, характеризующих взаимодействие, получила название потенциалов взаимодействия (обобщенных сил). Потенциалом взаимодействия в термодинамике называют физическую величину, различие значений которой внутри системы и в окружающей среде приводит к возникновению обмена энергией.
Деформационное взаимодействие (т.е. передача энергии в форме механической работы возникает только, если силы (давление) действующие на границе системы изнутри и извне, не равны между собой. Механическим потенциалом является абсолютное давление.
Тепловое взаимодействие осуществляется вследствие различия в температурах системы и окружающей среды. Тепловым потенциалом является абсолютная температура.
Потенциалы величины интенсивные.
Устойчивое термодинамическое равновесие достигается, если вариация функции (40) равна 0 . Эту функцию z он назвал изобарно-изотермическим потенциалом.
Гиббс установил, что термодинамические свойства системы полностью можно описать еще тремя функциями, обладающими свойствами термодинамического потенциала:
- внутренней энергией e (адиабатический потенциал),
- свободной энергией y (изотермический потенциал),
- тепловой функцией c (энтальпия)

В химическую термодинамику Гиббс ввел еще одну функцию m, названную химическим потенциалом (33), характеризующую причину химических и фазовых превращений. Его значение нельзя непосредственно определить измерением с помощью какого-либо прибора.
Однако его, как и энтропию, можно вычислить через другие измеряемые величины.
Термодинамика и статистика теплового излучения.
До сих пор термодинамика занималась свойствами вещества, принципиально новым явилось исследование свойств теплового излучения.
Впервые темные линии солнечного спектра наблюдал английский химик и врач Волластон в 1802г. Немецкий физик Фраунгофер вторично открыл их в 1814г.
Кирхгоф Густав Роберт (1824-1887) сделал 6.10.1859г. сообщение в Берлинской АН "О фраунгоферовых линиях". "Темные линии солнечного спектра, не вызванные земной атмосферой, возникают вследствие присутствия в раскаленной атмосфере Солнца тех же веществ, которые дают в спектре пламени на том же месте светлые линии". Этим он положил начало спектральным исследованиям термодинамики излучения. Уже через 3 недели (27.10.1859), он делает второе сообщение "О взаимосвязи между испусканием и поглощением света и тепла", где показал, что объяснение им фраунгоферовых линий является частичным следствием общего закона "для лучей одной и той же длины волны при одной и той же температуре отношение между способностями излучения и поглощения во всех точках одинаково". Он ввел понятие "об абсолютно черном теле", которое при бесконечно малой толщине при любой температуре полностью поглощает падающие на него лучи.
Следующий шаг был сделан только через 20 лет Стефаном Йозефом (1835-1893). В 1874г. в работе "О связи между тепловым излучением и температурой" привел формулу:

описывающую количество теплоты Q, которое термометр при температуре Т испускает с единицы поверхности в единицу времени.
В 1884г. Больцман в статье "Вывод закона Стефана, выражающего зависимость теплового излучения от температуры на основе электромагнитной теории света" обосновал закон, который теперь называется законом Стефана-Больцмана.
Распределением энергии в спектре теплового излучения экспериментально занимался С.Ланглей, а теоретически В.А.Михельсон, опубликовавший свои результаты на русском, французском и английском языках. На основе распределения Максвелла он статистически обосновал распределение энергии в спектре Ланглея. В частности, энергия распределяется по длинам волн неравномерно, причем максимум энергии приходится на определенную частоту.
Вильгельм Вин (1864-1928) в 1893г. в работе "Некоторая новая связь излучения чёрных тел со вторым началом термодинамики распространил понятие энтропии и температуры на тепловое излучение. Плотность лучистой энергии (41) обратно пропорцианальна пятой степени l, где f(lT) - неизвестная функция. Согласно Вину, если lmax - длина волны, несущая максимум энергии, то имеет место закон (42). В 1896 г.,следуя Михельсону, Вин применяет статистику и получает функцию распределения энергии в виде (43)

Дальнейший шаг в теории изучения был сделан Рэлеем Джан Уильям (1842-1919),благодаря найденному им закону равномерного распределения энергии по степеням свободы. Найденный Вином закон не соответствовал экспериментальным данным в области длинных волн. Для плотности излучения электромагнитных волн им получено выражение:

Джинс Джемс Хонвид (1877-1946) исправил ошибку Релея и закон(44) стал называться законом Релея-Джинса.
Планк Макс Карл Эрнст Людвиг (1858-1947), исходил из предположения, что элементарный обмен энергией является дискретным процессом. Больцман дискутируя с Планком, писал «Так же как и в теории газов можно и в излучение ввести вероятное состояние,при котором волны не упорядочены, а различным образом взаимодействуют между собой».
14.12.1900г. Планк назвал днём рождения квантовой теории. Основными ее положениями являются:
- величина кванта энергии пропорционально частоте излучения,
- энтропия осцилляторов описывается выражением:

где k и  - универсальные постоянные.
- универсальные постоянные.

Используя (47) он нашел, что (48) и следовательно средняя энергия осциллятора равна (49):
Прямыми опытами Луммера и Принегейма, Рубенса и Кургбаума установлено, что распределение энергии излучения для малых энергий пропорционально первой степени энергии, а для больших - квадрату энергии, этому удовлетворяет формула (50) Из формулы Планка как следствие вытекали закон Стефана-Больцмана, закон смещения Вина, распределение Вина и Рэлея-Джинса. Гипотеза Планка трактовала энергетический обмен как прерывный (дискретный), а классическая теория излучения - как непрерывный процесс.
Возникновение и развитие квантовой статистики.
Открытие квантовой природы излучения сыграло большую роль в развитии статистической физики. Луи де Бройль в статье "Кванты, кинетическая теория газов и принцип Ферма" (1923г.) развивает квантовую теорию газа на основе гипотезы о волнах материи. Он утверждал, что одна теория квантов не может решить вопрос о природе света, поскольку явления интерференции и дифракции определенно требуют введения понятия волны. Подчеркивая, что свет обладает "странной двойственностью", он пишет: "По-видимому, настал момент попытаться согласовать корпускулярные и волновые представления и несколько углубить понимание истинной сущности кванта".
В 1924г. С.Н.Бозе прислал Эйнштейну рукопись статьи "Закон Планка и гипотеза световых квантов", в которой он предложил свой вывод формулы Планка для фотонов, разделив фазовый объем V на ячейки размером h3 (исходя из принципа тождественности, неразличимости частиц).
Эйнштейн распространил метод Бозе с фотонов на энтропию равновесного состояния (51):

свободную энергию системы (52), давление (53), где L - число ячеек, n - число молекул, Е- средняя энергия молекулы, А и В - постоянные..
Таким образом, было показано:
- соотношение между кинетической энергией и давлением оказывается таким же как и в классической теории,
- для идеальных газов выполняется теория Нернста.
Квантово-статистическое обоснование теоремы Нернста показало, что её нельзя рассматривать в качестве третьего независимого постулата термодинамики, т.к. она является следствием квантовых свойств в поведении газа вблизи абсолютного нуля и статистического принципа Больцмана.
Эйнштейн показал, что:

Таким образом, обосновал важное положение "вплоть до очень низких температур классическая теория правильно описывает поведение идеального газа".
Функция распределения статистики Бозе-Эйнштейна записывается в виде (55), где bkT=1.Одним из выводов, который следует из неё, состоит в том, если уравнение состояния идеального газа отнести к классической теории, то функция распределения должна иметь вид exp(-n), а если к квантовой теории, то (en-1)-1.
Уравнения состояния и уравнения процесса.
Первые имеют вид  ,
,
Вторые  Эти два фундаментальных уравнения составляют аппарат термодинамического анализа свойств веществ. Характеристические функции представляют собой функции состояния, через которые, если они являются функциями определенных независимых переменных, могут быть выражены все термодинамические свойства системы. Из уравнений определяет внутреннюю энергию как функцию энтропии и объема, она является характеристической и через нее могут быть выражены термодинамические свойства термомеханической системы
Эти два фундаментальных уравнения составляют аппарат термодинамического анализа свойств веществ. Характеристические функции представляют собой функции состояния, через которые, если они являются функциями определенных независимых переменных, могут быть выражены все термодинамические свойства системы. Из уравнений определяет внутреннюю энергию как функцию энтропии и объема, она является характеристической и через нее могут быть выражены термодинамические свойства термомеханической системы
Одной из задач термодинамики является установление теоретической связи между двумя различными группами свойств вещества- термическими и калориметрическими величинами. Явное выражение этих величин как функций независимых переменных называется уравнениями состояния.
Термическое уравнение состояния имеет вид
Bk=Bk(T,b1,..,bm) (56),
где Bk- коэффициенты, bk-внешние параметры (числа), выбираемые так, что их изменение связано с работой над системой

Т – температура ( особый параметр, не входящий в число внешних).
На Bk и bk накладываются условия квазистатичности процессов, а также независивости Bk от координат точек внутри системы

Пример: bk=V,Bk=P, dA=PdV.
К термическим величинам относятся коэффициент теплового расширения (¶V/¶T)P коэффициент (¶P/¶T)V, сжимаемость (¶V/¶P)T.
Калориметрическое уравнение состояния имеет вид
e=e(T,b1,..,bm) (58)
где e-внутренняя энергия системы,

Разная природа величин видна при сравнении (59) и (57), в (59) фигурируют приращения всех независимых внешних параметров bк и температуры Т; в (57) нет приращения, связанного с изменением температуры, поэтому dA не есть полный дифференциал, а de- полный.
Пример: внутренняя энергия излучения черного тела 
В гидродинамике есть как термическая величина (давление), так и калориметрическая (внутренняя энергия).
Первое начало не дает определенного ответа о связи калориметрических и термических величин, т.к. помимо указанных de и dA, содержит еще и новую величину – количество теплоты 
Второе начало для квазистатических процессов благодаря введению энтропии h позволяет установить такую связь:
Гельмгольц, введя свободную энергию системы в виде (39)
показал, что y является характеристической функцией, зная которую можно вычислить калориметрические и термические величины, т.к. 
Дата добавления: 2019-02-12; просмотров: 1104; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
