Отборочный (районный) этап. Практический тур
Класс
I вариант
1)Уравнения реакций:
KCl + AgNO3 = AgCl↓(белый осадок) + KNO3
NH4Cl + AgNO3 = AgCl↓(белый осадок) + NH4NO3
KI + AgNO3 = AgI↓(жёлтый осадок) + KNO3
K3PO4 + 3AgNO3 = Ag3PO4↓(жёлтый осадок) + 3KNO3
NH4Cl + NaOH = NH3↑ + H2O + NaCl
4KI + 2CuCl2 = 2CuI↓ + I2↓(коричневая смесь осадков) + 4KCl
2K3PO4 + 3CuCl2 = Cu3(PO4)2↓(голубой осадок) + 6КCl
2) Правильное определение содержимого всех стаканчиков:
1 – KCl, 2 – NH4Cl, 3 – KI, 4 – K3PO4.
II вариант
1)Уравнения реакций:
K2SO4 + Pb(OOCCH3)2 = PbSO4↓(белый осадок) + 2KOOCCH3
2KCl + Pb(OOCCH3)2 = PbCl2↓(белый осадок) + 2KOOCCH3
2NaI + Pb(OOCCH3)2 = PbI2↓(жёлтый осадок) + 2NaOOCCH3
Na2CO3 + Pb(OOCCH3)2 = PbCO3↓(белый осадок) + 2NaOOCCH3
PbCO3 + 2HNO3 = CO2↑ + H2O + Pb(NO3)2
2KCl + H2SO4(конц.) = 2HCl↑ + K2SO4
3NaI + 2FeCl3 = 2FeCl2 + Na[I3](коричневый раствор) + 2NaCl
2) Правильное определение содержимого всех стаканчиков:
1 – K2SO4, 2 – KCl, 3 – NaI, 4 – Na2CO3.
Класс
I вариант
1) Точке конца титрования соответствует переход окраски из красной в синюю. Следовательно, объем титранта, пошедшего на анализ, составляет 10,8 мл.
Поскольку образующийся комплекс имеет состав 1:1, количество ионов жесткости в аликвоте равно количеству трилона, пошедшего на титрование: n = 0,025×10,8 = 0,27 мкмоль. Соответственно, в 1 л исследуемого раствора будет содержаться в 1000/20 = 50 раз больше ионов жесткости: С = 0,27×50 = 13,5 мкмоль/л (1,35×10-2 ммоль/л).
Оценим погрешность определения. Как было указано, результаты сходились в пределах 0,1 мл. Этой величине соответствует изменение концентрации0,1×0,025/20 = 0,125 мкмоль/л. Тогда правильный ответ: (1,35 ± 0,01)×10-2 ммоль/л.
|
|
|
2) В сильнощелочном растворе выпадут гидроксиды металлов. В сильнокислом – происходит гидролиз (протонирование) аниона тетрааминоуксусной кислоты.
II вариант
1) Поскольку образующийся комплекс имеет состав 1:1, количество ионов меди в аликвоте равно количеству трилона, пошедшего на титрование:n = 0,025×10,3 = 0,2575 мкмоль. Соответственно, в 1 л исследуемого раствора будет содержаться в 1000/20 = 50 раз больше ионов меди:С = 0,2575×50 = 12,875 мкмоль/л (1,29×10-2 ммоль/л).
Оценим погрешность определения. Как было указано, результаты сходились в пределах 0,1 мл. Этой величине соответствует изменение концентрации0,1×0,025/20 = 0,125 мкмоль/л. Тогда правильный ответ: (1,29 ± 0,01)×10-2 ммоль/л.
2) Синий цвет обусловлен образованием амминокомплексов меди.
3) В сильнощелочном растворе выпадут гидроксиды металлов. В сильнокислом – происходит гидролиз (протонирование) аниона тетрааминоуксусной кислоты.
Класс
I вариант
1) Определим концентрации ионов железа в растворах, для которых измерялась оптическая плотность:С = С0*V/V0, где С0 и V0 – концентрация ионов железа в исходном растворе (0,01 мг/мл) и объем исходного раствора, а С и V – молярная концентрация ионов железа в растворе, подготовленном для измерений, и объем этого раствора (100 мл).Тогда таблица оптических плотностей для стандартных растворов приобретает вид:
|
|
|
| Объем исходного раствора соли железа, мл | Концентрация ионов железа в фотометрируемом растворе, мг/мл | Оптическая плотность |
| 1 | 1×10-6 | 0,08 |
| 2 | 2×10-6 | 0,21 |
| 4 | 4×10-6 | 0,32 |
| 6 | 6×10-6 | 0,54 |
| 8 | 8×10-6 | 0,76 |
| 10 | 1×10-5 | 0,84 |
По этим данным можно построить калибровочный график:
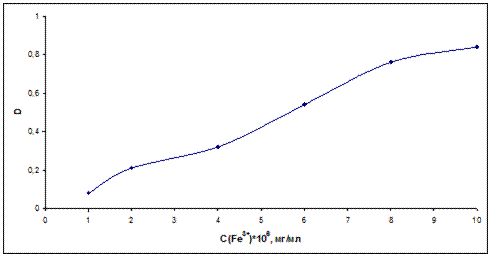
2) Для повышения точности анализа дальнейшую обработку желательно проводить в пределах линейного участка калибровочного графика, т.е., при значениях оптической плотности 0,3 – 0,76. Анализ зависимости позволяет вывести уравнение:
D = 1100×Ссоли железа – 0,12
Поскольку значение оптической плотности, полученное в ходе первого эксперимента (0,87) выходит за пределы линейного участка, расчет будем проводить по второму значению (0,58). Решая приведенное выше уравнение получаем, что концентрация ионов железа в фотометрируемом растворе составляет 6.4×10-4 мг/мл. Учитывая разбавление, получаем концентрацию ионов железа в исследуемом растворе:
С = 6,4×10-4 ×100/2,5 × 250/20 = 0,32 мг/мл
|
|
|
3) Подкисление исходного раствора проводили, чтобы избежать гидролиза ионов железа.
II вариант
1) Определим концентрации ионов кобальта в растворах, для которых измерялась оптическая плотность:С = С0*V/V0, где С0 и V0 – концентрация ионов кобальта в исходном растворе (25 мкг/мл) и объем исходного раствора, а С и V – молярная концентрация ионов кобальта в растворе, подготовленном для измерений, и объем этого раствора (100 мл).Тогда таблица оптических плотностей для стандартных растворов приобретает вид:
| Объем исходного раствора соли кобальта, мл | Концентрация ионов кобальта в фотометрируемом растворе, мкг/мл | Оптическая плотность |
| 0,5 | 0,125 | 0,34 |
| 1 | 0,25 | 0,48 |
| 2 | 0,50 | 0,60 |
| 3 | 0,75 | 0,72 |
| 4 | 1,00 | 0,84 |
| 5 | 1,25 | 0,92 |
По этим данным можно построить калибровочный график:
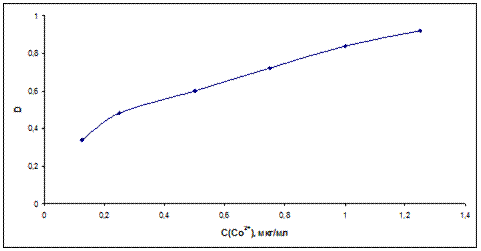
2) Для повышения точности анализа дальнейшую обработку желательно проводить в пределах линейного участка калибровочного графика, т.е., при значениях оптической плотности 0,5 – 0,8. Анализ зависимости позволяет вывести уравнение:
D = 0,48×Ссоли кобальта + 0,36
Поскольку значение оптической плотности, полученное в ходе первого эксперимента (0,94) выходит за пределы линейного участка, расчет будем проводить по второму значению (0,50). Решая приведенное выше уравнение получаем, что концентрация ионов кобальта фотометрируемом растворе составляет 0,29 мкг/мл. Учитывая разбавление, получаем концентрацию ионов железа в исследуемом растворе:
|
|
|
С = 0,29 ×100/2 × 250/20 = 181,25 мкг/мл
3) Подкисление исходного раствора проводили, чтобы избежать гидролиза ионов кобальта.
Дата добавления: 2019-01-14; просмотров: 257; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
