Автор задания – Скрипкин М.Ю.
I вариант
Описание эксперимента:
Для определения содержания малых количеств ионов металлов в растворе нередко применяют метод фотометрии, основанный на зависимости интенсивности окраски раствора от концентрации определяемого иона. Количественной характеристикой интенсивности окраски служит оптическая плотность D – величина, прямо пропорциональная концентрации окрашенных частиц С (моль/л) и толщине кюветы l (см): D = e*C*l, где e – молярный коэффициент поглощения.
Одним из примеров применения фотометрического метода является определение железа (III) с сульфосалициловой кислотой (С7Н6SO6):
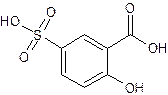
Для проведения анализа вначале приготовили подкисленный серной кислотой раствор, содержащий 0,01 мг железа(III) в 1 мл раствора, и 20% раствор сульфосалициловой кислоты. В мерные колбы объемом 100 мл внесли 1, 2, 4, 6, 8 и 10 мл раствора соли железа, довели рН до 6-8 и добавили в каждую колбу по 2 мл раствора сульфосалициловой кислоты. Довели раствор в колбах до метки. После этого измерили оптическую плотность растворов при длине волны 420 нм в кюветах толщиной 1 см относительно пустой кюветы. Результаты приведены в таблице ниже:
| Объем исходного раствора соли железа, мл | Оптическая плотность |
| 1 | 0,08 |
| 2 | 0,21 |
| 4 | 0,32 |
| 6 | 0,54 |
| 8 | 0,76 |
| 10 | 0,84 |
Аликвоту анализируемого раствора 20 мл перенесли в мерную колбу объемом 250 мл и разбавили раствор водой до метки. После этого отобрали с помощью мерной пипетки 5 мл полученного раствора, перенесли в мерную колбу объемом 100 мл, добавили 2 мл раствора сульфосалициловой кислоты, довели рН до 6-8 и добавили воды до метки. Измерили оптическую плотность раствора при длине волны 420 нм в кювете толщиной 1 см относительно пустой кюветы. Значение оптической плотности составило 0,87.
|
|
|
Эксперимент повторили эксперимент, взяв вместо 5 мл исследуемого раствора 2,5 мл. Тогда значение оптической плотности составило 0,58.
Задание:
1. На основании данных об оптической плотности стандартных растворов постройте калибровочный график (зависимость оптической плотности от концентрации раствора).
2. Рассчитайте концентрацию ионов железа в анализируемом растворе.
3. Для чего требуется подкислять исходный раствор соли железа?
II вариант
Описание эксперимента:
Для определения содержания малых количеств ионов металлов в растворе нередко применяют метод фотометрии, основанный на зависимости интенсивности окраски раствора от концентрации определяемого иона. Количественной характеристикой интенсивности окраски служит оптическая плотность D – величина, прямо пропорциональная концентрации окрашенных частиц С (моль/л) и толщине кюветы l (см): D = e*C*l, где e – молярный коэффициент поглощения.
|
|
|
Одним из примеров применения фотометрического метода является определение кобальта с нитрозо-Р-солью:
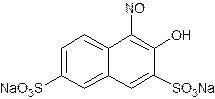
Для проведения анализа вначале приготовили подкисленный серной кислотой раствор, содержащий 25 мкг кобальта в 1 мл раствора, и 0,1% раствор нитрозо-Р-соли. В мерные колбы объемом 100 мл внесли 0.5, 1, 2, 3, 4 и 5 мл раствора соли кобальта, довели рН до 6-8 и добавили в каждую колбу по 2 мл раствора нитрозо-Р-соли. Довели растворы в колбах до метки. После этого измерили оптическую плотность растворов при длине волны 400 нм в кюветах толщиной 1 см относительно пустой кюветы. Результаты приведены в таблице ниже:
| Объем исходного раствора соли кобальта, мл | Оптическая плотность |
| 0,5 | 0,34 |
| 1 | 0,48 |
| 2 | 0,60 |
| 3 | 0,72 |
| 4 | 0,84 |
| 5 | 0,92 |
Аликвоту анализируемого раствора 20 мл перенесли в мерную колбу объемом 250 мл и разбавили раствор водой до метки. После этого отобрали с помощью мерной пипетки 5 мл полученного раствора, перенесли в мерную колбу объемом 100 мл, добавили 4 мл раствора сульфосалициловой кислоты, довели рН до 6-8 и добавили воды до метки. Измерили оптическую плотность раствора при длине волны 400 нм в кювете толщиной 1 см относительно пустой кюветы. Значение оптической плотности составило 0,94.
|
|
|
Эксперимент повторили эксперимент, взяв вместо 4 мл исследуемого раствора 2 мл. Тогда значение оптической плотности составило 0,50.
Задание:
1. На основании данных об оптической плотности стандартных растворов постройте калибровочный график (зависимость оптической плотности от концентрации раствора).
2. Рассчитайте концентрацию ионов кобальта в анализируемом растворе.
3. Для чего требуется подкислять исходный раствор соли кобальта?
Дата добавления: 2019-01-14; просмотров: 201; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
