Заключительный (городской) этап. Теоретический тур
Класс
Авторы задач – Пошехонов И.С. (№№ 1 – 5), Бегельдиева С.М. (№ 6), Григорьев А.Г. (№ 7)
1. Имеется смесь магния и алюминия, содержащая 40% магния по массе. Вычислите минимальную массу смеси, необходимую для получения 2,016 л (н.у.) водорода. Приведите два примера реакций, позволяющих получить водород в этих условиях.
2. Ниже приведена схема превращений с участием элемента X:
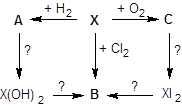
Расшифруйте схему и запишите уравнения всех приведённых реакций, если известно, что электронная конфигурация стабильного иона, образуемого элементом X, 1s22s22p63s23p6.
3. Даны следующие неорганические соединения: H3PO4, Ba(OH)2, Na2O2, N2, K2CO3, NaHSO4, Mg(OH)Cl, NaNO3, CS2, Fe2(SO4)3.
1) Приведите структурные формулы перечисленных соединений.
2) Выберите из списка соединения, в которых валентность одного из элементов не равна по модулю его степени окисления (ответ поясните).
3) Выберите из списка соединения, содержащие только ковалентные полярные связи.
4. Выберите из следующего списка химические явления: 1) появление ощущения свежести после грозы; 2) сверкание молнии; 3) образование бесцветных кристаллов при внесении стеклышка с несколькими каплями раствора поваренной соли в пламя спиртовки; 4) увеличение температуры воздуха в помещении с растопленным камином; 5) восстановление блестящей поверхности при чистке серебряного изделия с помощью нашатырного спирта; 6) образование пузырьков газа при обработке раны раствором перекиси водорода. Ваш ответ поясните.
|
|
|
Приведите примеры явлений, суть которых отражается следующими уравнениями химических реакций:
1) 4P + 5O2 → 2P2O5;
2) C + O2 → CO2;
3) CH4 + 2O2 → CO2 + 2H2O;
4) 4Fe + 6H2O + 3O2 → 4Fe(OH)3.
5. Известно, что процесс растворения сопровождается выделением или поглощением тепла. Так, например, теплота растворения серной кислоты в воде составляет +74,2 кДж/моль.
1) Вычислите объемы воды и серной кислоты, необходимые для приготовления 250 мл 15%-ного раствора.
2) Как при этом изменится температура раствора? Теплообменом с окружающей средой пренебречь.
3) Имеет ли значение последовательность смешения воды и кислоты? Ответ поясните.
| Справочные данные | Серная кислота | Вода | 15%-ный раствор серной кислоты |
| Плотность, г/мл | 1,84 | 1,00 | 1,10 |
| Теплоемкость, Дж/(кг·°С) | 1340 | 4200 | 3560 |
6. В лабораторию для анализа поступил некий белый порошок (А). Его подвергли прокаливанию, при этом выделился бесцветный газ (Б). Сухой остаток (В) смешали с водой, при этом произошла реакция образования вещества (Г) с бурным выделением тепла. Газ (Б) при нагревании взаимодействует с веществом черного цвета (Д) с образованием горючего газа (Е), после сжигания которого в кислороде вновь образовался газ (Б). Определите все вещества и запишите уравнения реакций всех описанных превращений.
|
|
|
7. Вещество А является оксидом некоторого элемента, массовая доля кислорода в этом оксиде составляет 36,8%. Навеску 17,4 г вещества А поместили при н.у. в колбу объемом 1 л и плотно закрыли пробкой. Колбу нагревали при 550 °C до полного разложения вещества А. При этом образовался порошок вещества Б. После охлаждения колбы до 0 ºC оказалось, что давление в колбе увеличилось в 2,12 раза по сравнению с первоначальным. Установите состав веществ А и Б, составьте уравнение описанной реакции.
Класс
Автор задач – Злотников Э.Г. (№№ 1 – 7)
1. Как известно, при разложении твердых веществ могут образоваться продукты в различном агрегатном состоянии. Возможны следующие варианты:
А) два твердых;
Б) два газообразных;
В) газообразный и твердый;
Г) газообразный и жидкий;
Д) жидкий и твердый.
Приведите по два примера, иллюстрирующих каждый из указанных вариантов. Напишите соответствующие уравнения реакций.
2. Неприятно пахнущий газ А имеет молярную массу больше средней молярной массы воздуха. 112 мл (н.у.) этого газа сожгли в избытке кислорода в присутствии оксида ванадия (V). Продукты сгорания с оставшимся кислородом пропустили в 100 мл воды. К полученному раствору прибавили 100 мл раствора гидроксида натрия с концентрацией 0,1 моль/л до нейтральной реакции по лакмусу. После выпаривания раствора и выдерживания полученного твёрдого остатка при температуре 140 ºС получили безводное вещество Б с массовой долей натрия 32,4%. При нагревании вещества Б до 600 K, получается соль В с массовой долей натрия 34,6 %.
|
|
|
а) Определите вещества А и Б.
б) Какова формула соли В?
в) Напишите уравнения всех упомянутых реакций.
3. Ниже приведены продукты взаимодействия двух веществ:
а) → K3[Fe(CN)6] + KCl; е) → Na2CO3 + O2;
б) → I2 + KNO2; ж) → SO2 + N2;
в) → Na2SO4 + NO + H2O; з) → H2SO4 + H2O;
г) → Fe2O3 + SO2; и) → Mn(NO3)2 + S + NO + H2O;
д) → CuI + I2 + KNO3; к) → H2SeO4 + HCl.
Напишите уравнения соответствующих реакций, учитывая, что продукты реакций приведены без стехиометрических коэффициентов.
4. Относительная молекулярная масса галогенида металла в 2,794 раза больше относительной молекулярной массы другого галогенида этого же металла. Разность относительных атомных масс галогенов, входящих в состав галогенидов равна 61.
|
|
|
А) Установите формулы галогенидов, если известно, что валентность металла в обоих галогенидах одинакова.
Б) Какие химические свойства характерны для этих галогенидов? Приведите не менее четырёх уравнений реакций, подтверждающих Ваше заключение.
5. Нерастворимая в воде соль реагирует с раствором другой соли с образованием только растворимых продуктов. Приведите примеры химических реакций разного типа, отвечающих данному условию.
6. К 150 г водного раствора хромата калия с массовой долей 9,7 % добавили некоторую массу оксида хрома (VI). При этом массовая доля хромата калия в растворе уменьшилась до 6,36 %. Раствор выпарили и остаток прокалили. Каков состав (в массовых долях) твердого остатка после прокаливания?
7. В электролизер с платиновыми электродами поместили 250 мл водного раствора сульфата меди (II) с концентрацией 0,8 моль/л и плотностью 1,14 г/мл и пропустили ток силой 7,236 А в течение 20 часов. После окончания электролиза к раствору добавили 100 г 16%-ного раствора гидроксида натрия. Раствор охладили до 7 ºС, после чего выпали бесцветные кристаллы.
А) Напишите уравнения описанных в задаче реакций. Какое вещество выпало в осадок?
Б) Какова масса выпавшего осадка, если известно, что в насыщенном при этой температуре растворе может содержаться 7,1% растворенного вещества?
Примечания: а) считать, что все процессы идут количественно, а образующиеся при электролизе газы полностью удаляются из электролизера; б) заряд одного моль электронов равен –96485 Кл.
Класс
Дата добавления: 2019-01-14; просмотров: 343; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
