Заключительный (городской) этап. Практический тур
Класс
Автор задания – Хлебникова Л.А.
Практическое задание:
1. Вам выдана смесь, состоящая из сульфата бария, карбоната магния и хлорида кальция. Используя только реактивы из приведенного ниже списка, выделите эти соли из смеси в индивидуальном виде. С использованием только выданных реактивов докажите полноту разделения солей.
2. Опишите ход выполнения работы и наблюдаемые явления.
Теоретические вопросы:
1. Предложите план разделения смеси солей.
2. Предложите реакции, с помощью которых можно подтвердить полноту выделения.
3. Напишите уравнения всех проводимых химических реакций.
Оборудование: химические стаканы, воронка, фильтры, стеклянная палочка, пробирки, штатив для пробирок, штатив для сбора установки для фильтрования, спиртовка.
Реактивы: дистиллированная вода, соляная кислота, карбонат натрия, сульфат натрия, нитрат серебра, фосфат натрия.
Класс
Автор задания – Хлебникова Л.А.
Практическое задание:
1. В восьми пакетах находятся следующие сухие вещества: оксид кальция, хлорид кальция, карбонат кальция, оксид бария, хлорид бария, сульфат бария, хлорид натрия и сульфат натрия. Используя только исходные вещества, воду и раствор хлороводородной кислоты, определите содержимое каждой пробирки.
2. Опишите ход выполнения работы и наблюдаемые явления.
Теоретические вопросы:
1. Представьте наиболее простой путь идентификации этих веществ.
|
|
|
2. Напишите уравнения всех проводимых реакций в молекулярном и ионном виде.
3. Напишите уравнения всех проводимых химических реакций.
Оборудование: пробирки, штатив для пробирок, ложечка (шпатель) для отбора пробы.
Реактивы: H2O, HCl (0,5 М).
Класс
Автор задания – Скрипкин М.Ю.
Практическое задание:
1. В выданной Вам мерной колбе находится неизвестный объем раствора индивидуальной соли, в состав которой могут входить: катион – кальция, магния, алюминия, цинка, свинца; анион – сульфат, хлорид, нитрат.Используя имеющийся набор реактивов, определите соль и установите, какое количество ее содержится в выданном Вам растворе.
Теоретические вопросы:
1. Составьте план определения.
2. Напишите уравнения соответствующих реакций.
Реактивы: иодид калия, сульфат калия, гидроксид натрия, карбонат натрия, нитрат свинца, хлорид бария, серная кислота, 0,05 М раствор трилона Б, аммиачный буфер (рН = 10), индикатор хромоген черный Т.
Класс
Авторы задания – Скрипкин М.Ю., Хлебникова Л.А.
Практическое задание 1 – качественный анализ органических веществ:
1. В склянках без надписей находятся водные растворы сахарозы, глицерина, глюкозы и ацетальдегида. Используя растворы сульфата меди, гидроксида натрия и серной кислоты, идентифицируйте содержимое пробирок.
|
|
|
2. Опишите и объясните наблюдаемые явления.
Практическое задание 2 – определение содержания (г) ацетона и уксусной кислоты в водном растворе:
1. Проведите количественный анализ смеси, содержащий ацетон и уксусную кислот, используя оборудование и реактивы, приведённые в списке.
2. Рассчитайте содержание (г) ацетона и уксусной кислоты в объеме мерной колбы.
Теоретические вопросы:
1. Представьте план идентификации содержимого каждой пробирки с использованием только предложенных веществ.
2. Напишите уравнения всех реакций, проводимых для идентификации.
3. Предложите методику проведения количественного анализа.
4. Обоснуйте выбор индикатора, используемого для определения уксусной кислоты.
5. Приведите уравнения реакций, лежащих в основе определения, и расчётные формулы.
Оборудование: электроплитка, бюретка, мерная колба, аликвотная пипетка, коническая колба для титрования с притертой пробкой.
Реактивы: растворы иода (0,0500 моль/л), Na2S2O3 (0,0500 моль/л), KOH или NaOH (0,1000 моль/л), крахмала 1%, фенолфталеина, метилоранжа, KOH (4 моль/л), HCl (2 моль/л).
Решения задач
|
|
|
Отборочный (районный) этап. Теоретический тур
Класс
I вариант
1. 1)По свойству пропорции: M*V = m*Vm. Откуда получается M/Vm = m/V, или отношение массы к объёму, т.е. физический смысл отношения молярной массы к молярному объему – это плотность газа.
2) Количество вещества гелия: n = p*V/(R*T). Подставляя численные значения, получаем n = 101,325*2/(8,31*273,15) = 0,08928 (моль). Тогда число атомов гелия N = n*Na = 0,08928*6,02*1023 = 5,37*1022.
3) При одинаковом количестве вещества число атомов водорода удвоится, т.к. водород Н2 – двухатомная молекула.
Рекомендации к оцениванию:
1) Физический смысл 2 балла = 2 балла
2) Число атомов 2 балла = 2 балла
3) Изменение числа атомов 1 балл = 1 балл
ИТОГО 5 баллов
2. 1)Классы веществ:
углерод – простое вещество, неметалл;
алюминий – простое вещество, металл;
|
|
|
оксид углерода (IV) – кислотный оксид;
оксид алюминия – амфотерный оксид;
2)C + O2 = CO2;
4Al + 3O2 = 2Al2O3
3)Рассчитаем массы исходных веществ:
n(CO2) = m(CO2)/M(CO2) = 44/44 = 1 моль.
Из уравнения реакции следует, что n(C) = n(CO2) = 1 моль.
Масса углерода m(C) = n(C)*M(C) = 1*12 = 12 г.
n(Al2O3) = m(Al2O3)/M(Al2O3) = 204/102 = 2 моль.
Из уравнения реакции следует, что n(Al) = 2*n(Al2O3) = 4 моль.
Масса алюминия m(Al) = n(Al)*M(Al) = 4*27 = 108 г.
Масса смеси равняется 12 + 108 = 120 г.
Массовая доля алюминия (108/120)*100% = 90%.
Рекомендации к оцениванию:
1) Указание класса по 0,25 балла 0,25∙4 = 1 балл
2) Уравнения по 1 баллу 1∙2 = 2 балла
3) Расчет массовой доли 2 балла = 2 балла
ИТОГО 5 баллов
3. Всего существует 9 типов молекул воды: 1H216O, 2H216O, 1H217O, 2H217O, 1H218O, 2H218O, 1H2H16O, 1H2H17O, 1H2H18O.
m(1H2H17O) = 0,000134998·0,2 = 0,0000269996 г;
ν = m/M = N/NA, N(1H2H17O) = mNA/M = 0,0000269996·6,02·1023/20 = 8,13·1017.
Рекомендации к оцениванию:
1) 9 типов молекул воды (правильный ответ без комментариев 1 балл) = 3 балла
2) Расчет количества 1H2H17O = 2 балла
ИТОГО 5 баллов
4. Необходимый объем раствора V = 40∙4 = 160 л; поскольку раствор очень разбавленный, то можно считать его плотность равной 1 г/мл, тогда m(H3BO3) = 160∙0,00015 = 0,024 кг = 24 г. M(H3BO3) = 62 г/моль. n(H3BO3) = 24/62 = 0,4 моль.
Рекомендации к оцениванию:
1) Объем раствора = 2 балла
2) Количество H3BO3 = 3 балла
ИТОГО 5 баллов
5. 1 – г, 2 – а, 3 – б, 4 – д, 5 – в.
Рекомендации к оцениванию:
1) Каждое правильное соответствие по 1 баллу 1∙5 = 5 баллов
ИТОГО 5 баллов
II вариант
1. 1)По свойству пропорции: M*N = m*Na. Откуда получается M/Na = m/N, или отношение массы к числу частиц, т.е. физический смысл отношения молярной массы к числу Авогадро – это масса одной частицы (атома, молекулы).
2) Количество вещества неона: n = p*V/(R*T). Подставляя численные значения, получаем n = 101,325*5/(8,31*273,15) = 0,22319 (моль). Тогда число атомов неона N = n*Na = 0,22319*6,02*1023 = 1,34*1023.
3) При одинаковом количестве вещества число атомов кислорода удвоится, т.к. кислород О2 – двухатомная молекула.
Рекомендации к оцениванию:
1) Физический смысл 2 балла = 2 балла
2) Число атомов 2 балла = 2 балла
3) Изменение числа атомов 1 балл = 1 балл
ИТОГО 5 баллов
2. 1)Классы веществ:
сера – простое вещество, неметалл;
магний – простое вещество, металл;
оксид серы (IV) – кислотный оксид;
оксид магния – основный оксид;
2)S + O2 = SO2;
2Mg + O2 = 2MgO
3)Рассчитаем массы исходных веществ:
n(SO2) = m(SO2)/M(SO2) = 64/64 = 1 моль.
Из уравнения реакции следует, что n(S) = n(SO2) = 1 моль.
Масса серы m(S) = n(S)*M(S) = 1*32 = 32 г.
n(MgO) = m(MgO)/M(MgO) = 80/40 = 2 моль.
Из уравнения реакции следует, что n(Mg) = n(MgO) = 2 моль.
Масса магния m(Mg) = n(Mg)*M(Mg) = 2*24 = 48 г.
Масса смеси равняется 32 + 48 = 80 г.
Массовая доля магния (48/80)*100% = 60%.
Рекомендации к оцениванию:
1) Указание класса по 0,25 балла 0,25∙4 = 1 балл
2) Уравнения по 1 баллу 1∙2 = 2 балла
3) Расчет массовой доли 2 балла = 2 балла
ИТОГО 5 баллов
3. Всего существует 9 типов молекул воды: 1H216O, 2H216O, 1H217O, 2H217O, 1H218O, 2H218O, 1H2H16O, 1H2H17O, 1H2H18O.
m(1H2H18O) = 0,000728769·0,3 = 0,0002186307 г;
ν = m/M = N/NA, N(1H2H18O) = mNA/M = 0,0002186307·6,02·1023/21 = 6,27·1018.
Рекомендации к оцениванию:
1) 9 типов молекул воды (правильный ответ без комментариев 1 балл) = 3 балла
2) Расчет количества 1H2H18O = 2 балла
ИТОГО 5 баллов
4. Необходимый объем раствора V = 50∙6 = 300 л; поскольку раствор очень разбавленный, то можно считать его плотность равной 1 г/мл, тогда m(H3BO3) = 300∙0,0001 = 0,03 кг = 30 г. M(H3BO3) = 62 г/моль. n(H3BO3) = 30/62 = 0,5 моль.
Рекомендации к оцениванию:
1) Объем раствора = 2 балла
2) Количество H3BO3 = 3 балла
ИТОГО 5 баллов
5. 1 – в, 2 – б, 3 – г, 4 – д, 5 – а.
Рекомендации к оцениванию:
1) Каждое правильное соответствие по 1 баллу 1∙5 = 5 баллов
ИТОГО 5 баллов
Класс
I вариант
1. 1. На смесь металлов действуем избытком раствора щелочи. Уменьшение массы смеси соответствует массе алюминия:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
2. Твердый остаток растворяем в избытке соляной кислоты. Уменьшение массы смеси соответствует массе железа:
Fe + 2HCl = FeCl2 + H2
3. Твердый остаток растворяем в избытке раствора азотной кислоты, уменьшение массы смеси соответствует массе меди:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Масса твердого остатка соответствует массе золота.
Рекомендации к оцениванию:
1) Количественное определение металла по 0,5 балла 0,5∙4 = 2 балла
2) Уравнения реакций по 1 баллу 1∙3 = 3 балла
ИТОГО 5 баллов
2. Декагидрат сульфита натрия: Na2SO3*10H2O. Уравнения реакций:
Na2SO3 + 2HCl = 2NaCl + H2O + SО2
Ba(OH)2 + SO2 = BaSO3 + H2O
По стехиометрической схеме:
Na2SO3*10H2O à BaSO3
находим массу чистогокристаллогидрата: (32,55/217)*306 = 45,9 г.
Масса примесей в декагидрате сульфита натрия: 50 – 45,9 = 4,1 г.ω(прим.) = 4,1/50 = 0,082 или 8,2%.
Рекомендации к оцениванию:
1) Уравнения реакций по 1 баллу 1∙2 = 2 балла
2) Масса чистого кристаллогидрата 2 балла = 2 балла
3) Массовая доля примесей 1 балл = 1 балл
ИТОГО 5 баллов
3. Находим массу серной кислоты в 1 мл 35%-ного раствора: 1,26*0,35 = 0,441 г.
Масса серной кислоты в 1 капле в 20 раз меньше: 0,441/20 = 0,02205 г.
Эта масса серной кислоты будет и в 500 мл раствора, а в 1 литре раствора будет в 2 раза больше: 0,02205*2 = 0,0441 г.
Количество серной кислоты: 0,0441/98 = 0,00045 моль
Учитывая диссоциацию серной кислоты:
H2SO4 = 2Н+ + SO42–
находим концентрацию ионов Н+: 0,00045*2 = 0,0009 (моль-ионов/л) или 9*10–4 (моль-ионов/л).
Рекомендации к оцениванию:
1) Расчет массы 3 балла = 3 балла
2) Расчет концентрации 2 балла = 2 балла
ИТОГО 5 баллов
4. Разложение оксида азота (I) протекает по уравнению:
2N2O = 2N2 + O2
Скорость реакции: W = к[N2O]2
Считая объем системы равным V, выразим начальную скорость: W0 = к(0,2/ V)2
Разложилось N2O: 0,2*0,2 = 0,04 моль (см. уравнение).
Осталось N2O: 0,2 – 0,04 = 0,16 моль.
Скорость реакции к этому моменту составит: W = к(0,16/ V)2.
Значит, скорость уменьшилась в: W0: W = к(0,2/ V)2/к(0,16/ V)2 = 0,04/0,0256 = 1,5625 раз.
Рекомендации к оцениванию:
1) Уравнение реакции 1 балл = 1 балл
2) Выражение для начальной скорости 2 балла = 2 балла
3) Выражение для конечной скорости 1 балл = 1 балл
4) Вывод об изменении скорости 1 балл = 1 балл
ИТОГО 5 баллов
5. CaCO3 + H2SO4 = CaSO4 + H2O + CO2
7,5 г CaCO3 соответствуют изменению давления на 175,39 кПа
100 г CaCO3 « « х кПа
Таким образом, в расчете на моль CaCO3 изменение давления составит: 100*175,39/7,5 = 2338,53 кПа.
Me + H2SO4 = MeSO4 + H2
0,98 г металла соответствуют изменению давления на 35,08 кПа
А « « 2338,53 кПа
Отсюда относительная атомная масса металла равна 65,3. Это цинк.
Рекомендации к оцениванию:
1) Уравнения реакций по 1 баллу 1∙2 = 2 балла
2) Определение металла 3 балла = 3 балла
ИТОГО 5 баллов
II вариант
1. 1.На смесь металлов действуем избытком раствора щелочи. Уменьшение массы смеси соответствует массе цинка:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
2. Твердый остаток растворяем в избытке соляной кислоты. Уменьшение массы смеси соответствует массе магния:
Mg +2HCl = MgCl2 + H2
3. Твердый остаток растворяем в избытке раствора азотной кислоты, уменьшение массы смеси соответствует массе серебра:
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O
Масса твердого остатка соответствует массе золота.
Рекомендации к оцениванию:
1) Количественное определение металла по 0,5 балла 0,5∙4 = 2 балла
2) Уравнения реакций по 1 баллу 1∙3 = 3 балла
ИТОГО 5 баллов
2. Уравнения реакций:
CaCO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2
2NaOH + CO2 = Na2CO3 + H2O или NaOH + CO2 = NaHCO3
Увеличение массы раствора соответствует массе поглощенного углекислого газа.
По стехиометрической схеме:
CaCO3 à CO2
находим массу чистогокарбоната кальция: (26,4/44)*100 = 60 г.
Масса примесей: 75 – 60 = 15 г.ω(прим.) = 15/ 75 = 0,2 или 20%.
Рекомендации к оцениванию:
1) Уравнения реакций по 1 баллу 1∙2 = 2 балла
2) Масса чистого кристаллогидрата 2 балла = 2 балла
3) Массовая доля примесей 1 балл = 1 балл
ИТОГО 5 баллов
3. Находим массу гидроксида натрия в 1 мл 35%-ного раствора: 1,38*0,35 = 0,483 г.
Масса гидроксида натрия в 1 капле в 20 раз меньше: 0,483/20 = 0,02415 г.
Эта масса гидроксида натрия будет и в 250 мл раствора, а в 1 литре раствора будет в 4 раза больше: 0,02415*4 = 0,0966 г.
Учитывая диссоциацию гидроксида натрия:
NaOH = Na+ + OH–
находим концентрацию ионов OH–: 0,0966/40 = 0,002415 (моль-ионов/л) или 2,415*10–3 (моль-ионов/л).
Рекомендации к оцениванию:
1) Расчет массы 3 балла = 3 балла
2) Расчет концентрации 2 балла = 2 балла
ИТОГО 5 баллов
4. Уравнение реакции:
2NO + O2 = 2NO2
Скорость реакции: W = к[NO]2*[O2]
Считая объем системы равным V, выразим начальную скорость: W0 = к(0,4/V)2*(0,4/V)
Прореагировало кислорода: 0,4*0,25 = 0,1 моль. Следовательно, вступило в реакцию оксида азота (II): 0,1*2 = 0,2 моль.
Осталось кислорода: 0,4 – 0,1 = 0,3 моль.
Осталось оксида азота (II): 0,4 – 0,2 = 0,2 моль.
Скорость реакции к этому моменту составит: W = к(0,2 / V)2*(0,3 / V).
Значит, скорость уменьшилась в: W0:W = к (0,4/ V)2*(0,4/ V)/ к(0,2 / V)2 *(0,3 / V) =
= ((0,4)2 *0,4)/ (0,2)2 * (0,3) = 5,33 раз.
Рекомендации к оцениванию:
1) Уравнение реакции 1 балл = 1 балл
2) Выражение для начальной скорости 2 балла = 2 балла
3) Выражение для конечной скорости 1 балл = 1 балл
4) Вывод об изменении скорости 1 балл = 1 балл
ИТОГО 5 баллов
5. Mg + H2SO4 = MgSO4 + H2
1,8 г магния соответствует изменению давления на 140,59 кПа
24 г « « х кПа
Таким образом, в расчете на моль магния изменение давления составит: 24*140,59/1,8 = 1874,53 кПа.
MeCO3 + H2SO4 = MeSO4 + H2O + CO2
2,95 г карбоната металла соответствуют изменению давления на 28,12 кПа
М « « 2338,53 кПа
Молярная масса карбоната металла равна 197 и атомная масса металла равна 197 – 60 = 137. Это барий.
Рекомендации к оцениванию:
1) Уравнения реакций по 1 баллу 1∙2 = 2 балла
2) Определение металла 3 балла = 3 балла
ИТОГО 5 баллов
Класс.
I вариант
1. Задача имеет несколько возможных решений. Ниже приведено одно из них:
1) Na2CO3*10H2O = Na2CO3 (1) + 10H2O (2)
2) 2H2O = 2H2 (3) + O2 (4) (электролиз раствора Na2CO3)
3) H2 + O2 = H2O2 (5)
4) CuSO4*5H2O = CuSO4 (6) + 5H2O
5) 2CuSO4 + 2H2O = 2Cu (7) + O2 + 2H2SO4 (8) (электролиз)
6) 2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3 (9) + 2Na2SO4 (10) + CO2 (11)
7) CuSO4 + Fe = FeSO4 (12) + Cu
Рекомендации к оцениванию:
1) Каждое новое вещество по 0,5 балла 0,5∙10 = 5 баллов
Замечание: если не указаны условия протекания реакции
(при том, что это принципиально) – 0,25 баллаза вещество.
ИТОГО 5 баллов
2. Рассмотрим металлы с валентностью 1. Для них будет справедливо соотношение:
(М + 126,9)/(М + 35,5) = 1,8775
Тогда М = 68,7 г/моль – таких металлов нет
Пусть валентность металла равна 2. Тогда справедливо:
(М + 126,9*2)/(М + 35,5*2) = 1,8775
М = 137,4 г/моль – эта атомная масса соответствует барию.
Уравнения реакций:
Ba + O2 = BaO2 (ниже 500 оС) или 2Ва +О2 = 2ВаО (выше 800 оС)
Ba + H2 = BaH2
BaO + H2O = Ba(OH)2
BaO + SO3 = BaSO4
Ba(OH)2 + H2SO4 = BaSO4 + 2H2O
Ba(OH)2 + CO2 = BaCO3 + H2O
Рекомендации к оцениванию:
1) Определение металла 2 балла = 2 балла
2) Уравнения реакций (отличных по типу) по 0,5 балла 0,5∙6 = 3 балла
ИТОГО 5 баллов
3. 1) 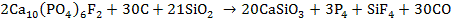
2) 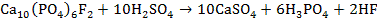
3) 
4) При добавлении фторидов равновесие (3) смещается в сторону исходных веществ и зубная эмаль восстанавливается.
5) Минерал – фторапатит.
Рекомендации к оцениванию:
1) Уравнения реакций по 1 баллу 1∙3 = 3 балла
2) Механизм процесса 1 балл = 1 балл
3) Название минерала 1 балл = 1 балл
ИТОГО 5 баллов
4. При кристаллизации 500 граммов пересыщенного раствора сульфата натрия выделяется теплоты Qсол.гр. = 252*500/1000 = 126 кДж.
В химической грелке при добавлении воды протекает следующая термохимическая реакция:
CuCl2(безв.) + Fe(мет.) + 4H2O(жидк.) = Cu(мет.) + FeCl2*4H2O + Qреакц.
Теплота реакции равна Qреакц = (1 моль)*Qобр(FeCl2*4H2O) – (1 моль)*Qобр(CuCl2) – (4 моль)*Qобр(H2O) = 1552 – 216 – 4*286 = 192 кДж.
Для химической грелки с тем же самым выделением тепла, что и в солевой, надо взять: n(CuCl2) = n(Fe) = (Qсол.гр./Qреакц) = 0,656 моль, т.е. 0,656*134,5 = 88,3 граммов хлорида меди(II) и 0,656*56 = 36,7 граммов железа и воды не менее 0,656*4*18 = 47,3 граммов.
Древесные опилки в химической грелке используются как инертный разбавитель: в составах без опилок тепло выделяется интенсивней, что приводит к быстрому завершению работы грелки и сильному её разогреванию.
В сухой смеси хлорида меди и железных опилок реакция не идет по причине малой площади контакта реагентов. Добавление воды растворяет хлорид меди и это запускает химическую реакцию между растворенным хлоридом меди и металлическим железом.
Рекомендации к оцениванию:
1) Количество теплоты 0,5 балла = 0,5 балла
2) Термохимическое уравнение реакции 1 балл = 1 балл
3) Теплота реакции 1 балл = 1 балл
4) Расчет масс реактивов 1 балл = 1 балл
5) Объяснение использования опилок 0,5 балла = 0,5 балла
6) Роль воды 1 балл = 1 балл
ИТОГО 5 баллов
5. Реакция углеводорода с [Ag(NH3)2]OH с выпадением осадка – это качественная реакция на наличие в соединении концевой тройной связи, при этом осадком является ацетиленид серебра. Следовательно, А содержит концевую тройную связь и может присоединить 2 эквивалента брома (или более, если в А имеются ещё другие кратные связи). Количество углеводорода А: n(A) = 10,0/(M(A) – 1 + 108)
В то же время: n(A) = 21,27/(M(A) + x*160), где х – количество присоединённых эквивалентов брома. Приравнивая оба выражения, получаем:
10,0/(M(A) + 107) = 21,27/(M(A) + x*160), откуда М(А) = 142х – 202.
При х = 2 получаем М = 82, это углеводород С6Н10, что как раз соответствует алкину.
При х = 3 получаем М = 224, однако углеводород С16Н32 может быть только алкеном или циклоалканом, и поэтому не может присоединить три эквивалента брома.
Таким образом, изомеры углеводорода С6Н10 с концевой тройной связью:

Из которых пять типов атомов углерода имеет только 4-метилпент-1-ин:
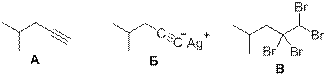
Рекомендации к оцениванию:
1) Выход на брутто-формулу 1 балл = 1 балл
2) Струтура А 2 балла = 2 балла
3) Структуры Б и В по 1 баллу 1∙2 = 2 балла
ИТОГО 5 баллов
6. ν(RHal) = 0,2016/22,4 = 0,009 моль. Реакция горения галогеналкана:
CnH2n+2 – kHalk + O2 → nCO2 + H2O + kHHal, где Hal = F, Cl, Br
При пропускании продуктов сгорания через раствор гидроксида кальция выпадает осадок карбоната кальция:
CO2 + Ca(OH)2 → CaCO3 + H2O,
и если Hal = F, то образуется также и фторид кальция:
2HF + Ca(OH)2 → CaF2 + 2H2O.
Если Hal = Cl или Br, то ν(RHal) = ν(CaCO3)/n, т.е. n = (3,402/100)/0,009 = 3,78 – не подходит по химическому смыслу. Значит, Hal = F и масса осадка равна сумме масс CaCO3 и CaF2. ν(CaCO3) = n·ν(RHal); ν(CaF2) = 0,5k·ν(RHal). Тогда 100·n·0,009 + 0,5k·0,009·78 = 3,402. Откуда n = 3,78 – 0,39k. По химическому смыслу n > 0, т.е. k < 9,7. В натуральных числах уравнение имеет единственное решение: k = 2, n = 3, т.е. исходное соединение C3H6F2 (имеет 4 структурных изомера):

Рекомендации к оцениванию:
1) Реакция горения или стехиометрическая схема = 0,5 балла
2) Уравнения по 1 баллу 0,5·2 = 1 балл
3) Вывод, что Hal = F 0,5 балла
4) Молекулярная формула 1 балл
5) Изомеры по 0,5 балла 0,5·4 = 2 балла
ИТОГО 5 баллов
II вариант
1. Задача имеет несколько возможных решений. Ниже приведено одно из них:
1) NH4Cl = NH3 (1) + HCl (2) (нагрев)
2) CuCl2*2H2O = CuСl2 (3) + 2H2O
3) 2H2O = 2H2 (4) + O2 (5) (электролиз раствора NH4Cl)
4) H2 + O2 = H2O2 (6)
5) CuCl2 = Cu (7) + Cl2 (8) (электролиз расплава)
6) CuСl2 + Mg = MgCl2 (9) + Cu
7) 4NH3 + 3O2 = 2N2 (10) + 6H2O
8) 2Mg + O2 = 2MgO (11)
9) 3Mg + N2 = Mg3N2 (12)
Рекомендации к оцениванию:
1) Каждое новое вещество по 0,5 балла 0,5∙10 = 5 баллов
Замечание: если не указаны условия протекания реакции
(при том, что это принципиально) – 0,25 баллаза вещество.
ИТОГО 5 баллов
2. Рассмотрим металлы с валентностью 1. Для них будет справедливо соотношение:
(М + 126,9)/(М + 79,9) = 1,398
Тогда М = 38,0 г/моль – таких металлов нет
Пусть валентность металла равна 2. Тогда справедливо:
(М + 126,9*2)/(М + 79,9*2) = 1,398
М = 76,5 г/моль – таких металлов нет
Пусть валентность металла равна 3. Тогда:
(М + 126,9*3)/(М + 79,9*3) = 1,398
М = 114,5 г/моль – данная масса соответствует индию.
Уравнения реакций:
4In + 3O2 = 2In2O3
2In + 3Cl2 = 2InCl3
In2O3 + 3H2SO4 = In2(SO4)3 + 3H2O
In2O3 + 2NaOH = 2NaInO2 (сплавление)
In(OH)3 + 3HCl = InCl3 + 3H2O
In(OH)3 + NaOH = NaIn(OH)4
Рекомендации к оцениванию:
1) Определение металла 2 балла = 2 балла
2) Уравнения реакций (отличных по типу) по 0,5 балла 0,5∙6 = 3 балла
ИТОГО 5 баллов
3. 1) 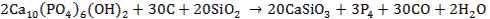
2) 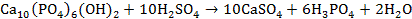
3) 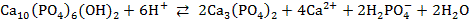
4) 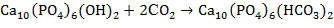
Альтернативная форма записи: 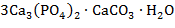
5) Минерал – гидроксиапатит.
Рекомендации к оцениванию:
1) Уравнения реакций по 1 баллу 1∙4 = 4 балла
2) Название минерала 1 балл = 1 балл
ИТОГО 5 баллов
4. При кристаллизации 400 граммов пересыщенного раствора ацетата натрия выделяется теплоты Qсол.гр. = 264*400/1000 = 105,6 кДж.
В химической грелке при добавлении воды протекает следующая термохимическая реакция:
3CuCl2(безв.) + 2Al(мет.) + 12H2O(жидк.) = 3Cu(мет.) + 2AlCl3*6H2O + Qреакц.
Теплота реакции равна Qреакц = (2 моль)*Qобр(AlCl3*6H2O) – (3 моль)*Qобр(CuCl2) – (12 моль)*Qобр(H2O) = 2*2693 – 3*216 – 12*286 = 1306 кДж.
Для химической грелки с тем же самым выделением тепла, что и в солевой, надо взять: r = (Qсол.гр./Qреакц) = 0.081, r*3*134,5 = 32,6 граммов хлорида меди (II) и r*2*56 = 9,1 граммов алюминия и воды не менее r*12*18 = 17,5 граммов.
Древесные опилки в химической грелке используются как инертный разбавитель: в составах без опилок тепло выделяется интенсивней, что приводит к быстрому завершению работы грелки и сильному её разогреванию.
В сухой смеси хлорида меди и алюминиевых опилок реакция не идет по причине малой площади контакта реагентов. Добавление воды растворяет хлорид меди и это запускает химическую реакцию между растворенным хлоридом меди и металлическим алюминием.
Рекомендации к оцениванию:
1) Количество теплоты 0,5 балла = 0,5 балла
2) Термохимическое уравнение реакции 1 балл = 1 балл
3) Теплота реакции 1 балл = 1 балл
4) Расчет масс реактивов 1 балл = 1 балл
5) Объяснение использования опилок 0,5 балла = 0,5 балла
6) Роль воды 1 балл = 1 балл
ИТОГО 5 баллов
5. Реакция углеводорода с [Cu(NH3)2]OH с выпадением осадка – это качественная реакция на наличие в соединении концевой тройной связи, при этом осадком является ацетиленид меди (I). Следовательно, А содержит концевую тройную связь и может присоединить 2 эквивалента брома (или более, если в А имеются ещё другие кратные связи).
Количество углеводорода А: n(A) = 10,0/(M(A) – 1 + 63,5)
В то же время: n(A) = 27,82/(M(A) + x*160), где х – количество присоединённых эквивалентов брома. Приравнивая оба выражения, получаем:
10,0/(M(A) + 62,5) = 27,82/(M(A) + x*160), откуда М(А) = 89,8х – 97,6.
При х = 2 получаем М = 82, это углеводород С6Н10, что как раз соответствует алкину.
При х = 3 и х = 4 разумных формул для углеводорода А получить не удаётся.
Таким образом, изомеры углеводорода С6Н10 с концевой тройной связью:
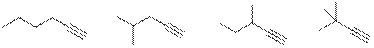
Из которых четыре типа атомов углерода имеет только 3,3-диметилбут-1-ин:
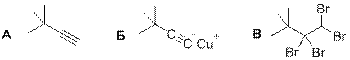
Рекомендации к оцениванию:
1) Выход на брутто-формулу 1 балл = 1 балл
2) Струтура А 2 балла = 2 балла
3) Структуры Б и В по 1 баллу 1∙2 = 2 балла
ИТОГО 5 баллов
6. ν(RHal) = 0,1792/22,4 = 0,008 моль. Реакция горения галогеналкана:
CnH2n+2 – kHalk + O2 → nCO2 + H2O + kHHal, где Hal = F, Cl, Br
При пропускании продуктов сгорания через раствор гидроксида кальция выпадает осадок карбоната кальция:
CO2 + Ca(OH)2 → CaCO3 + H2O,
и если Hal = F, то образуется также и фторид кальция:
2HF + Ca(OH)2 → CaF2 + 2H2O.
Если Hal = Cl или Br, то ν(RHal) = ν(CaCO3)/n, т.е. n = (3,512/100)/0,008 = 4,39 – не подходит по химическому смыслу. Значит, Hal = F и масса осадка равна сумме масс CaCO3 и CaF2. ν(CaCO3) = n·ν(RHal); ν(CaF2) = 0,5k·ν(RHal). Тогда 100·n·0,008 + 0,5k·0,008·78 = 3,512. Откуда n = 4,39 – 0,39k. По химическому смыслу n > 0, т.е. k < 11,3. В натуральных числах уравнение имеет единственное решение: k = 1, n = 4, т.е. исходное соединение C4H9F (имеет 4 структурных изомера):
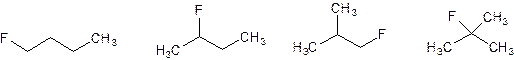
Рекомендации к оцениванию:
1) Реакция горения или стехиометрическая схема = 0,5 балла
2) Уравнения по 1 баллу 0,5·2 = 1 балл
3) Вывод, что Hal = F 0,5 балла
4) Молекулярная формула 1 балл
5) Изомеры по 0,5 балла 0,5·4 = 2 балла
ИТОГО 5 баллов
Класс.
I вариант
1. 1) С концентрированной азотной кислотой при комнатной температуре железо не реагирует. Вещество А – Fe.
2) Fe + 2HCl = FeCl2 (B) + H2
3) 4FeCl2 + 8NaOH + O2 + 2H2O = 4Fe(OH)3 (C) + 8NaCl
4) 2Fe(OH)3 + 6HI = 2FeI2(D) + I2 + 6H2O
5) FeI2 + 2KOH = Fe(OH)2 (Е) + 2KI
Рекомендации к оцениванию:
1) Определение А и уравнения реакций по 1 баллу 1∙5 = 5 баллов
ИТОГО 5 баллов
2. 4Li + O2 ® 2Li2O
2Na + O2 ® Na2O2
При растворении происходят следующие процессы:
Li2O + H2O ® 2LiOH
2Na2O2 + 2H2O ® 4NaOH + O2↑
Стехиометрические схемы:
Li ® LiOH
4Na ® 4NaOH + O2
Пусть ν(Li) = x моль, ν(Na) = y моль. Тогда:
| Вещество | ν, моль | M, г/моль | m, г |
| Li | x | 7 | 7x |
| Na | y | 23 | 23y |
| Li2O | 0,5x | 30 | 15x |
| Na2O2 | 0,5y | 78 | 39y |
| LiOH | x | 24 | 24x |
| NaOH | y | 40 | 40y |
| O2 | 0,25y | 32 | 8y |
суммарная массовая доля щелочи Ω будет вычисляться по формуле
Ω = (24x + 40y)∙100/(50 + 15x + 39y – 8y). Исходя из условия, можно составить систему:
 (24x + 40y)∙100/(50 + 15x + 31y) = 6,84
(24x + 40y)∙100/(50 + 15x + 31y) = 6,84
7x + 23y = 1,73
 Решая которую, получим x = 0,05
Решая которую, получим x = 0,05
y = 0,06
ω(Li) = 0,05∙7∙100/1,73 = 20,2%.
Ответ: 20,2%.
Рекомендации к оцениванию:
1) Уравнения реакций по 0,5 балла 0,5∙4 = 2 балла
2) Учет элементов, которые образуют новую массу раствора 1 балл = 1 балл
3) Система уравнений 1 балл = 1 балл
4) Расчет массовой доли металлов 1 балл = 1 балл
ИТОГО 5 баллов
3. Причина конечного срока хранения масел и жиров – неизбежные химические реакции ненасыщенных жирных кислот, входящих в состав этих продуктов, с кислородом воздуха. Влияние температуры T на скорость v химических реакций (и, следовательно, на срок хранения τ продуктов) может быть описано правилом Вант-Гоффа:
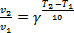 , где γ – температурный коэффициент.
, где γ – температурный коэффициент.
Скорость реакции («химической порчи» продукта) обратно пропорциональна времени хранения, поэтому
 .
.
Найдем температурный коэффициент γ в интервале температур -18 … 0 °С:
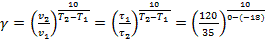 = 2,0
= 2,0
Найдем температуру, при которой масло можно хранить один год (т.е. 365 суток):
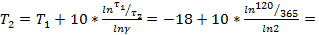 –34 °С
–34 °С
При комнатной температуре (+18°С) масло можно хранить
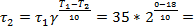 10 суток.
10 суток.
На этот вопрос ответ можно получить еще проще, если заменить, что в интервале температур от -18 до 0°С такое же число градусов, что и в интервале от 0 до +18°С. Следовательно, увеличение температуры от -18 до 0°С уменьшает срок хранения в столько же раз (в 120/35 = 3,43 раз), во сколько сократится срок хранения масла при увеличении температуры от 0 до +18°С. При комнатной температуре срок хранения масла равен: (35 сут)/3,43 = 10 суток.
Реальный срок годности масла при комнатной температуре уменьшается не только по причине идущей химической реакции ненасыщенных соединений с кислородом воздуха, но и из-за появления нового процесса – деятельности бактерий, питающихся маслом.
Достигнуть расчетного срока хранения при комнатной температуре (около 10 суток) можно способами, предохраняющими масло от попадания бактерий и сдерживающими развитие уже попавших. Для этого достаточно хранить масло в герметичной упаковке или в соленой воде (или просто его посолить).
Рекомендации к оцениванию:
1) Расчет температурного коэффициента 2 балла = 2 балла
2) Расчет температуры 1 балл = 1 балл
3) Расчет времени 1 балл = 1 балл
4) Срок годности 1 балл = 1 балл
ИТОГО 5 баллов
4. 1-В, 2-А, 3-Д, 4-Б, 5-Г.
Рекомендации к оцениванию:
1) Каждое правильное соответствие по 1 баллу 1∙5 = 5 баллов
ИТОГО 5 баллов
5. Исходя из условия задачи, можно составить уравнение (X + 14 + 16•2)/(X + 14 + 1•2) = 1,280, где Х – масса R, с помощью которого можно вычислить массу углеводородной части молекулы – X . Примем формулу углеводородного остатка молекулы за CnHm, тогда получим уравнение: 12•n +1•m = X = 90. Единственное решение этого уравнения, дающее химически верные ответ, это n = 7, m = 7. Значит брутто-формула вещества А – C7H7NO2.
Учитывая степень ненасыщенности углеводородного скелета – 4, можно предположить, что в состав соединения A входит бензольное кольцо. Существование только двух изомеров при бромирования указывает на пара-расположение заместителей. Таким образом соединение А – это пара-нитротолуол.
В большем количестве при бромировании пара-нитротолуола образуется 2-бром-4-нитротолуол, так как метильная группа является орто-/пара-ориентантом, а нитро-группа мета-ориентантом.
А – 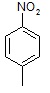 Основной продукт бромирования –
Основной продукт бромирования – 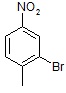
Восстановители – сульфид аммония, каталитическое гидрирование молекулярным водородом, водород в момент выделения (железо, олово, цинк в соляной кислоте), хлорид олова(II) с соляной кислотой.
Рекомендации к оцениванию:
1) Брутто-формула А 1 балл = 1 балл
2) Структурная формула А 1,5 балла = 1,5 балла
3) Продукт бромирования 1 балл = 1 балл
4) Примеры восстановителей по 0,5 балла 0,5∙3= 1,5 балла
ИТОГО 5 баллов
6. Непоглощенным газом в данных условиях могут быть азот, кислород или их смесь. Для определения данного вещества рассмотрим смесь газообразных продуктов после сгорания. Она состоит из 0,7 л водяных паров, 0,6 л углекислого газа и 2,0 л газа, оставшегося непоглощенным. Тогда можно записать:
(МХ*2 + 18*0,7 + 44*0,6)/(2 + 0,7 + 0,6) = 44*0,71
Отсюда МХ = 32,05 г/моль, что соответствует чистому кислороду.
Тогда исходное вещество имеет состав ЭСхOyHz.
Исходя из соотношения объемов водяных паров и углекислого газа, а также объема паров исходного вещества, легко установить, что х = 6, а z = 14.
Молярная масса исходного вещества составляет примерно 3,40*44 = 149,6 г/моль, при этом на фрагмент ЭОy приходится 149,6 – 6*12 – 14*1 = 63,6 г/моль. Если у = 1, то искомый элемент имеет молярную массу около 47,6 г/моль – это титан. Если у = 2, то молярная масса неизвестного элемента составляет примерно 21,6 г/моль – с большой натяжкой здесь может подойти натрий, однако соответствующее соединение Na2O2C6H14 предложить крайне затруднительно. По-видимому, искомое соединение TiOC6H14.
Для проверки можно рассмотреть реакцию сгорания данного соединения:
TiOC6H14 + 10O2 = TiO2 + 7H2O + 6CO2
Таким образом, на полное сгорание 100 мл паров исходного вещества расходуется 1 л кислорода, что полностью соответствует условию задачи.
Возможные структурные формулы:
Ti(OCH3)(CH3)(C2H5)(CH=CH2), Ti(OC2H5)(CH3)2(CH=CH2), Ti(OH)(C2H5)2(CH=CH2) и т.д.
Рекомендации к оцениванию:
1) Определение соотношения С:Н 1 балл = 1 балл
2) Доказательство того, что непоглощенный газ – кислород 1 балл = 1 балл
3) Вывод формулы исходного вещества 1,5 балла = 1,5 балла
4) Структурные формулы по 0,5 балла 0,5∙3= 1,5 балла
ИТОГО 5 баллов
II вариант
1. 1) С концентрированной серной кислотой при комнатной температуре алюминий не реагирует. Вещество А – Al.
2) 2Al + 3HBr = 2AlBr3 (B) + 3H2
3) 2AlBr3 + 3Na2CO3 + 3H2O = 2Al(OH)3 (C) + 3CO2 + 6NaBr
4) Al(OH)3 + NaOH = NaAlO2 (D) + 2H2O
5) NaAlO2 + 4HNO3 = Al(NO3)3 (Е) + NaNO3
Рекомендации к оцениванию:
1) Определение А и уравнения реакций по 1 баллу 1∙5 = 5 баллов
ИТОГО 5 баллов
2. 4Li + O2 ® 2Li2O
2Na + O2 ® Na2O2
При растворении происходят следующие процессы:
Li2O + H2O ® 2LiOH
2Na2O2 + 2H2O ® 4NaOH + O2↑
Стехиометрические схемы:
Li ® LiOH
4Na ® 4NaOH + O2
Пусть ν(Li) = x моль, ν(Na) = y моль. Тогда:
| Вещество | ν, моль | M, г/моль | m, г |
| Li | x | 7 | 7x |
| Na | y | 23 | 23y |
| Li2O | 0,5x | 30 | 15x |
| Na2O2 | 0,5y | 78 | 39y |
| LiOH | x | 24 | 24x |
| NaOH | y | 40 | 40y |
| O2 | 0,25y | 32 | 8y |
суммарная массовая доля щелочи Ω будет вычисляться по формуле
Ω = (24x + 40y)∙100/(50 + 15x + 39y – 8y). Исходя из условия, можно составить систему:
 (24x + 40y)∙100/(50 + 15x + 31y) = 7,84
(24x + 40y)∙100/(50 + 15x + 31y) = 7,84
7x + 23y = 2,12
 Решая которую, получим x = 0,04
Решая которую, получим x = 0,04
y = 0,08
ω(Na) = 0,08∙23∙100/2,12 = 86,8%.
Ответ: 86,8%.
Рекомендации к оцениванию:
1) Уравнения реакций по 0,5 балла 0,5∙4 = 2 балла
2) Учет элементов, которые образуют новую массу раствора 1 балл = 1 балл
3) Система уравнений 1 балл = 1 балл
4) Расчет массовой доли металлов 1 балл = 1 балл
ИТОГО 5 баллов
3. Причина конечного срока хранения масел и жиров – неизбежные химические реакции ненасыщенных жирных кислот, входящих в состав этих продуктов, с кислородом воздуха. Влияние температуры T на скорость v химических реакций (и, следовательно, на срок хранения τ продуктов) может быть описано правилом Вант-Гоффа:
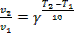 , где γ – температурный коэффициент.
, где γ – температурный коэффициент.
Скорость реакции («химической порчи» продукта) обратно пропорциональна времени хранения, поэтому
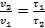 .
.
Найдем температурный коэффициент γ в интервале температур +5 … +20 °С:
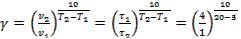 = 2,52.
= 2,52.
Найдем температуру, при которой масло можно хранить 6 месяцев:
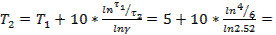 0,6 °С.
0,6 °С.
Увеличить срок годности подсолнечного масла до года (и более) можно, поместив продукт в герметичную светонепроницаемую тару с бескислородной средой, например, налив масло в бутылки из темного стекла и запечатав их в атмосфере азота.
Как долго можно подвергать масло нагреву на воздухе до температуры 110 градусов Цельсия без серьезного ухудшения качества масла? Ответ на этот вопрос можно получить расчетом по формуле, которая выводится из правила Вант-Гоффа:
 2,44*10–4 мес или (2,44*10–4 мес)*(30 сут/мес)*(24 ч/сут)*(60 мин/ч) = 10,5 мин.
2,44*10–4 мес или (2,44*10–4 мес)*(30 сут/мес)*(24 ч/сут)*(60 мин/ч) = 10,5 мин.
На этот вопрос ответ можно получить еще проще, если заменить, что интервал температур от +5 до +110 °С ровно в 7 раз больше интервала от +5 до +20 °С. Увеличение температуры от +5 до +20 °С уменьшает срок годности в 4 раза, следовательно в 4*4*4*4*4*4*4 = 47 = 16384 раза сократится срок годности масла при увеличении температуры от +5 до +110 °С, и будет равен 4 месяца/16384 = (4*30*24*60 мин)/16384 = 10,5 минут.
Именно по причине интенсивного протекания реакций ненасыщенных соединений с кислородом воздуха при высоких температурах, приводящих к образованию вредных для человека перекисных соединений и накопления их в термически обработанном масле, настоятельно не рекомендуется использовать в пищу или для жарки масло, ранее уже подвергшееся действию высокой температуры.
Рекомендации к оцениванию:
1) Расчет температурного коэффициента 2 балла = 2 балла
2) Расчет температуры 1 балл = 1 балл
3) Расчет времени 1 балл = 1 балл
4) Срок годности 1 балл = 1 балл
ИТОГО 5 баллов
4. 1-Д, 2-А, 3-Б, 4-В, 5-Г.
Рекомендации к оцениванию:
1) Каждое правильное соответствие по 1 баллу 1∙5 = 5 баллов
ИТОГО 5 баллов
5. Исходя из условия задачи, можно составить уравнение (X + 12 + 16 + 1•3)/(X + 12 + 16 + 1•1) = 1,0168, где Х – масса R, с помощью которого можно вычислить массу углеводородной части молекулы – X. Примем формулу углеводородного остатка молекулы за CnHm, тогда получим уравнение: 12•n + 1•m = X = 91. Единственное решение этого уравнения, дающее химически верные ответ, это n = 7, m = 7. Значит брутто-формула вещества А – C8H8O.
Учитывая степень ненасыщенности углеводородного скелета – 4, можно предположить, что в состав соединения A входит бензольное кольцо. Существование только двух изомеров при бромировании указывает на пара-расположение заместителей. Таким образом соединение А – это пара-метилбензальдегид.
В большем количестве при бромировании пара-метилбензальдегида образуется 3-бром-4-метилбензальдегид, так как метильная группа является орто-/пара-ориентантом, а формильная группа мета-ориентантом.
А – 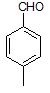 Основной продукт бромирования
Основной продукт бромирования 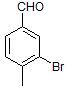
Восстановители: каталитическое гидрирование молекулярным водородом, смешенные гидриды металлов, водород в момент выделения (железо в уксусной кислоте, натрий в этиловом спирте).
Рекомендации к оцениванию:
1) Брутто-формула А 1 балл = 1 балл
2) Структурная формула А 1,5 балла = 1,5 балла
3) Продукт бромирования 1 балл = 1 балл
4) Примеры восстановителей по 0,5 балла 0,5∙3= 1,5 балла
ИТОГО 5 баллов
6. Непоглощенным газом в данных условиях могут быть азот, кислород или их смесь. Для определения данного вещества рассмотрим смесь газообразных продуктов после сгорания. Она состоит из 2,3 л водяных паров, 2,0 л углекислого газа и 1,8 л газа, оставшегося непоглощенным. Тогда можно записать:
(МХ*1,8 + 18*2,3 + 44*2,0)/(1,8 + 2,3 + 2,0) = 40*0,77
Отсюда МХ = 32,5 г/моль, что соответствует чистому кислороду.
Тогда исходное вещество имеет состав ЭСхOyHz.
Исходя из соотношения объемов водяных паров и углекислого газа, а также объема паров исходного вещества, легко установить, что х = 10, а z = 23.
Молярная масса исходного вещества составляет примерно 4,20*40 = 168 г/моль, при этом на фрагмент ЭОy приходится 168 – 10*12 – 23*1 = 25 г/моль. Если у = 1, то искомый элемент имеет молярную массу около 9 г/моль – это бор. Следовательно, искомое соединение ВOC10H23.
Для проверки можно рассмотреть реакцию сгорания данного соединения:
2ВOC10H23 + 32O2 = В2O3 + 23H2O + 20CO2
Таким образом, на полное сгорание 200 мл паров исходного вещества расходуется 3.2 л кислорода, что полностью соответствует условию задачи.
Возможные структурные формулы:В(OCH3)(C4H9)(C5H11), В(CH3)(ОC4H9)(C5H11), В(CH3)(C4H9)(ОC5H11) и т.д.
Рекомендации к оцениванию:
1) Определение соотношения С:Н 1 балл = 1 балл
2) Доказательство того, что непоглощенный газ – кислород 1 балл = 1 балл
3) Вывод формулы исходного вещества 1,5 балла = 1,5 балла
4) Структурные формулы по 0,5 балла 0,5∙3= 1,5 балла
ИТОГО 5 баллов
Дата добавления: 2019-01-14; просмотров: 294; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
