Отборочный (районный) этап. Практический тур
Экспериментальные задачи практического тура отборочного этапа были представлены для 9 – 11 классов в форме презентаций (доступны на сайте олимпиады http://chemspb.3dn.ru)
Класс
Автор задания – Скрипкин М.Ю.
I вариант
Описание эксперимента:
В четырех пронумерованных стаканчиках находятся следующие соли: хлорид аммония, хлорид калия, фосфат калия, иодид калия. Для определения содержимого стаканчиков были проделаны указанные ниже опыты.
1. К порошкам прилили воду – все выданные вещества растворились.
2. Из каждого стаканчика отлили немного раствора и добавили нитрат серебра. Во всех четырех стаканах выпал осадок – в №1 и №2 белый, в №3 и №4 – желтый.
3. К растворам, образующим с нитратом серебра белый осадок, добавили твердый таблетированный гидроксид натрия, у верхней части расположили кусочек фильтровальной бумаги, смоченной фенолфталеином, и нагрели. При этом в одном случае (стакан №2) бумажка окрасилась в малиновый цвет, а в другом (стакан №1) осталась белой.
4. К растворам, из которых при добавлении соли серебра выпал желтый осадок, добавили водный раствор хлорида меди. В одном случае (стакан №4) выпал голубой осадок, в другом (стакан №3) – коричневая смесь осадков.
Задание:
1. Напишите уравнения всех протекавших в ходе эксперимента реакций.
2. Определите содержимое стаканчиков.
II вариант
Описание эксперимента:
В четырех пронумерованных стаканчиках находятся следующие соли: хлорид калия, сульфат калия, карбонат натрия, иодид натрия. Для определения содержимого стаканчиков были проделаны указанные ниже опыты.
|
|
|
1. К порошкам прилили воду – все выданные вещества растворились.
2. Из каждого стаканчика отлили немного раствора и добавили ацетат свинца. Во всех четырех стаканах выпал осадок – в №№ 1, 2 и 4 белый, в №3 – желтый.
3. Выпавшие белые осадки обработали азотной кислотой. В случае №4 наблюдалось выделение газа.
4. К твердым веществам, растворы которых при взаимодействии с раствором ацетата свинца образовывали белый осадок, не взаимодействующий с азотной кислтой, добавили концентрированную серную кислоту и закрыли стаканы влажными лакмусовыми бумажками. При этом в случае №2 бумажка окрасилась в красный цвет, а в №1 окраску не изменила.
5. К раствору, дающему желтый осадок с раствором ацетата свинца (№3), добавили раствор хлорида железа (III), цвет изменился.
Задание:
1. Напишите уравнения всех протекавших в ходе эксперимента реакций.
2. Определите содержимое стаканчиков.
Класс
Автор задания – Скрипкин М.Ю.
I вариант
Описание эксперимента:
Для определения содержания ионов металлов на практике нередко применяют комплексонометрическое титрование. Оно основано на реакции образования комплексного соединения между ионом определяемого металла и веществом-титрантом.
|
|
|
В качестве титранта во многих случаях используется трилон Б – двунатриевая соль этилендиаминтетрауксусной кислоты, Na2H2Y:
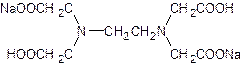
Анион этилендиаминтетрауксусной кислоты Y4- образует с анализируемыми ионами комплексные соединения состава 1:1.
В данном опыте метод комплексонометрического титрования был применен для определения жесткости воды (по суммарному содержанию ионов магния и кальция). Из анализируемого образца отобрали аликвоту 20 мл, разбавили ее дистиллированной водой до 100 мл. К пробе добавили аммиачный буферный раствор (NH3×H2O + NH4Cl, рН = 9) и индикатор хромоген черный Т (в точке эквивалентности из бесцветного стал красным.
После этого к раствору стали по каплям при постоянном перемешивании добавлять из бюретки трилон Б с концентрацией 0,025 ммоль/л. После добавления 10,5 мл титранта окраска раствора сменилась на фиолетовую, а после добавления 10,8 мл титранта – на синюю. Опыт повторили еще 2 раза – результаты эксперимента сходились в пределах 0,1 мл.
Задание:
1. Каково содержание катионов жесткости в образце (в ммоль/л)?
|
|
|
2. Почему титрование выполняют при рН = 9 (слабощелочная среда)? Почему анализируемый раствор не должен быть ни сильнокислым, ни сильнощелочным?
II вариант
Описание эксперимента:
Для определения содержания ионов металлов на практике нередко применяют комплексонометрическое титрование. Оно основано на реакции образования комплексного соединения между ионом определяемого металла и веществом-титрантом.
В качестве титранта во многих случаях используется трилон Б – двунатриевая соль этилендиаминтетрауксусной кислоты, Na2H2Y:
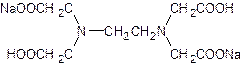
Анион этилендиаминтетрауксусной кислоты Y4- образует с анализируемыми ионами комплексные соединения состава 1:1.
В данном опыте метод комплексонометрического титрования был применен для определения содержания ионов меди в сточных водах гальванического производства. Из анализируемого образца отобрали аликвоту 20 мл, разбавили ее дистиллированной водой до 100 мл. К пробе добавили аммиачный буферный раствор (NH3×H2O + NH4Cl, рН = 9). Раствор стал синим. Затем индикатор мурексид (в точке эквивалентности меняет окраску с желтой на лиловую). Раствор изменил окраску с синей на желто-зеленую (лимонную).
|
|
|
После этого к раствору стали по каплям при постоянном перемешивании добавлять из бюретки трилон Б с концентрацией 0,025 ммоль/л. После добавления 10,3 мл титранта окраска раствора сменилась на лиловую. Опыт повторили еще 2 раза – результаты эксперимента сходились в пределах 0,1 мл.
Задание:
1. Каково содержание ионов меди в образце (в ммоль/л)?
2. Чем обусловлен синий цвет образца после добавления аммиачного буфера?
3. Почему титрование выполняют при рН = 9 (слабощелочная среда)? Почему анализируемый раствор не должен быть ни сильнокислым, ни сильнощелочным?
Класс
Дата добавления: 2019-01-14; просмотров: 242; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
