Тепловой баланс процессов горения
Теплота сгорания вещества
В основе процесса горения лежит химическая реакция горючего вещества с окислителем, которая происходит с интенсивным тепловыделением. Количество теплоты, выделяющееся при полном сгорании единицы количества горючего вещества (моль, кг или м3), называют низшей теплотой сгорания Qн.
Если горючее имеет в своем составе водород, то при его сгорании образуется вода в газообразном состоянии, которая, охлаждаясь, будет конденсироваться. Так как в процессе конденсации паров тепло выделяется, то общее количество теплоты, полученное при сгорании вещества, будет больше на эту величину. Напомним, что количество теплоты, выделяющееся при конденсации паров, равно количеству теплоты, затраченному на парообразование. Тогда:
 ( 11)
( 11)
где Qв – высшая теплота сгорания вещества,
r – удельная теплота парообразования воды.
При расчетах температуры горения пользуются величиной Qн, так как при температуре горения вода находится в газообразном состоянии. Значения низшей теплоты сгорания вещества (тепловой эффект химической реакции) приводится в справочной литературе. Эта величина может быть рассчитана по закону Гесса, который говорит о том, что тепловой эффект химической реакции равен разности сумм теплоты образования продуктов реакции и теплоты образования исходных веществ:
 ( 12)
( 12)
|
|
|
где ΔH0fi – теплота образования i-того вещества,
ni – количество молей i-го вещества.
Напомним из курса химии, что теплота образования сложного вещества равна количеству теплоты, выделившейся при его образовании из простых веществ. Теплота образования простого вещества (вещества, молекулы которого состоят из атомов одного элемента, например, N2, O2, H2, S, C...) принимается равной нулю. Теплота образования некоторых горючих веществ приведена в табл. 24, 25 приложения. При сгорании метана
CH4 + 2O2 = CO2 + 2H2O
Низшая теплота сгорания, согласно закону Гесса (12), равна
 . ( 13)
. ( 13)
Учитывая, что кислород – простое вещество и для него  ,
,
 . ( 14)
. ( 14)
Подставляя значения теплоты образования CO2, Н2O и CH4 из табл. 24 приложения, окончательно получают
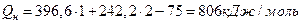 .
.
Температура горения
Под температурой горения понимают максимальную температуру, до которой нагреваются продукты горения. Принято различать адиабатическую температуру горения, рассчитываемую без учета потерь тепла в окружающее пространство, и действительную температуру горения, учитывающую эти теплопотери.
Для расчета температуры горения составим уравнение теплового баланса, считая, что выделившееся в результате сгорания тепло нагревает продукты горения (CO2, H2O, N2...) от начальной температуры T0 до температуры Tг, увеличивая их теплосодержание.
|
|
|
 , ( 15)
, ( 15)
где h – коэффициент теплопотерь (доля потерь тепла на излучение);
Нпгi(Tг)и Нпгi(T0) – значения теплосодержания (энтальпии) i-го продукта горения при температуре горения и начальной температуре;
Vпгi – объем i-го продукта горения.
Если теплосодержание продуктов горения при Т = 273 К принять равным нулю, то
 . ( 16)
. ( 16)
Задача состоит в том, чтобы по известной зависимости теплосодержания газов от температуры методом последовательных приближений найти температуру, при которой будет справедливо это равенство.
Напомним, что адиабатическим называют процесс, происходящий без теплообмена с окружающей средой, поэтому температуру горения, рассчитанную при условии отсутствия теплопотерь, называют адиабатической. И так для адиабатического процесса, так как η = 0
 . ( 17)
. ( 17)
Температура горения зависит от концентрации горючего в горючей смеси. Если горение происходит с избытком воздуха, т.е. при α > 1, то выделившееся в результате сгорания тепло частично затрачивается на нагрев этого лишнего воздуха. В горючей смеси с α < 1 из-за недостатка воздуха полное сгорание горючего вещества произойти не может, поэтому и тепловыделение в такой смеси будет неполным. Из этого можно сделать вывод, что максимальная температура горения будет при сгорании стехиометрической смеси, т.е. при α = 1.
|
|
|
Адиабатическую температуру горения, как правило, рассчитывают для стехиометрической смеси, т.е. при условии α = 1.
Пример 5. Найти адиабатическую температуру горения стехиометрической смеси этана с воздухом, начальная температура горючей смеси Т0 = 273 К.
Решение: Адиабатическую температуру горения вещества находят при условии отсутствия теплопотерь (h = 0) для стехиометрической смеси горючего с воздухом, т. е. при α = 1.
Записывают уравнение горения этана в воздухе
 .
.
Объем продуктов горения составляет VCO2=2 моль/моль; VH2O=3 моль/моль; V0N2=3,5×3,76=13,2 моль/моль.
Избыток воздуха ΔVв = 0, так как a = 1.
Низшую теплоту сгорания этана рассчитаем по закону Гесса, взяв значения теплоты образования веществ из табл. 24 приложения.

Так как теплопотери отсутствуют, то все выделившееся тепло идет на нагревание продуктов горения. Среднее теплосодержание продуктов горения будет составлять
|
|
|

Воспользовавшись зависимостью теплосодержания газов от температуры (табл. 26 приложения), можно установить, какой температуре соответствует такое теплосодержание. Лучше всего это сделать, ориентируясь на азот, так как его больше всего в продуктах горения. Из табл. 26 приложения видно, что при температуре 23000С теплосодержание азота 77,8 кДж/моль. Уточняют, сколько потребовалось бы тепла, чтобы нагреть продукты горения до такой температуры.
При Т1 = 23000С
 ,
,
подставляя численные значения теплосодержаний этих газов из табл. 26 приложения, получают
 .
.
Но это больше, чем выделилось тепла в результате реакции горения
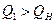 .
.
Поэтому можно сказать, что температура горения меньше, чем 23000С.
Определяют, сколько тепла потребуется для нагревания продуктов горения до 22000С.
При Т2 = 22000С
 .
.
Но и 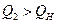 , значит температура горения меньше, чем 22000С.
, значит температура горения меньше, чем 22000С.
Следующий шаг (в этом и состоит суть метода последовательных приближений), выбирают Т3 = 21000С, при этой температуре
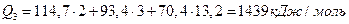 .
.
Это совсем немного больше, чем Qн.
При Т4 = 20000С
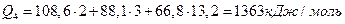 .
.
Q4 уже меньше, чем Qн, из этого можно сделать вывод, что температура горения имеет значение между 20000С и 21000С. Уточняют эту температуру линейной интерполяцией между двумя этими ближайшими значениями

Действительную температуру горения рассчитывают с учетом теплопотерь и для любого заданного состава горючей смеси тем же методом последовательных приближений.
Для приближенных расчетов действительной температуры горения можно использовать формулу
 ( 18)
( 18)
где Српгi – среднее значение теплоемкости i-го продукта горения при постоянном давлении в интервале температур от 273 К до Тг, которая принята равной 1500 К.
Чем больше полученное значение Тг отличается от 1500 К, тем большая погрешность вносится в ее определение. Средние значения теплоемкости продуктов горения при постоянном давлении в температурном интервале 273-1500 К приведены в табл. 3.
Таблица – 3 Удельные теплоемкости продуктов горения
| №п/п | Вещество | Химическая формула | Удельная теплоемкость, Cрi | |
| кДж(м3×К) | кДж/(моль×К) | |||
| 1 | Азот | N2 | 1,41 | 3,18×10-2 |
| 2 | Вода (пар) | H2O | 1,78 | 3,98×10-2 |
| 3 | Воздух | O2 + 3,76N2 | 1,44 | 3,23×10-2 |
| 4 | Диоксид серы | SO2 | 2,28 | 5,11×10-2 |
| 5 | Диоксид углерода | СО2 | 2,27 | 5,08×10-2 |
| 6 | Oксид углерода | СО | 1,50 | 3,37×10-2 |
Температура взрыва
Принципиальное различие между горением и взрывом заключается в скорости процесса. При взрыве химическое превращение происходит настолько быстро, что все выделившееся тепло остается в системе, а образовавшиеся продукты не успевают расшириться, т. е. процесс взрыва является адиабатическим и изохорным (V = const). Количество теплоты, выделившееся при взрыве, примерно равно низшей теплоте сгорания вещества Qвзр≈Qн. Температура взрыва значительно выше адиабатической температуры горения, так как при горении часть тепла, выделившегося при химическом превращении, затрачивается на совершение работы расширения газа, а при взрыве все выделившееся тепло расходуется только на увеличение внутренней энергии системы. Учитывая, что Qвзр≈Qн, а изменение энтальпии (теплосодержания) продуктов реакции происходит лишь в результате изменения внутренней энергии (dH = dU + pdV = dU при dV =0), уравнение теплового баланса для взрыва можно записать в следующем виде
 , ( 19)
, ( 19)
где Uпгi (Твзр) и Uпгi (Т0) – значения внутренней энергии i-го продукта взрыва (горения) при температуре взрыва и начальной температуре.
Если для удобства расчетов принять, что внутренняя энергия газов при Т=273 К равна нулю, то полная внутренняя энергия продуктов взрыва при температуре взрыва будет равна количеству теплоты, выделившейся в результате химической реакции
 . ( 20)
. ( 20)
Температуру взрыва находят методом последовательных приближений так же как адиабатическую температуру горения (Пример 5). Только при расчетах вместо зависимости теплосодержания от температуры используют зависимость внутренней энергии от температуры (табл. 27 приложения).
Пример 6. Определить температуру взрыва газовой стехиометрической смеси этана с воздухом. Начальная температура горючей смеси Т0=273 К.
Решение: Рекомендуется сравнить с решением примера 5. Температуру взрыва находят при условии отсутствия теплопотерь (η = 0). Записывают уравнение химического превращения при взрыве (аналогично уравнению горения)
С2Н6 + 3,5О2 + 3,5×3,76N2 = 2СО2 + 3Н2О + 3,5×3,76N2.
Объем продуктов взрыва составляет VCO2=2 моль/моль; VH2O=3 моль/моль; V0N2=3,5×3,76 = 13,2 моль/моль. Избыток воздуха ΔVв = 0, так как смесь стехиометрическая (α = 1).
Низшую теплоту сгорания этана рассчитывают по закону Гесса, взяв значение теплот образования веществ из табл. 24 приложения.

Так как процесс взрыва адиабатно-изохорный (теплопотери отсутствуют и нагревание продуктов происходит без расширения газовой смеси), все выделившееся тепло расходуется на увеличение внутренней энергии системы. Среднее значение внутренней энергии продуктов взрыва составит

Воспользовавшись зависимостью внутренней энергии газов от температуры (табл. 27 приложения), можно установить, какой температуре соответствует такое значение внутренней энергии. Делают это по азоту, так как его больше всего в продуктах взрыва. Из табл. 27 приложения следует, что при температуре 2900 К внутренняя энергия 1 моля азота составляет 76,4 кДж/моль. Проверяют расчетом, какое количество тепла требуется для того, чтобы продукты взрыва нагреть до этой температуры.
При Т1 = 29000С
 ,
,
подставляя численные значения внутренней энергии для этих газов из таблицы 27 приложения, получают
Q1 = 139,7×2 + 111,7×3 + 76,4×13,2 = 1623 кДж/моль.
Это значительно больше той энергии Qн, которая выделилась при взрыве. Поэтому выберают следующее более низкое значение температуры Т2 = 27000С и определяют, какое количество тепла при этой температуре будут содержать продукты взрыва.
Q2 = 128,9×2 + 102,4×3 + 70,2×13,2 = 1491,6 кДж/моль.
Это тоже больше, чем количество тепла, выделившегося при взрыве (Q2 > Qн), и означает, что температура взрыва ниже этого значения. Рассчитывают, какое количество тепла содержат продукты взрыва при температуре Т3 = 26000С.
Q3 = 123,7×2 + 97,8×3 + 67,4×13,2 = 1430,5 кДж/моль.
Это значение уже меньше, чем Qн, на этом основании можно сделать вывод, что температура взрыва этановоздушной смеси находится между значениями Т3 = 26000С и Т2 = 27000С. Уточняют значение температуры взрыва методом линейной интерполяции

Если сравнить полученное значение температуры взрыва с адиабатической температурой горения (см. ответ в примере 5), можно придти к выводу, что температура взрыва примерно на 500 К выше адиабатической температуры горения. Таким образом, химическое превращение, протекающее в форме взрыва (изохорно-адиабатический процесс), происходит со значительно большим разогревом.
Газовоздушные горючие смеси
Дата добавления: 2019-01-14; просмотров: 1470; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
