Некоторые важные понятия молекулярной физики
В молекулярной физике количество вещества удобно выражать в молях или киломолях. 1 моль вещества – количество вещества в граммах, масса которого численно равна молекулярной массе. Например, масса 1 моля водорода H2 равна 2 г/моль или 2×10-3 кг/моль, а масса 1 моля метана CH4 – 16 г/моль или 16×10-3 кг/моль. 1 киломоль вещества в тысячу раз больше 1 моля, поэтому его масса в 103 раз больше, например, для метана масса 1 киломоля составляет 16 кг/кмоль.
Примечание. При определении массы моля вещества можно воспользоваться табл. 23 приложения, в которой приведены атомные массы элементов.
В связи с тем, что масса 1 моля вещества численно равна его молекулярной массе, то в 1 моле любого вещества содержится одинаковое количество молекул. Оно составляет N A=6,02×1023 молекул/моль (число Авогадро). Поэтому в газообразном состоянии 1 моль любого вещества при нормальных условиях занимает один и тот же объем, равный 22,4 л. Таким образом, объем 1 моля любого газа при Т0= 273 К и Р0 =1,013×105 Па составляет 22,4 л/моль или 22,4×10-3 м3/моль. Объем 1 киломоля в тысячу раз больше и равен 22,4 м3/кмоль.
Объем 1 моля газа можно определить из уравнения состояния (Клапейрона – Менделеева)
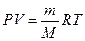 , ( 1)
, ( 1)
где m - масса вещества,
М – масса одного моля вещества,
m/M – число молей вещества,
R – универсальная газовая постоянная (R=8,31Дж/(моль×К)).
Для одного моля вещества (m/M=1) объем газа при нормальных условиях составит:
|
|
|
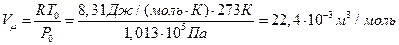
где Дж=Н×м, Па=Н/м2.
Плотность вещества в газообразном состоянии при нормальных условиях:
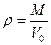 . ( 2)
. ( 2)
Если условия отличаются от нормальных, то необходимо ввести поправки на температуру и давление. Для этого можно использовать объединенный газовый закон:
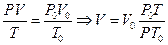 . ( 3)
. ( 3)
Использование таких величин, как масса и объем 1 моля вещества позволяет значительно упростить решение многих практических важных задач, когда необходимо по известной массе вещества найти его объем в газообразном состоянии или наоборот.
Пример 1. Какой объем паров образуется при испарении 20 кг ацетона? Условия считать нормальными ( Т = 273 К, Р = 101, 3 кПа).
Решение: Воспользовавшись табл. 23 приложения, где приведены атомные массы углерода, водорода и кислорода, находят молекулярную массу ацетона (С3Н6О).
М=12×3+1×6+16×1=58, это означает, что масса 1 кмоля ацетона равна 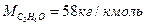 , а количество киломолей испарившегося ацетона составит:
, а количество киломолей испарившегося ацетона составит:
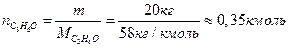
Тогда объем паров ацетона 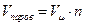 , где Vm - объем 1 кмоля вещества при нормальных условиях, Vпаров = 22,4 м3/кмоль × 0,35 кмоль = 7,8 м3.
, где Vm - объем 1 кмоля вещества при нормальных условиях, Vпаров = 22,4 м3/кмоль × 0,35 кмоль = 7,8 м3.
Пример 2. В баллоне объемом 40 л находится кислород под давлением 150 ат. Найти массу этого кислорода. Температуру принять равной нормальной (Т=273 К).
|
|
|
Решение: Находят объем кислорода при нормальных условиях. Согласно объединенному газовому закону (формула 3) 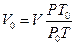 . По условию задачи Т=Т0=273 K, Р=150×Р0.
. По условию задачи Т=Т0=273 K, Р=150×Р0.
Тогда, V0=V×150=40л×150=6000л=6м3 (при н.у.).
Масса кислорода, находящегося в баллоне, составит
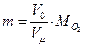 , где Vm=22,4м3/кмоль,
, где Vm=22,4м3/кмоль, 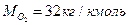 (см. табл. 23, 24 приложения)
(см. табл. 23, 24 приложения)
Дата добавления: 2019-01-14; просмотров: 680; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
