Материальный баланс процессов горения
Уравнение материального баланса
При горении веществ в воздухе происходит быстрая химическая реакция между горючим веществом и кислородом воздуха с интенсивным тепловыделением. В результате этой реакции образуются в основном окислы элементов, входящих в состав горючего вещества. При сгорании углеводородов, состоящих из атомов С и Н, образуется СО2 (двуокись углерода) и Н2О (вода). При неполном сгорании наряду с ними образуются СО (окись углерода) и Сn(тверд) (углерод) в виде сажи. При написании уравнения горения и составлении материального баланса, как правило, записывают только продукты полного окисления СО2 и Н2О. Если в составе горючего вещества есть сера (S), то при сгорании образуется SО2. Азот (N), входящий в состав горючего вещества, при горении в воздухе не окисляется, а выделяется в виде свободного азота (N2). Объясняется это тем, что при горении в воздухе температура горения относительно невысокая (1500-2000 К) и при такой температуре окислы азота не образуются.
Примеры реакций горения:
горение пропана С3H8 + O2 → CO2 + H2O
горение ацетона С3H6O + O2 → CO2 + H2O
горение сероуглерода CS2 + O2 → CO2 + SO2
горение сероводорода H2S + O2 → H2O + SO2
горение аммиака NH3 + O2 → N2 + H2O
Согласно закону сохранения массы количество атомов каждого элемента в левой и правой части химического уравнения должно быть одинаковым. Для того, чтобы уравнять обе части уравнения, рекомендуется сначала расставить коэффициенты перед окислами в правой части с тем, чтобы уравнять число атомов элементов горючего вещества (С, Н, S, N …). Затем, подсчитав количество атомов кислорода в правой части уравнения, поставить коэффициент перед кислородом в левой части уравнения. При этом необходимо учесть кислород, который может входить в состав молекулы горючего вещества (например, как это имеет место в ацетоне С3Н6О или этиловом спирте С2Н5ОН). С учетом вышесказанного запишем уравнения реакций горения вышеприведенных веществ:
|
|
|
С3Н8 + 5О2 = 3СО2 + 4Н2О
С3Н6О + 4О2 = 3СО2 + 3Н2О
СS2 + 3О2 = СО2 + 2SО2
Н2S + 1,5О2 = Н2О + SО2
NН3 + 0,75О2 = 0,5N2 + 1,5Н2О
Необходимо помнить, что записанные уравнения химических реакций горения являются брутто-уравнениями, которые показывают только начальное и конечное состояние системы, т.е. какие исходные вещества вступают в реакцию и какие продукты при этом образуются. Они не отражают механизма химического взаимодействия при горении.
Уравнение материального баланса процесса горения отличается от уравнения химической реакции тем, что в него для удобства расчетов включают азот, содержащийся в воздухе и не участвующий в химическом превращении. Поскольку воздух состоит из 21 % (об.) кислорода и 79 % (об.) азота, т.е. в нем на 1 моль кислорода приходится 79/21 = 3,76 молей, в уравнении материального баланса перед азотом ставят коэффициент 3,76.
|
|
|
Например, уравнение материального баланса для горения пропана будет следующим:
С3Н8 + 5О2 + 5∙3,76N2 = 3СО2 + 4Н2О + 5∙3,76N2.
Коэффициент, который записывают перед О2 (в данном случае 5) необходимо повторить и перед N2, так как азот и кислород в воздухе неразделимы.
Объем воздуха, необходимый для горения, и объем продуктов горения
Уравнение материального баланса позволяет рассчитывать количество воздуха, необходимое для горения любого горючего вещества и количество образующихся продуктов горения.
Минимальное количество воздуха, необходимое для полного сгорания единицы количества (кг, кмоль, м3) горючего вещества, называется теоретическим количеством воздуха V в 0.
Рассмотрим для примера материальный баланс процесса горения бензола в воздухе:
C6H6 + 7,5O2 + 7,5×3,76N2 = 6CO2 + 3H2O + 28,2N2.
Из этого уравнения видно, что для полного сгорания 1 кмоля бензола требуется (7,5 + 7,5·3,76) кмолей воздуха, который состоит из 7,5 кмолей O2 и 7,5×3,76 кмоля, не принимающего участия в горении N2. При сгорании 1 кмоля бензола образуется 6 кмолей СО2, 3 кмоля H2O и остается не участвовавший в химическом превращении 7,5×3,76 = 28,2 кмоля N2.
|
|
|
В общем виде формула для расчета количества воздуха:
 , ( 4)
, ( 4)
где  - число кмолей кислорода, азота и горючего вещества в уравнении материального баланса, кмоль.
- число кмолей кислорода, азота и горючего вещества в уравнении материального баланса, кмоль.
А для расчета объема продуктов горения:
 ,
,  и
и  ( 5)
( 5)
где  - количество кмолей веществ в правой части уравнения материального баланса,
- количество кмолей веществ в правой части уравнения материального баланса,  - объем азота из воздуха, участвовавшего в горении, кмоль/кмоль.
- объем азота из воздуха, участвовавшего в горении, кмоль/кмоль.
Общий объем продуктов горения определяется по формуле:
 ( 6)
( 6)
Горючая газовоздушная смесь, соответствующая уравнению материального баланса называется стехиометрической. В такой смеси нет ничего лишнего, горючее и окислитель находятся в пропорции, обеспечивающей полное ее сгорание.
Для вышеприведенного примера стехиометрическая смесь состоит из 1 объема бензола (пары в газообразном состоянии), 7,5 объемов кислорода и 7,5×3,76 объемов азота. При сгорании такой смеси в продуктах горения будет только СО2, Н2О и N2 в объемах, соответствующих правой части уравнения.
|
|
|
При горении расход воздуха может отличаться от теоретически необходимого. Отношение количества воздуха, участвовавшего в горении к теоретически необходимому, называется коэффициентом избытка воздуха

Действительный расход воздуха на единицу горючего записывается как Vв = aV0в. Разность между действительным и теоретически необходимым количеством воздуха называется избытком воздуха.
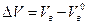 или
или  . ( 7)
. ( 7)
Для стехиометрической смеси α = 1 и ΔVв =0.
Если горение происходит с избытком воздуха (α > 1), то азота в продуктах горения будет больше (добавится азот из избытка воздуха):
 ( 8)
( 8)
и в продуктах горения появится кислород
 . ( 9)
. ( 9)
В этом случае полный объем продуктов горения
 или
или  . ( 10)
. ( 10)
Для газообразных горючих веществ расчет объемов воздуха и продуктов горения чаще всего проводят в м3/м3. Так как 1 кмоль любого газа в одинаковых условиях занимает один и тот же объем (при нормальных условиях 22,4 м3), то объем, рассчитанный в м3/м3, численно будет таким же, как и в кмоль/кмоль.
Если горючее вещество находится в конденсированном состоянии (жидком или твердом), то, как правило, расчеты объемов воздуха и продуктов горения проводят в м3/кг. Для этого кмоль воздуха или продукта горения переводят в м3, умножая на объем одного кмоля газа (22,4 м3/кмоль), а кмоль горючего переводят в кг, умножая на массу одного кмоля горючего (Мг, кг/кмоль). Например, при сгорании 1 кг гептана
С7Н16 + 11O2 + 11×3,76N2 = 7CO2 + 8H2O + 11×3,76N2
требуется воздуха

Образуется

и далее по химическому уравнению.
Пример 3. Определить какое количество воздуха потребуется для сгорания 1 м3 пропана и какое количество продуктов сгорания при этом образуется. Сгорание происходит при α = 1 (стехиометрическая смесь; температуру и давление считать нормальными).
Решение: Записывают уравнение материального баланса горения пропана
C3H8 + 5O2 + 5×3,76N2 = 3CO2 + 4H2O + 5×3,76N2 .
Объем воздуха, необходимый для горения

Объем продуктов горения
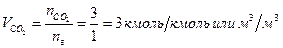


так как α = 1, избыток воздуха ΔVв = 0, тогда полный объем продуктов горения

Таким образом, для сгорания 1 м3 пропана требуется 23,8 м3 воздуха, объем продуктов сгорания при этом составит 25,8 м3 (при н.у.).
Пример 4. Определить объемы воздуха и продуктов горения при нормальных условиях, если при пожаре на складе сгорело 1000 кг ацетона, а горение протекало при a=2.
Решение: Записывают уравнение материального баланса горения ацетона в воздухе
C3H6O + 4O2 + 4×3,76N2 = 3CO2 + 3H2O + 4×3,76N2 .
Объем воздуха, необходимого для сгорания 1 кг ацетона

учитывая, что масса одного киломоля ацетона составляет 58 кг/моль, получают
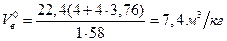
Действительный объем воздуха с учетом коэффициента избытка воздуха a = 2.

а избыток воздуха

Объем продуктов горения

С учетом избытка воздуха полный объем продуктов горения

При сгорании 1000 кг ацетона объем воздуха при нормальных условиях составит 14,8 м3/кг×1000 кг = 14 800 м3, а объем продуктов горения 15,5 м3/кг×1000 кг = 15 500 м3.
Примечание. Если в процессе горения были заданы другие значения температуры и давления, то объем продуктов горения и воздуха рассчитывается с учетом объема, который занимает один кмоль газа при этих условиях:

где P0 = 101,3 кПа;
T0 = 273,15 К;
T и P – заданные температура и давление.
Дата добавления: 2019-01-14; просмотров: 2943; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
