Патология гипоталамо-аденогипофизарной системы. Парциальная и тотальная гипо- и гиперфункция передней доли гипофиза.
Гипофункция гипоталамо- аденогипофизарной системы (соматотропин, тиреотропин, гонадотропины, кортикотропные гормоны)
В эксперименте удаления всего гипофиза или его передней доли у животных развивается дезорганизация обмена веществ и регуляции эндокринных функций. Резкое нарушение роста и развития, недостаточное образование гормонов в периферических железах – щитовидной, надпочечных и половых.
Пангипопитуитаризм – полная недостаточность функций гипофиза. Врожденная или приобретенная. Причины: опухоль, некроз гипофиза, травма основания черепа, воспаление, тромбоз, вирусная инфекция. Проявления: карлоиковость, половое недоразвитие, ослабление функций щитовидной железы, снижение реактивности.
Гипофизарная кахексия (болезнь Симмондса) – разрушение более 95% массы железы на почве тяжелых родовых кровотечений и послеродовых осложнений, инфекционных, токсических, сосудистых, травматических и опухолевых поражений аденогипофиза и/или гипоталамуса. Проявления: истощение, атрофия щитовидной, надпочечных и половых желез, мышечной ткани, разрушение костной ткани, выпадение зубов, волос, гипогликемия. Большинство нарушений связано с прекращением выработки соматотропина и картикотропина.
Гипоталамо-гипофизарная карликовость = нанизм – генетическое заболевание, обусловлено абсолютным или относительным дефицитом СТГ. Основное проявление – резкое осттавание в росте и физическом развитии.
|
|
|
Гипоталамо-гипофизарная микроспланхия – дефицит соматолиберина и СТГ. Проявление – недоразвитие органов брюшной полости, главным образом уорочение кишечника.
Гипоталамо-гипофизарная гипотиреоз – нарушение синтеза и инкреции тиролиберина гипоталамусом и/или гитиреотропина аденогипофизом. Проявление: недостаточность тиреоидных гормонов.
Гипоталамо-гипофизарная гипогонадизм. Проявления: у мальчиков – гипоплазия яичек, физическое и половое недоразвитие, у девочек – отсутствие менструаций, бесплодие. Для всех характерны астеническое телосложение, недоразвитая скелетная мускулатура, тонкая бледная кожа, нарушение поведения, быстрая смена настроения.
2. Гиперфункция гипоталамо- аденогипофизарной системы .
Гипофизарный гигантизм = акромегалия – гиперпродукиця СТГ. Причина: эозинофильная аденома гипофиза. Механизм: СТГ повышает проницаемость клеточных оболочек для аминокислот, ускоряет их включение в белок, тормозит распад белков. Проявления: отдельные части тела непропорционально увеличиваются, черты лица резко укрупняются, спланхомегалия - увеличение печени, селезенки, сердца. Часто наблюдается гипергликемия, так как СТГ воздействует на различные звенья регуляции углеводного обмена.
|
|
|
Болезнь Иценко-Кушинга – увеличение выработки кортикотропина → чрезмерная секреция кортизола и др. гликокортикоидов надпочечными железами. Причина: базофильная аденома аденогипофиза или избыточный синтез кортиколиберина передним гипоталамусом. Проявления: ожирение лица, живота, спины и шеи, наличие стрий – красно-багровых полос растяжения, артериальная гипертензия, остеопороз, гипергликемия, нарушение свертываемости крови, головные боли, общая слабость, сонливость и жажда.
Патология гипоталамо-нейрогипофизарной системы.
Несахарный диабет –характеризуетсянарушениемводно-солевого баланса и избыточным выделением мочи (полиурией)вследствие снижения концентрационной функции почек.Причины возникновения заболевания во многом остаются неясными, но отмечена связь этой эндокринопатии с генетическими дефектами, а также с черепно-мозговой травмой, инфекционными поражениями ЦНС и заболеваниями почек.
Несахарный диабет вызывается недостаточностью эффектов антидиуретического гормона (АДГ). Она может быть обусловленауменьшением продукции АДГ нейросекреторными клетками гипоталамуса и/или снижением чувствительности рецепторов эпителия почечных канальцев к гормону. Последний механизм развития болезни наиболее часто встречается в детском возрасте, преимущественно у мальчиков.
|
|
|
Объем мочи, теряемой взрослым пациентом за сутки, может достигать 10-12 литров. Наблюдается учащенное мочеиспускание ночью (никтурия). Больные постоянно испытывают жажду и потребляют большое количество жидкости.
Синдром неадекватной секреции АДГ. Этот симптомокомплекс возникает в результате избыточной продукциинейросекреторными клетками ядер гипоталамуса АДГ и характеризуется задержкой воды в организме. Гиперсекреция АДГбывает перманентной и транзиторной. Перманентная форма патологии связана с образованием АДГ - продуцирующих опухолей. Транзиторная форма эндокринопатии возникает при тяжелых стрессах, а также вследствие лекарственной стимуляции нейрогипофизарной системы (амитриптилин, финлепсин, опиаты).
Разнонаправленные колебания содержания АДГ приводят к чередованию олиго- и полиурии, отекам подкожной клетчатки, поражению миокарда и нарушениям сердечного ритма. Бесконтрольное употребление воды может вызывать гипергидратацию (водное отравление) организма.
|
|
|
95. Патология коры надпочечников. Парциальная и тотальная гиперфункция
Надпочечники являются жизненно важными парными железами. В них вырабатываются две группы гормонов - кортикостероиды (минерал- и глюкокортикоиды, сексоиды) и катехоламины. Кортикосероиды образуются в коре, а катехоламины - в мозговом веществе надпочечников.
В условиях патологии нарушения функции надпочечников проявляются в виде гиперфункции и гипофункции. Гипо- и гиперфункция надпочечников могут быть тотальной или частичной (парциальной). Тотальная гиперфункция надпочечников связана с избыточным образованием кортикотропина (например, при болезни Иценко-Кушинга), а парциальная - с избыточной продукцией отдельных кортикостероидов (альдостеронизм; гиперкортизолизм; адреногенитальный синдром). В некоторых случаях развивается дисфункция надпочечников, которая характеризуется разнонаправленными изменениями секреции гормонов.
Классическим примером является врожденный адреногенитальный синдром, при котором вследствие наследственного дефицита фермента 21-гидроксилазы не образуется кортизол и по принципу обратной связи увеличивается секреция кортикотропина, следствием чего является избыточная секреция сексоидов, особенно андрогенов
96. Гиперкортизолизм. Этиология, патогенез, основные проявления.
Этиология. Три основные группы причин вызывают гиперкортизолизм –
1) развитие опухоли гипоталамуса или гипофиза с избыточной секрецией кортикотропина (болезнь Иценко-Кушинга). Кроме того, некоторые опухоли вне гипоталамуса и гипофиза также способны секретировать кортикотропин (наиболее часто карциномы легких, поджелудочной железы, тимуса, щитовидной железы),
2) Развитие опухоли пучковой зоны коры надпочечников (синдром Иценко-Кушинга).
3) Избыточное введение извне глюкокортикоидов
Патогенез. Только лишь на основании знания биологических эффектов глюкортикоидов можно понять происхождение всех проявлений гиперкортизолизма. Так, в связи с увеличением минералокортикоидного эффекта глюкокортикоидов при гиперкортизолизме наблюдается ЗАДЕРЖКА НАТРИЯ в крови и УМЕНЬШЕНИЕ КАЛИЯ в связи с его потерей с мочой. Учитывая увеличение секреции одновременно с калием и ионов водорода, формируется ГИПОКАЛИЕМИЧЕСКИЙ АЛКАЛОЗ.
Развитие гипертензии при заболеваниях почек обусловлено тремя механизмами: задержкой натрия и воды, увеличением активности прессорной и снижением функции депрессорной системы почек
При гиперкортизолизме наблюдается регионарное ожирение в области лица (лунообразное лицо), шеи, туловища. Ноги остаются худыми. Поэтому такое ожирение получило название РЕГИОНАРНОГО ОЖИРЕНИЯ. Развитие его связано с изменениями зон гипоталамуса, ответственных за жировой обмен, а также связано с увеличением аппетита и количества потребляемых продуктов. Учитывая, что глюкокортикоиды являются основными контринсулярными гормонами, и их эффекты направлены на увеличение уровня сахара в крови за счет глюконеогенеза, активации глюкозо-6-фосфатазы и подавления активности гексокиназы, становится понятной склонность к ГИПЕРГЛИКЕМИИ, особенно в условиях наследственно обусловленной или приобретенной недостаточности инсулярного аппарата поджелудочной железы. В этих условиях возможно развитие стероидного диабета.
Склонность к инфекции и явление остеопороза связаны с катаболическими эффектами глюкокортикоидов. В этом случае за счет усиления катаболизма белка в лимфоидных узлах и тимусе, а также торможения митоза лимфоцитов, и формирования лимфопении, и уменьшения синтеза антител, развивается одновременно с инволюцией тимиколимфотической системы приобретенный иммунодефицит. Отсюда такие больные склонны к ИНФЕКЦИИ, особенно к туберкулезу.
Учитывая превалирование катаболизма белка в костях и снижение его синтеза, уменьшается белковый остов костей и затрудняется отложение кальция. При уменьшении кальция в кости на 30 % и более возникает разрежение костной ткани (ОСТЕОПОРОЗ) и повышается ломкость костей. Возможны спонтанные переломы.
Превалирование катаболизма белка в коже ведет к ее истончению, особенно в нижней части живота. Сосуды становятся более видимыми и поэтому формируются багровые полосы (СТРИИ).
Основные проявления гиперкортизолизма:
1. Задержка натрия, уменьшение калия,
2. Регионарное ожирение.
3. Склонность к гипергликемии.
4. Склонность к гипертензии.
5. Склонность к инфекциям.
6. Остеопороз.
7. Стрии.
8. Гипокалиемический алкалоз.
97. Альдостеронизм. Этиология, патогенез, основные проявления.
Этиология. Увеличение секреции альдостерона может быть первичным, т.е. обусловленным развитием опухоли в клубочковой зоне коры надпочечников (синдром Конна) или вторичным - при дефиците натрия, избыточной продукции ангиотензина II - например, при сердечной едостаточности, шоке, поражении почек, печени
Патогенез. При первичном альдостеронизме содержание альдостерона в крови увеличивается в 40-100 раз. Вследствие избыточного эффекта альдостерона в почках реабсорбируется натрий и секретируется калий. Поэтому в крови регистрируется ГИПЕРНАТРИЕМИЯ и ГИПОКАЛИЕМИЯ.
Накопление ионов натрия в мышцах повышает их возбудимость и первоначально регистрируются мышечные подергивания, а как только количество ионов калия в крови уменьшается на 10-30 %, возбудимость мышц уменьшается, и поэтому регистрируется ГИПО- И АДИНАМИЯ. В связи с усиленной секрецией в почках ионов водорода формируется явление АЛКАЛОЗА. В результате задержки натрия количество его нарастает в крови до определенного уровня, а затем натрий начинает теряться с мочой (синдром утечки). Кроме того, вследствие резкого уменьшения калия в канальцевом аппарате почек снижается его чувствительность к АДГ. Все это способствует УВЕЛИЧЕНИЮ ДИУРЕЗА. Отсюда становится понятным отсутствие отека при первичном альдостеронизме. Только при вторичном альдостеронизме наиболее характерными являются ОТЕКИ, т.к. не возникает феномен утечки натрия, а задержка его постоянно прогрессирует.
Основные проявления альдостеронизма следующие:
1. Гипернатриемия и гипокалиемия;
2. Склонность к судорогам с последующей гипо- и адинамией;
3. Гипертензия;
4. Алкалоз;
5. Увеличение диуреза;
6. Отеки (только при вторичном альдостеронизме).
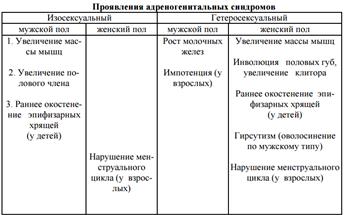
98. Адрено-генитальный синдром. Этиология, патогенез, основные проявления.
Нарушение функций надпочечников может сопровождаться увеличением секреции гормонов сетчатой зоны - андро- и эстрогенов с последующим нарушением гениталий.
Если в организме увеличивается количество гормонов, соответственных данному полу (андрогены у индивидов мужского, а эстрогены у индивидов женского пола), такой адреногенитальным синдром называется изосексуальным, а если избыточно секретируются гормоны, свойственные преимущественно противоположному полу, то формируются гетеросексуальный адрено-генитальный синдром
Этиология. Причиной является или врожденный дефект синтеза гормонов в коре надпочечников (При врожденном дефекте фермента 21-гидроксилазы, которая необходима для синтеза кортизола по принципу обратной связи усиливается образование кортикотропина, который стимулирует все три зоны коры надпочечников, а так как обратная связь для образования кортикотропина функционирует только лишь по отношению к глюкокортикоидам, а они не образуются, происходит постоянная стимуляция образования кортикотропина, следствием чего и является избыточная секреция сексоидов сетчатой зоны коры надпочечников), или, как правило, развитие опухоли сетчатой зоны коры надпочечников.
Патогенез. Если избыточно секретируются андрогены во внутриутробном периоде у индивида женского пола, то происходит нарушение образования наружных половых губ, увеличение клитора к моменту рождения, а через несколько лет за счет усиления синтеза белка в мышцах и стимуляции волосяных фолликулов наблюдается увеличение массы мускулатуры и оволосение по мужскому типу, огрубение голоса. Аналогичные изменения происходят в организме женщины при развитии опухоли сетчатой зоны и избыточной продукции андрогенов. Кроме того, у них наблюдаются нарушение менструального цикла. Если врожденные расстройства у индивидов мужского пола сопровождаются избытком андрогенов, то к моменту рождения у мальчика отмечается увеличение размера полового члена, и к 4-5 годам формируется мальчик- геркулес с хорошо развитой мускулатурой, низким ростом, увеличенным половым членом. Сперматогенез, как правило, нарушен, т.к. по принципу обратной связи подавляется образование гонадотропинов в гипофизе. При увеличении эстрогенов в организме мужского пола наблюдаются явления ФЕМИНИЗАЦИИ (рост молочных желез, изменение голоса, импотенция у взрослых).
99. Острая и хроническая недостаточность коры надпочечников. Этиология, патогенез, основные проявления.
Недостаточность коры надпочечников может быть первичной (в результате поражения коры надпочечников) или вторичной (в результате дефицита кортикотропина, обусловленного нарушением функции гипоталамуса или аденогипофиза). Причем в коре возникают атрофические изменения вследствие выпадения стимулирующих влияний кортикотропина на кору надпочечников.
По течению кортикостероидная недостаточность может быть острой и хронической.
Острая кортикостероидная недостаточность возникает при тяжелых инфекционных процессах, ДВС-синдроме, кровоизлияниях в надпочечники, синдроме отмены, а в эксперименте при удалении надпо чечников у животных.
Наиболее частыми причинами хронической недостаточности являются аутоиммунные поражения, атрофия неизвестной этиологии и туберкулезное разрушение надпочечников. Признаки хронической кортикостероидной недостаточности возникают при разрушении 95 % массы надпочечников. Проявления острой и хронической кортикостероидной недостаточности обусловлены дефицитом минерал-, глюкокортикоидов и сексоидов и являются аналогичными, за исключением выраженной пигментации, особенно открытых частей тела (лица, шеи, кистей рук). Вследствие этого хроническая кортикостероидная недостаточность получила название бронзовой болезни или болезни Аддисона. Бронзовая окраска отсутствует при вторичной недостаточности надпочечников, т.к. в ее основе лежит уменьшение образования кортикотропина. Развитие бронзовой окраски связывают с избыточной секрецией кортикотропина по принципу обратной связи из-за невозможности образования глюкокортикоидов в надпочечниках. Полагают, что кортикотропин, а также меланотропин стимулируют образование меланина в клетках, что и дает бронзовую окраску кожных покровов.
Патогене.
В связи с уменьшением или полным прекращением выделения альдостерона, кортизола и кортикостерона невозможен их минерал- кортикоидный эффект в почках. С мочой теряется большое количество натрия и не секретируется калий. Поэтому в крови снижается уровень натрия и повышается содержание калия. В связи с расстройствами электролитного баланса снижается возбудимость адренорецепторов сосудов к действию вазопрессоров. Кроме того, накопление калия в крови способствует брадикардии. Уменьшается объем циркулирующей крови. Все это ведет к снижению МОК и общего периферического сопротивления и, следовательно, к гипотензии. Уменьшение концентрации ионов натрия в крови ведет к снижению возбудимости мышц. Кроме того, в связи с дефицитом питательных веществ из-за нарушения аппетита, секреторных процессов, переваривания в желудочно-кишечном тракте, расстройств процессов фосфорилирования в мышцах, а также формирующейся гипотензии, у больного нарушается мышечная активность, нарастают явления усталости, и поэтому больной основную массу времени проводит в постели. Кроме того, вследствие выпадения аффектов андрогенов (особенно дегидроандростерона) уменьшается синтез сократительного белка в мышцах. Снижение возбудимости мышц, гипотензия и нарушение синтеза сократительных белков мышц и ведут к гипо- и адинамии. Из-за выпадения глюкокортикоидных эффектов глюко- и минералкортико- идов, которые являются главными контринсулярными гормонами, начинают преобладать эффекты инсулина. Кроме того, нарушается аппетит и всасывание пищевых веществ. Все это и ведет к гипогликемии. Уменьшение окислительно-восстановительных процессов, дефицит основного энергетического субстрата - глюкозы, формирование гипотензии, превалирование парасимпатических эффектов ведет к снижению температуры тела. Учитывая, что при дефиците глюкокортикоидов уменьшается процесс фильтрации в почках, развивается гипотензия и снижается объем циркулирующей крови, следует ожидать уменьшение суточного диуреза. Сложные электролитные и другие обменные расстройства ведут к уменьшению аппетита, вплоть до его отсутствия (анорексия), уменьшению секреторных процессов, процессов переваривания и всасывания. А уже следствием указанных процессов является уменьшение массы тела - исхудание. В связи с тем, что гормоны надпочечников выполняют важнейшую адаптивную роль, становится понятным снижение резистентности организма к ряду экстремальных факторов - шоку, кровопотере, электрическому току, коллапсу.
Наиболее общие проявления острой и хронической недостаточности надпочечников следующие:
1. Увеличение в крови К+ , снижение Na+ ,
2. Гипотензия;
3. Гипо- и адинамия;
4. Гипогликемия;
5. Уменьшение слюноотделения, желудочного и кишечного соков;
6. Уменьшение аппетита с развитием анорексии;
7. Исхудание;
8. Снижение температуры тела;
9. Уменьшение диуреза;
10. Возможная тошнота, рвота, запор или понос
100. Гипертиреоз. Этиология, патогенез, основные проявления.
ЭТИОЛОГИЯ ГИПЕРТИРЕОЗА.
1. Образование длительно действующего тиреоидного стимулятора, который представлен антителами против щитовидной железы. Образованию анти тел предшествует предварительное повреждение щитовидной железы (грипп, ангина, туберкулез).
2. Избыточная продукция ТТГ, например, при климаксе, беременности, мен- струации, при тяжелых переживаниях, особенно у женщин.
3. Опухоли щитовидной железы.
4. Внетиреоидные причины (уменьшение белков крови и слабая связь с ними йодсодержащих гормонов, недостаточность печени, при гиперкалиемии и фосфатемии усиливаются эффекты соответственно тироксина и триоидтиронина)
Патогенез.
Энергообмен. При избытке тироксина и трийодтиронина происходит набухание митохондрий и разобщение дыхания и окислительного фосфорилирования, уменьшение АТФ. Именно дефицит энергии при гипертиреозе ведет к дистрофическим из- 215 менениям в сердце с развитием в последующем его недостаточности. За счет нарушения процессов фосфорилирования происходит увеличение первичной теплоты, которая не успевает выделяться из организма, и поэтому температура тела повышается до 37,1-37,4°С, т.е. развивается субфебрилитет, и одновременно в связи с повышенным потреблением кислорода на 15-50 % повышается чувствительность организма к гипоксии
Белковый обмен. при гипертиреозе повышается возбудимость нервной системы, особенно симпато-адреналовой, что клинически, в частности, проявляется мышечной дрожью, особенно пальцев рук с расстройством почерка. В последующем как при гипо-, так и гипертиреозе нарушается память, ослабляются процессы торможения, возникают явления психи- ческой неустойчивости. Периоды возбуждения сменяются периодами депрессии, возможно развитие тиреотоксического психоза. При избыточном количестве гормонов усиливается распад эндогенных белков и развивается отрицательный азотистый баланс, за счет распада скелетно-мышечных белков и сердечной мышцы.
Углеводный обмен. Избыток йодсодержащих гормонов усиливает всасывание глюкозы в кишечнике, повышает активность инсулиназы печени и активирует симпатоадреналовую систему. Все это ведет к мобилизации гликогена с уменьшением его количества в печени, мышцах, сердце. Поэтому вначале появляется склонность к гипергликемии и, в крайнем случае, возможно истощение бета-клеток поджелудочной железы и развитие тиреоидного диабета
Жировой обмен. При гипертиреозе усиливается всасывание жиров в кишечнике, мобилизация его из депо. Поэтому будет характерна гипергликемия. Одновременно усиливается окисление жирных кислот в печени с увеличением образования кетоновых тел и холестерина. Гиперхолестеринемии не наблюдается
Мин.обмен При гипертиреозе в связи с активацией симпатоадреналовой системы включается и система ренин-ангиотензин-альдостерон. Поэтому увеличивается образование альдостерона, а вместе с ним и усиление секреции калия. Эти электролитные расстройства, повышение чувствительности альфа-адренорецепторов сосудов и бета-рецепторов сердца будут вести к тахикардии, причем МОК увеличивается до 9000 мл/мин (норма около 6000 мл/мин), и повышению артериального давления.
Осн. эффекты
1. Увеличение потребления кислорода.
2. Повышенная возбудимость, раздражительность, бессонница.
3. Влажная теплая кожа.
4. Повышение аппетита.
5. Непереносимость тепла.
6. Субфебрилитет.
7. Тахикардия.
8. Гипертензия.
9. Исхудание.
10. Эритроцитоз.
11. Гипохолестеринемия.
12. Склонность к гипергликемии.
13. Зоб.
14. Экзофтальм.
15. Отрицательный азотистый баланс.
16. Тиреотоксический криз.
101. Гипотиреоз. Этиология, патогенез, основные проявления.
ЭТИОЛОГИЯ ГИПОТИРЕОЗА.
1. Врожденная недостаточность или как следствие родовой травмы, например кровоизлияния, опухоли в гипофизе и гипоталамусе с нарушением образования ТТГ (вторичный или центральный гипотиреоз);
2. Тиреоидэктомия;
3. Неумеренное применение радио- и рентгенотерапии;
4. Воспалительные процессы в щитовидной железе;
5. Дефицит йода в пище и воде (первичный или периферический гипотиреоз);
6. Уменьшение количества ядерных рецепторов для тиреоидных гормонов.
Патогенез.
Энергообмен. При гипотиреозе уменьшается интенсивность окислительных и восстановительных процессов. Поэтому снижается потребление кислорода, образование АТФ, с последующим нарушением синтеза белковых веществ. Наблюдается склонность к гипотермии. Отсюда больные не переносят холода. Это может завершиться микседемной комой с гипотермией и тяжелыми нарушениями метаболизма. Для гипотиреоидной комы характерны брадикардия, гипотензия, снижение температуры тела до 30° С и ниже, потеря сознания.
Белковый обмен. Считают, что с уменьшением гормонов щитовидной железы уменьшается и влияние соматотропина на рост тела. Кроме того, тормозится развитие ЦНС. Отсюда становится понятным формирование явления кретинизма у детей при гипотиреозе. Для кретинизма характерны низкий рост, нарушение дифференцировки нервной системы и, следовательно, практически невозможность формирования условных рефлексов. Поэтому такие дети не способны обучать- ся в школе. У взрослых наблюдается замедленность мышления, безразличие, вялость, сонливое состояние, снижается артериальное давление, развивается слабость, трофические нарушения (выпадение и ломкость волос, ломкость ног- тей), расстройства половой функции.
Углеводный обмен. При гипотиреозе уменьшается мобилизация гликогена и превалируют эффекты инсулина. Поэтому для гипотиреоза характерна гипогликемия.
Жировой обмен. При гипотиреозе уменьшается мобилизация жира из жировых депо и распад холестерина. Поэтому будет характерна склонность к ожирению (несмотря на уменьшение всасывания жира в кишечнике) и развитие атеросклероза из-за гиперхолестеринемии
Минеральный обмен.
При гипотиреозе увеличивается в крови количество калия, уменьшается интенсивность обменных процессов, тормозится образование альдостерона, понижается активность симпато-адреналовой системы, поэтому наблюдается брадикардия (МОК уменьшается до 3000-4000 мл/мин), гипотензия.
Основные проявления.
1. Уменьшение потребления кислорода.
2. Заторможенность, медлительность, снижение умствен- ных способностей, сонливость.
3. Холодная, сухая кожа.
4. Уменьшение аппетита, запор.
5. Повышенная чувствительность к холоду.
6. Склонность к гипотермии.
7. Брадикардия.
8. Гипотензия.
9. Увеличение массы тела, слизистый отек (микседема).
10. Анемия.
11. Гиперхолестеринемия.
12. Склонность к гипогликемии.
13. Эндемический зоб.
14. Гипотиреоидная кома
102. Патология околощитовидных желез: гипер- и гипопаратиреоз. Этиология, патогенез, основные проявления
ЭТИОЛОГИЯ ГИПЕРПАРАТИРЕОЗА.
1. Опухоли паращитовидных желез или опухоли другой локализации, но способные образовывать паратирин (см. раздел "Опухоли").
2. Хроническая почечная недостаточность, при которой развивается гипо- кальциемия, нарушается образование 1,25 (ОН)2 - Д3 и инактивация в почках паратирина. Поэтому количество паратирина в крови возрастает. Это так назы- ваемый вторичный гиперпаратиреоз.
ЭТИОЛОГИЯ ГИПОПАРАТИРЕОЗА.
1. Удаление паращитовидных желез в связи с операцией на щитовидной железе.
2. Образование аутоантител,
3. Нечувствительность рецепторов к действию паратирина и поэтому, хотя содержание в крови паратирина будет нормальным или повышенным, однако из-за нечувствительности рецепторов он неэффективен. Это явление получило название псевдогипопаратиреоза
Патогенез.
При избыточном образовании паратирина в костях активируются остеокласты, которые резорбируют кальций из кости, что ведет к остеопорозу и повышенной ломкости костей. В связи с увеличением кальция в крови и изменением соотношения кальций/фосфор, кальций начинает откладываться в стенки сосудов, сердце, печени, роговицы, поперечно-полосатой мускулатуры с развитием кальциноза. За счет отложения кальция в мышцах возникают боли, а при отложении в почки формируется хроническая почечная недостаточность. Достаточно часто в желудке обнаруживаются пептические язвы, происхождение которых связывают со стимуляцией секреции желудочного сока.
При недостаточном образовании паратирина уменьшается всасывание кальция из кишечника. Он не мобилизуется из костей и теряется с мочой. Поэтому содержание кальция в крови снижается и относительно повышается количество ионов натрия и калия.

103. Патология половых желез: гипо- и гипергонадизм у женщин. Этиология, патогенез, основные проявления.
Этиология.
Первичный или периферический гипогонадизм наблюдается при воспа- лении, аплазии яичников, анатомических дефектах, при аутоиммунных поражениях яичников.
Центральный (вторичный) гипогонадизм наблюдается часто при стрессе, недостаточном питании, тяжелых заболеваниях, а также при повреждении аденогипофиза опухолями или при удалении гипофиза
Основной причиной первичного или вторичного гипергонадизма являются опухоли яичников или гипофиза.
Основные проявления.
Гипогонадизм. У взрослых женщин гипогонадизм проявляется нарушением менструального цикла (олигоменорея, аменорея). Если же гипогонадизм развивается у девочки до полового созревания, то формируются явления евнухоидизма, для которого характерны удлиненное туловище и конечностей, остеопороз, отсутствие менструаций.
Гипергонадизм. при опухолях яичников в зависимости от того, увеличиваются в крови андрогены или эстрогены, клинические проявления различны, При избытке андрогенов характерна вирилизация, а при избытке эстрогенов до полового созревания наблюдается преждевременное половое развитие. Появляются вторичные половые признаки (рост молочных желез, оволосение лобка и подмышек). После полового созревания это проявляется в виде нарушений менструаций. Если гипергонадизм у девочки до полового созревания носит вторичный характер (избыток образования гонадотропинов), то развивается так называемое истинное преждевременное половое созревание. У взрослых женщин дисфункции (галакторея-аменорея) может сопровождаться избытком образования пролактина, при котором, как правило, понижается секреция гонадотропинов. Поэтому у женщин возникает явление ложной беременности (увеличение живота, груди, аменорея).
104. Патология половых желез: гипо- и гипергонадизм у мужчин. Этиология, патогенез, основные проявления.
Этиология.
1. Гипогонадизм.
· Первичный гипогонадизм или периферический связан с первичными нарушениями семенников. Наблюдается при кастрации, рентгеновском облучении, фиброзе яичек после вирусных процессов.
· При недостаточности печени, формируется вторичный гипогонадизм, или центральный
2. Гипергонадизм. Основными причинами являются опухоли или воспаление гипоталамуса, гипофиза, семенников.
Основные проявления.
Гипогонадизм.
1. До полового созревания. Не развиваются вторичные половые признаки, евнухоидные пропорции тела. Отсутствие полового влечения, изменения психики, уменьшение массы мускулатуры, остеопороз. Крайний вариант - мужской псевдогермафродитизм
2. После. Уменьшение полового влечения, потенции, инволюция наружных половых органов, изменение психики, остепороз, уменьшение массы мускулатуры.
Гипергонадизм.
1. До полового созревания. Раннее половое созревание -увеличение полового члена и мо- шонки, сперматогенез, половое влечение (при центрального гипергонадизме), хорошо развитая мускулатура оволосинение по мужскому типу, прекращение роста
2. После. Кроме увеличения массы мускулатуры, другие признаки отсутствуют.
105. Этиология и патогенез сахарного диабета.
ЭТИОЛОГИЯ
Диабет 1 типа развивается при панкреатитах вирусного или интоксикационного происхождения, гипоксии, длительном и избыточном приеме углеводов и жиров. Большое значение в развитии диабета 1 типа принадлежит аутоиммунным повреждениям бета-клеток островков Лангерганса.
Важнейшей особенностью диабета 2 типа являются: Первичная гиперинсулинемия (она наиболее часто наблюдается при ожирении больных). Нарушение рецепторного аппарата клеток-мишеней наблюдается также при лечении больных инсулином, особенно пролонгированного действия, а также в обычных случаях, когда больной, как правило, вводит дозу инсулина значительно большую, чем содержится в крови в физиологических условиях. В самой поджелудочной железе в 70 % случаев наблюдается амилоидная дегенерация. Во многом это связано или с блокадой антителами инсулиновых рецепторов, уменьшением их образования на мембранах клеток или качественными изменениями их структуры.
Патогенез.
106. Нарушения обмена веществ при сахарном диабете. Патогенез диабетической комы.
Диабетическая кома характеризуется нарушением сознания и возникает в результате сложных нарушений всех видов обмена веществ с накоплением в крови глюкозы до 25-55 ммоль/л, ацетоновых тел до 10 ммоль/л, остаточного азота до 40 ммоль/л, некомпенсированного ацидоза.
Патогенез. Дефицит инсулина ведёт к повышению концентрации глюкозы в крови и «голоду» периферических инсулинозависимых тканей, не способных утилизировать глюкозу без участия инсулина. В ответ на «голод» организма в печени начинается синтез глюкозы (глюконеогенез) и кетоновых тел из ацетил-КоА — развивается кетоз, а при недостаточной утилизации кетоновых тел и усугубления ацидоза — кетоацидоз. Накопление недоокисленных продуктов метаболизма, в частности лактата ведёт к развитию лактатацидоза. В некоторых случаях грубые нарушения метаболизма на фоне декомпенсации сахарного диабета приводят к развитию гиперосмолярной комы.
107. Возможные проявления при сахарном диабете, связанные с нарушениями углеводного обмена.
При дефиците инсулина снижается утилизация глюкозы периферическими тканями, в основном мышечной и жировой. Это в какой-то мере обусловливает развитие гипергликемии, которая дополнительно возрастает в результате гликогенолиза в печени и мышцах. (В повышении концентрации глюкозы в крови играет роль и глюконеогенез), Когда концентрация глюкозы превысит почечный порог, начинается глюкозурия и возникает осмотический диурез. Это лежит в основе полидепсии и полиурии. Потеря воды и электролитов с мочой, не компенсируемая их поступлением в организм, приводит к дегидратации и гемоконцентрации. Это в свою очередь вызывает недостаточность периферического кровообращения из-за резкого падения объема циркулирующей крови, или шока.
108. Возможные проявления при сахарном диабете, связанные с нарушениями белкового обмена.
Лишение организма инсулина и нарушение утилизации глюкозы приводит к снижению синтеза белка и поэтому к преобладанию его распада, прежде всего в инсулиночувствительных тканях, особенно мышцах. Этот процесс сопровождается потерей организмом азота, а также выходом калия и других внутриклеточных ионов в кровь с последующей экскрецией ионов калия с мочой.
Клинические симптомы нарушения белкового обмена при СД: гиперазотемия, гиперазотурия и (как следствие) метаболический ацидоз.
109. Возможные проявления при сахарном диабете, связанные с нарушениями липидного обмена.
Относительная недостаточность инсулина и снижение утилизации глюкозы жировой тканью организма приводит к значительному «опустошению» жировых депо. В результате может возникнуть вторичная гипертриглицеридемия, так как в печени из свободных жирных кислот синтезируются ЛПОНП.
В печени увеличивается содержание жиров, большую часть которых она способна окислять только до стадии ацетил-КоА. Затем двухуглеродные фрагменты образуют ацетоуксусную и бета-оксимасляную кислоты, концентрация которых в венозной крови, оттекающей от печени, возрастает. Развивающаяся кетонемия имеет два основных следствия: 1) она усугубляет метаболический ацидоз, приводя тем самым к характерному глубокому и быстрому дыханию, которое служит одним из диагностических признаков диабетического ацидоза; 2) когда кетонемия превысит почечный порог реабсорбции кетоновых тел, последние появляются в моче. Их экскреция почками уменьшает содержание в организме связанных оснований, что дополнительно ведет к потере натрия.
110. Механизм формирования атеросклероза при сахарном диабете.
АТЕРОСКЛЕРОЗ Представляет собой системное заболевание, в основе которого лежит дегенеративное изменение интимы сосудов, отличительной особенностью которого является образование в интиме артерий мышечно-эластического типа (аорта, крупные и средние артерии) атероматозных бляшек, вследствие нарушения липидного и белкового обмена, с последующим их изъязвлением, кальцинозом и склонностью к тромбообразованию.
При сахарном диабете имеет место нарушение липопротеинового обмена с увеличением в крови липопротеинов низкой и очень низкой плотности.
Стойкая гипергликемия при сахарном диабете способствует неферментативному гликозилированию апопротеинов и собственных белков интимы, что нарушает их функции и ускоряет атерогенез.
В результате повреждения нарушается обмен липопротеидов в эндотелии, что ведет к снижению их способности образовывать простациклины и активаторы плазмина. Поэтому на эндотелии агрегируют тромбоциты, которые образуют хемотаксические и пролиферативные факторы. Это способствует накоплению макрофагов и гладкомышечных клеток интимы с большим количеством липидов. Позже часть кристаллов холестерина, вследствие гибели эндотелиальных гладкомышечных клеток, накапливается на базальной мембране и морфологически это соответствует образованию атеро-матозных бляшек интимы, выступающих в просвет сосуда.
111. Механизмы формирования ангиопатий при сахарном диабете.
Достаточно сложный генез имеют диабетические микроангиопатии, что ведет к нарушению зрения (диабетическая ретинопатия), почек (диабетическая нефропатия), нервов (диабетическая невропатия), сосудов конечностей (облитерирующий эндоартериит). Полагают, что нарушения сосудистой стенки свя- заны с расстройствами всех видов обмена, особенно большое значение придают гликосиляции протеинов, т.е. соединению углеводов с молекулами разных бел- ков. Этот процесс резко возрастает при гипергликемии. При отложении их в стенке сосудов ее структура нарушается
112. Осложнения при сахарном диабете.
I Острые осложнения представляют собой состояния, которые развиваются в течение дней или даже часов, при наличии сахарного диабета.
Диабетический кетоацидоз — тяжёлое состояние, развивающееся вследствие накопления в крови продуктов промежуточного метаболизма жиров (кетоновые тела). Возникает при сопутствующих заболеваниях, прежде всего — инфекциях, травмах, операциях, при недостаточном питании.
Гипогликемия — снижение уровня глюкозы в крови ниже нормального значения (обычно ниже 3,3 ммоль/л), происходит из-за передозировки сахароснижающих препаратов, сопутствующих заболеваний, непривычной физической нагрузки или недостаточного питания, приёма крепкого алкоголя.
Гиперосмолярная кома. Встречается, главным образом, у пожилых больных с диабетом 2-го типа в анамнезе или без него и всегда связана с сильным обезвоживанием. Часто наблюдаются полиурия и полидипсия продолжительностью от дней до недель перед развитием синдрома. Пожилые люди предрасположены к гиперосмолярной коме, так как у них чаще наблюдается нарушение восприятия чувства жажды.
Лактацидотическая кома у больных сахарным диабетом обусловлена накоплением в крови молочной кислоты и чаще возникает у больных старше 50 лет на фоне сердечно-сосудистой, печеночной и почечной недостаточности, пониженного снабжения тканей кислородом и, как следствие этого, накопления в тканях молочной кислоты.
II Поздние. Представляют собой группу осложнений, на развитие которых требуются месяцы, а в большинстве случаев годы течения заболевания.
Диабетическая ретинопатия — поражение сетчатки глаза в виде микроаневризм, точечных и пятнистых кровоизлияний, твёрдых экссудатов, отёка, образования новых сосудов. Заканчивается кровоизлияниями на глазном дне, может привести к отслоению сетчатки.
Диабетическая микро- и макроангиопатия — нарушение проницаемости сосудов, повышение их ломкости, склонность к тромбозам и развитию атеросклероза.
Диабетическая нефропатия — поражение почек, сначала в виде микроальбуминурии (выделения белка альбумина с мочой), затем протеинурии. Приводит к развитию хронической почечной недостаточности.
Диабетическая стопа — поражение стоп больного сахарным диабетом в виде гнойно-некротических процессов, язв и костно-суставных поражений, возникающее на фоне изменения периферических нервов, сосудов, кожи и мягких тканей, костей и суставов. Является основной причиной ампутаций у больных сахарным диабетом.
113. Общие принципы лечения сахарного диабета.
В настоящее время лечение сахарного диабета в подавляющем большинстве случаев является симптоматическим и направлено на устранение имеющихся симптомов без устранения причины заболевания, так как эффективного лечения диабета ещё не разработано. Основными задачами врача при лечении сахарного диабета являются:
· Компенсация углеводного обмена.
· Профилактика и лечение осложнений.
· Нормализация массы тела.
· Обучение пациента.
Компенсация углеводного обмена достигается двумя путями: путём обеспечения клеток инсулином, различными способами в зависимости от типа диабета, и путём обеспечения равномерного одинакового поступления углеводов, что достигается соблюдением диеты.
Очень важную роль в компенсации сахарного диабета играет обучение пациента. Больной должен представлять, что такое сахарный диабет, чем он опасен, что ему следует предпринять в случае эпизодов гипо- и гипергликемии, как их избегать, уметь самостоятельно контролировать уровень глюкозы в крови и иметь чёткое представление о характере допустимого для него питания
114. Общая этиология и общий патогенез расстройств функций нервной системы
- ЦНС обладает высокой чувствительностью к гипоксии, т.к. потребляет 20 % всего кислорода, поступающего в организм.
- Головной мозг очень чувствителен к изменению рН крови, ее химического состава из-за нарушения обмена веществ или интоксикаций.
- Нарушения нервной деятельности могут быть обусловлены голоданием разного вида, особенно в этом отношении следует выделить гипо- и авитаминозы.
- Регуляция обмена веществ в нервной системе имеет высокую степень зависимости от функционирования эндокринных желез, поэтому их патология (особенно гипофиза и щитовидной железы) может привести к очень глубоким нарушениям в нервной системе.
- Патология нервной системы может быть врожденной или наследственной, обусловленной недоразвитием отдельных структур или нарушением метаболизма в них. Иногда нарушения в нервной системе являются вторичными, если они возникли в результате наследственного нарушения обмена веществ.
- Нарушения деятельности нервной системы могут быть результатом развития типических патологических процессов. Наиболее часто такой причиной служат воспаления и опухоли.
- Установлена значимая роль возрастных нарушений функции нервной системы, хотя механизм их развития изучен недостаточно.
- Факторами нарушения функций нервной системы являются рефлекторные влияния в результате сильных или необычных воздействий на наружные или внутренние рецепторы (стресс, шок).
Все нарушения деятельности нервной системы условно делят на органические и функциональные.
Органические нарушения характеризуются наличием выраженных дефектов структуры нервной системы, что сопровождается выпадением функции ее отдельных элементов.
Функциональные нарушения значительно более распространены; в их патогенезе общим звеном является возникновение генератора патологически усиленного возбуждения. Если в норме активность нейронов или нервных центров ограничивается соответствующими явлениями торможения, то при патологии контроля этих процессов возникает генератор патологически усиленного возбуждения, который в зависимости от локализации может служить причиной чувствительных, двигательных, вегетативных расстройств или нарушений высшей нервной деятельности.
115. Сенсорные нарушения. Различные уровни расстройств чувствительности. Их виды и механизмы развития.
В целом нарушение чувствительности проявляется в виде следующих феноменов:
1. Боль - сигнал повреждения органов и тканей с вовлечением болевых рецепторов, проводников и центров мозга.
2. Гипестезия - уменьшение чувствительности.
3. Анестезия - полная утрата какой-либо чувствительности.
4. Выпадение функций дистантных рецепторов слуха, зрения, обоняния, как и отсутствие звуковых воздействий ведет к развитию сна.
5. Гиперестезия - повышение различных видов чувствительности вследствие понижения порога возбудимости.
6. Парестезия - ощущение покалывания, онемения, ползания мурашек, холода, электролитных разрядов.
7. Дизестезия - извращенная чувствительность. Когда тактильное раздражение воспринимается как болевое, тепловое как холодовое и т.д.
8. Гиперпатия - любое раздражение сопровождается неприятным чувством с длительным последействием, с нарушением локализации и дифференциации ощущения.
Нарушение чувствительности может быть связано с нарушением чув- ствительного анализатора на различных его уровнях (рецептора, чувствитель- ного нерва, спинного мозга, ретикулярной формации, таламуса, коры мозга)
Нарушение чувствительности при поражении чувствительных нервов и задних корешков спинного мозга связано с развитием гипоксии, охлаждением, воспалением, интоксикацией, авитаминозом В, травмой, сдавлением опухолью, рубцом и проявляется в виде замедления или полного прекращения проведения импульсов. Прекращение поступления импульсов с чувствительных нервов в выше- лежащие отделы спинного и головного мозга называется деафферентацией.
НАРУШЕНИЕ ЧУВСТВИТЕЛЬНОСТИ ПРИ ПОРАЖЕНИИ НА УРОВНЕ СПИННОГО МОЗГА проявляется в виде синдрома Броун-Секара, который характеризуется выпадением движений (паралич) и мышечно-суставного чувства (глубокая чувствительность) на стороне поражения и болевой, температурной чувствительности на противоположной стороне, При полном прекращении проводимости спинного мозга (разрывы, трав- мы, опухоли) формируется двусторонняя анестезия для всех видов чувствительности ниже места поражения и нарушение движений
Важной особенностью нарушений чувствительности при поражении ствола является сочетание симптомов поражений отдельных черепно-мозговых нервов с нарушением чувствительности на противоположной стороне. Нарушение чувствительности типа выпадения или раздражения во многом обусловлено нарушением ретикулярной формации. при поражении ретикулярной формации ствола мозга возможны нарушения сна и бодрствования, регуляции дыхания и кровообращения. Наиболее тяжелым является синдром бульварного паралича.
116. Патофизиология гипоталамуса. Понятие о диэнцефальных синдромах.
Гипоталамические синдромы (синоним диэнцефальные синдромы) — симптомокомплексы, возникающие при поражении гипоталамической области и характеризующиеся вегетативными, эндокринными, обменными и трофическими расстройствами. Клиническая картина различных Г. с. зависит как от преимущественной локализации поражения в пределах гипоталамуса (задний или передний его отделы), так и от особенностей нейрогуморальных нарушений в гипоталамо-гипофизарной системе . Гипоталамус является той областью головного мозга, где происходит интеграция нервных и гуморальных функций, что обеспечивает постоянство внутренней среды — гомеостаз . Он регулирует периодичность физиологических процессов, поэтому при патологии гипоталамуса нарушается периодичность той или иной функции, что проявляется пароксизмом (кризом) вегетативного характера. Г. с. развиваются при опухолях головного мозга, таких заболеваниях, как грипп, малярия, ревматизм, хронический тонзиллит, реже при вирусных нейроинфекциях, закрытой черепно-мозговой травме, сосудистых заболеваниях, хронических интоксикациях. Определенное значение имеют психогенные факторы. В развитии патологических изменений играет роль повышенная проницаемость сосудов гипоталамической области, что способствует проникновению в эту зону мозга токсинов и вирусов, а также значительная травматизация этой области за счет перемещения цереброспинальной жидкости при черепно-мозговой травме, гидроцефалии, опухолях.
Среди больных с Г. с. преобладают женщины, чаще в возрасте 31—40 лет. У значительной части больных Г. с. протекают приступообразно (пароксизмально), в виде кризов. Гипоталамический криз в типичных случаях характеризуется смешанной симптоматикой: диффузной головной болью, реже несистемным головокружением, болями в области сердца, сердцебиением, затруднением дыхания, ознобоподобным тремором, чувством беспокойства, страха, иногда жаждой, чувством голода, болями в эпигастральной области, затем наступают позывы на мочеиспускание с обильным выделением светлой мочи, и приступ заканчивается резкой общей слабостью. Существуют преимущественно симпатико-адреналовые и вагоинсулярные кризы. При симпатико-адреналовых кризах вследствие сужения сосудов наступает побледнение кожи, повышается системное АД, появляются тахикардия, ознобоподобный тремор, страх, снижается температура тела (гипотермия). Характерно увеличение содержания в моче 17-оксикортикостероидов. Вагоинсулярные кризы проявляются понижением АД, брадикардией, болями в области сердца, спазмами кишечника, обильным потоотделением, гипертермией и частым мочеиспусканием, содержание 17-оксикортикостероидов в моче уменьшено.
В зависимости от преобладания тех или иных симптомов выделяют следующие Г. с.: синдром с гипоталамической (диэнцефальной) эпилепсией, синдром с вегетативно-висцерально-сосудистыми расстройствами, гипоталамический синдром с нарушением терморегуляции, синдромы с нервно-мышечными расстройствами, нейротрофическими нарушениями, нейроэндокринными нарушениями и гипоталамический синдром с нервно-психическими расстройствами.
117. Нарушение функций вегетативной нервной системы. Виды, механизмы. Понятие о вегетативных кризах.
Вегетативные нарушения бывают результатом поражения вегетативной нервной системы на различных уровнях, различными патологическими процессами.
выделяют такие виды расстройств:
• катехоламиновые расстройства (Большинство катехоламиновых расстройств относят к группе гормонально-активных опухолей и генетических нарушений синтеза катехоламинов);
• центральные вегетативные расстройства:
- мультисистемная атрофия - синдром Шая-Дрейджера;
- изолированная (чистая) вегетативная недостаточность;
- болезнь Паркинсона;
• расстройства ортостатической толерантности:
• периферические вегетативные расстройства (вегетативные невропатии) (группа заболеваний, при которых селективно страдают вегетативные нервные волокна или вегетативные ганглии. Сахарный диабет - самая частая причина вегетативной невропатии)
Вегетативный криз представляет собой необъяснимый, мучительный для больного, приступ тяжёлой тревоги, сопровождаемый страхом, в сочетании с различными вегетативными (соматическими) симптомами. Русскоязычные врачи используют термины «вегетативный криз», «симпатоадреналовый криз», «кардионевроз», «ВСД (вегетососудистая дистония) с кризовым течением», «НЦД — нейроциркуляторная дистония», отражающие представления о нарушениях вегетативной нервной системы в зависимости от ведущего симптома. Термины «паническая атака» и «паническое расстройство» имеют мировое признание и введены в Международную классификацию болезней 10-го пересмотра. В то же время наличие панических атак не обязательно означает, что у больного — паническое расстройство. Панические атаки могут быть симптомами феохромоцитомы, соматоформных дисфункций, фобий, депрессивных расстройств, эндокринологических заболеваний, сердечных заболеваний, митохондриальных заболеваний и т. д. Или же возникать в результате приёма каких-либо препаратов
118. Нарушение двигательной функции нервной системы.
Расстройства двигательной функции нервной системы возникают в результате нарушения деятельности различных звеньев пирамидной и экстрапирамидной систем, мотонейронов спинного мозга, тормозных нейронов (клеток Реншоу), эфферентных двигательных волокон, концевой пластинки и др.
Проявления двигательных расстройств, связанных с различными структурами и уровнями нервной системы, многообразны:
· миастения (расстройства пресинаптической мембраны);
· вялый (периферический) паралич (повреждения последнего эфферентного нейрона);
· центральный паралич (повреждения двигательных эфферентных нейронов головного мозга);
· рефлекторный паралич (обусловлен тормозящим влиянием афферентного нейрона при сохраненной иннервации двигательных эфферентных путей);
· децеребрационная ригидность (возникает после перерезки ствола мозга ниже среднего мозга);
· астения (быстрая утомляемость при незначительной мышечной работе);
· астезия (неспособность удерживать положение тела без поддержки);
· атаксия (нарушение координации движений);
· атетоз (медленные червеобразные движения пальцев;
· гипокинез (понижение двигательной активности);
· понижение тонуса мышц;
· повышение тонуса мышц;
· нарушение тонких дифференцированных движений;
· болезнь Паркинсона (повышение мышечного тонуса — ригидность, гипокинезия, дрожание — тремор — конечностей, головы, туловища, замедлено как начало, так и окончание движения, амимическое выражение лица и др.).
119. Пирамидные и экстрапирамидные расстройства.
Нарушение движения при поражении пирамидной системы проявляются в виде парезов или параличей. Парез означает уменьшение объема и силы сокращения, а паралич - невозможность произвольного движения. В зависимости от уровня поражения пирамидной системы выделяют центральный (спастический) и периферический (вялый, атрофический) параличи. Центральный паралич развивается при поражении первого нейрона, а периферический - второго нейрона пирамидной системы.
Поражение различных образований экстрапирамидной системы сопровождается изменением мышечного тонуса (повышение или понижение), и двигательной активности (гипер- или гипокинезия), и слабостью в конечностях (экстрапирамидный парез). Гиперкинезы связаны также с поражением мозжечка, коры мозга, таламуса и спинного мозга. При поражении экстрапирамидной системы формируется два основных синдрома: гипертонически-гипокинетический и гипотонически-гиперкинетический. Гипертонически-гипокинетический (синдром Паркинсонизма) возникает при поражении бледного шара и черной субстанции при атеросклерозе, энцефалите, опухоли, интоксикации марганцем, свинцом, ртутью. Основными клиническими проявлениями являются уменьшение двигательной активности, общая скованность, замедленная походка, амимия, монотонная негромкая речь. Одновременно с этим наблюдается тремор кистей рук, стоп, головы, нижней челюсти
Гипотонически-гиперкинетический синдром формируется при поражении хвостатого ядра в результате ревматических изменений, расстройств кровообращения, опухолей или наследственных заболеваний. При этом снижение тонуса и гиперкинезы (непроизвольные движения) конечностей и туловища обусловлены увеличением в пораженных участках медиатора возбуждения - дофамина.
120. Патофизиология экстрапирамидных расстройств
Поражение различных образований экстрапирамидной системы сопровождается изменением мышечного тонуса (повышение или понижение), и двигательной активности (гипер- или гипокинезия), и слабостью в конечностях (экстрапирамидный парез). Гиперкинезы связаны также с поражением мозжечка, коры мозга, таламуса и спинного мозга. При поражении экстрапирамидной системы формируется два основных синдрома: гипертонически-гипокинетический и гипотонически-гиперкинетический. Гипертонически-гипокинетический (синдром Паркинсонизма) возникает при поражении бледного шара и черной субстанции при атеросклерозе, энцефалите, опухоли, интоксикации марганцем, свинцом, ртутью. Основными клиническими проявлениями являются уменьшение двигательной активности, общая скованность, замедленная походка, амимия, монотонная негромкая речь. Одновременно с этим наблюдается тремор кистей рук, стоп, головы, нижней челюсти
Гипотонически-гиперкинетический синдром формируется при поражении хвостатого ядра в результате ревматических изменений, расстройств кровообращения, опухолей или наследственных заболеваний. При этом снижение тонуса и гиперкинезы (непроизвольные движения) конечностей и туловища обусловлены увеличением в пораженных участках медиатора возбуждения - дофамина.
121. Нарушение трофической функции нервной системы. Нейродистрофии. Механизмы их развития.
Трофические влияния нервной системы осуществляются путем регуляции метаболизма в органах и тканях рефлекторно с участием медиаторов, гормонов, трофогенов, лей- и метэнкефалинов, субстанции Р, микроциркуляторного, лим-фатического и кровеносного русла, обеспечивающих доставку нутритивных веществ и удаление продуктов обмена. Развитие дистрофического процесса имеет стандартный характер, что связано с тем, что внутриклеточные процессы, протекающие в виде цепных реакций, имеют определенную последовательность, и их нарушение при расстройстве нервной системы, хотя и вызывается различными причинами, но патогенез этих расстройств, как правило, общий. Поэтому нервная дистрофия рассматривается как типовой патологический процесс.
Эфферентные пути трофического рефлекса разделяются на нервно- проводниковые и гуморальные. Как уже говорилось, нервно-трофические влияния осуществляются чувствительными, двигательными, симпатическими и парасимпатическими нервами. Но их влияние на трофику опосредуется с помощью нейротрансмиттеров, таких как норадреналин, ацетилхолин, ГАМК, глицин, дофамин, аминокислоты, нейропептиды, а также гормонами. Поступая в межклеточную жидкость, а затем и в кровь, они опосредуют гуморальные трофические нервнопроводниковые влияния. Поэтому как их избыточное образование (в случае хронически повышенной функциональной активности чувствительных моторных, симпатических и парасимпатических нейронов), так и снижение их образования при повреждении вышеуказанных нервов и различных структур ЦНС трофическая функция нервной системы нарушается. Периферический участок чувствительного нерва является источником антидромных импульсов (т.е. распространяющихся в противоположном обычному направлению), вызывающих в органе трофические расстройства. Важное значение в возникновении нервных дистрофий принадлежит нарушению межклеточных контактов и взаимодействия, а также образованию цАМФ в иннервируемых структурах. Известно, что перенос веществ из клетки в клетку осуществляется через контактирующие участки мембран соседних клеток обеспечивающих узнавание, сортировку и использование веществ межклеточной жидкости. Нарушение межклеточных контактов возникает как следствие расстройств трофической функции нервной системы, гормонального, медиаторного обмена
122. Спинальный шок. Этиология, нарушения в организме.
При полном перерыве (перерезке) спинного мозга формируется особый процесс - спинальный шок, в основе которого лежит глубокое, но обратимое нарушение двигательных и вегетативных рефлексов и необратимое расстройство всех видов чувствительности ниже участка травмы мозга. Постепенное восстановление у человека двигательных и вегетативных рефлексов начинается со сгибательных рефлексов. Вслед за восстановлением рефлексов, наблюдается гиперрефлексия, что связывают с невозможностью тормозного влияния ретикулярной формации на спинной мозг. Поэтому из-за увеличенной иррадации в спинном мозге воспроизведение нормальных спинальных рефлексов невозможно. Основу патогенеза спинального шока составляет превалирование процессов торможения в спинном мозге из-за выпадения возбуждающего влияния со стороны головного мозга. Важным механизмом спинального шока является перераздражение чувствительных зон травмирующим агентом и развивающееся вследствие этого разобщение выше и нижележащих отделов нервной системы
123. Синдром Броун-Секара. Этиология, основные проявления.
Синдром Броун-Секара - синдром половинного поперечного поражения спинного мозга, проявляющийся параличом , утратой суставно-мышечной чувствительности и утратой вибрационной чувствительности на противоположной стороне. Иногда гемипарез сочетается с ипсилатеральной потерей проприоцептивной чувствительности и контралатеральным выпадением болевой чувствительности и контралатеральным выпадением температурной чувствительности .
Синдром Броун-Секара возникает при повреждении половины поперечника спинного мозга и характеризуется парезом (повреждение кортикоспинального пути ) и утратой проприоцептивной чувствительности (повреждение задних канатиков ) на стороне поражения, а утратой болевой и температурной чувствительности ( спиноталамический путь ) - на противоположной стороне (на 1-2 сегмента ниже уровня поражения). Все нарушения развиваются ниже уровня поражения. Сегментарные расстройства ( корешковая боль , атрофия мышц или утрата сухожильных рефлексов ) выявляются не всегда и бывают односторонними.
Классический синдром Броун-Секара встречается редко. Чаще наблюдается частичный синдром или полное поперечное повреждение спинного мозга. При повреждении одного из задних квадрантов спинного мозга утрачивается вибрационная и проприоцептивная чувствительность на стороне поражения, одного из передних квадрантов - возникает ипсилатеральный парез и контралатеральное нарушение болевой и температурной чувствительности .
124. Основные проявления ваго-инсулярного криза.
Вагоинсулярный криз является одним из разновидностей кризов при сбое работы вегетативной нервной системы человеческого организма. Чаще всего его возникновение связано с внезапным выбросом в кровь большой дозы инсулина. Такая реакция ведет к снижению уровня глюкозы и соответственно молниеносным ухудшением самочувствия.
Вагоинсулярные кризы характеризуются удушьем, замедленным, глубоким дыханием (до 8-10 в мин.), "приливом жара к лицу", головной болью, бради- кардией, ощущением остановки сердца, резкой потливостью, неприятными ощущениями в эпигастральной области, усилением перистальтики, метеориз- мом, профузными поносами.
125. Основные проявления симпато-адреналового криза.
Симпатоадреналовый криз – это крайняя степень проявления нейроциркуляторной дистонии по гипертензивному типу. Во время развития криза отмечается значительное повышение артериального давления, порой до 200 мм рт.ст . За рубежом это состояние еще называется «паническая атака».
Симпато-адреналовые кризы начинаются с озноба, тахикардии, онемения и похолодания конечности, резкой бледности лица. У больного отмечается стой- кое и значительное повышение АД, спонтанная пилоэрекция (гусиная кожа), потливость, повышение температуры. Почти во всех случаях наблюдается страх, возбуждение, двигательное беспокойство
126. Основные теории нервных дистрофий и их обоснование.
1. недостаточность медиаторов
2. истощение медиаторов
3. специфич. Вещества белковой природы (перфарены?) вызывают нарушен. Метаболизма в самой клетке
127. Морфологические проявления нервных дистрофий на уровне клетки и органа.
Морфологические проявления характеризуются потерей четкости границ клеток, их набуханием, гомогенизацией, диффузной гибелью паренхиматозных клеток и разрастанием соединительной ткани, вакуолизацией цитоплазмы, уменьшением количества митохондрий, уменьшением их крист, разрушением эндоплазм этического ретикулума и лизисом, деформацией ядер. Наблюдаются глубокие расстройства кровообращения в виде повышения проницаемости сосудов, дегенеративных изменений их стенок, гемостаза, отека паренхимы органов, инфильтрации ее нейтрофильными лейкоцитами
128. Нарушения высшей нервной деятельности. Понятие о неврозах. Биологические и социальные аспекты этиологии и патогенеза неврозов.
Причинами нарушений высшей нервной деятельности могут послужить:
- функциональные воздействия на мозг; нарушения эмоций:
- травматические и хирургические повреждения мозга;
- влияния различных токсинов и ядов;
- функциональные и травматические воздействия на другие системы, ведущие к нарушению функций мозга.
Невроз - это функциональное нарушение деятельности центральной нерв- ной системы, проявляющееся нервно-психическими и сомато-вегетативными расстройствами. К неврозам относятся заболевания, при которых нервнопсихические расстройства не сопровождаются выраженными патоморфологическими изменениями в коре и подкорковых образованиях мозга
ЭТИОЛОГИЯ НЕВРОЗОВ Ведущим этиологическим фактором является острая или хроническая психическая травма
ПАТОГЕНЕЗ НЕВРОЗОВ неврозы чаще всего развиваются у лиц с неуравновешенным и слабым типом нервной системы (холерики и меланхолики). Существенное значение имеет преобладание первой или второй сигнальной системы. улиц с преобладанием первой сигнальной систем - склонность к истерии, у лиц с преобладанием второй сигнальной системы - склонность к развитию навязчивых состояний, а лиц с уравновешенностью первой и второй сигнальных систем склонны к неврастении. В основе невроза лежит перенапряжение силы, подвижности и уравновешенности нервных процессов. Очень часто на правый план выступает перенапряжение тормозного процесса, связанное с необходимостью длительное время не проявлять двигательный компонент поведенческой реакции, чувства, желания, мысли. В результате подавления двигательного компонента поведенческой реакции и сохранности вегетативных реакций в коре мозга создаются очаги застойного возбуждения, в результате чего нарушаются корково-подкорковые взаимоотношения с психо-эмоциональными и вегетативными проявл
Дата добавления: 2018-11-24; просмотров: 1377; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
