Примеры решения типовых задач
Пример 1. Константа равновесия реакции H2(Г)+I2(Г) =2 HI(Г) при 693 К КС=50,25. Вычислите массу образующегося иодида водорода, если в сосуд вместимостью 1 л введено 846 г йода и 21,2 г водорода.
Дано:
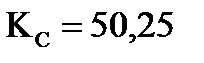 V = 1л
m(I2) = 846 г
m(H2) = 21,2 г
V = 1л
m(I2) = 846 г
m(H2) = 21,2 г
| Решение.
Уравнение процесса: H2(Г)+I2(Г) =2 HI(Г).
Определим количество молей исходных веществ по формуле (ν = m/M): ν0(H2) = 21,2/2 = 0,0106 моль, ν0(I2) = 846/254 = 0,0033 моль.
Число молей иодида водорода в исходном состоянии равно нулю (ν0(HI)=0). Изменение числа молей к моменту равновесия йода и водорода (Δν(H2)= Δν(I2)= х) будет одинаковым (исходя из уравнения процесса), а равновесное число молей HI будет определяться удвоенным изменением числа молей H2 или I2: νравн.(HI)=2∙Δν=2х. Равновесное число молей остальных веществ в системе составит:
νравн.(H2)= ν0(H2) –х =(10,6∙10-3 – х ) моль,
νравн.(I2)= ν0(I2) –х =(3,33∙10-3 – х) моль.
Находим: 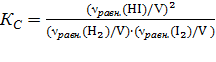 , ,
 Решение этого уравнения дает:
Решение этого уравнения дает: 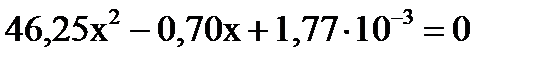 .
Откуда: .
Откуда: 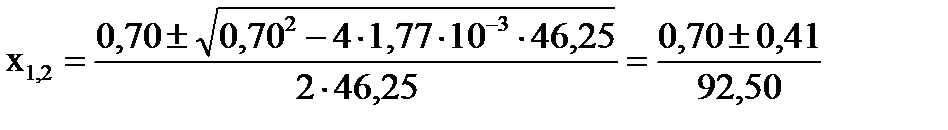 , ,
 , , 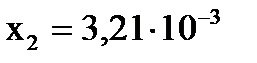 .
Первый корень уравнения не имеет физического смысла, так как величина х1 не может быть больше ν0(H2), т.е. .
Первый корень уравнения не имеет физического смысла, так как величина х1 не может быть больше ν0(H2), т.е. 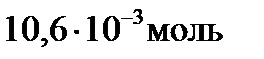 . Следовательно, равновесное количество полученного йодистого водорода будет составлять: . Следовательно, равновесное количество полученного йодистого водорода будет составлять:
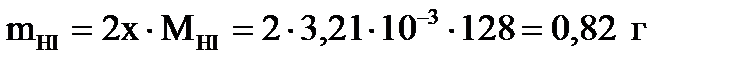 . .
|
| Найти: m(HI)? | Ответ: m(HI) = 0,82 г. |
Пример 2. В закрытый сосуд вместимостью 0,05  введено 10 моль вещества А и 1 моль вещества В. В результате реакции 2A+B=D установилось равновесие с общим давлением в системе 485 кПа. Вычислите равновесные количества всех веществ в системе при 298 К. Чему равно значение
введено 10 моль вещества А и 1 моль вещества В. В результате реакции 2A+B=D установилось равновесие с общим давлением в системе 485 кПа. Вычислите равновесные количества всех веществ в системе при 298 К. Чему равно значение  при этой температуре? Система подчиняется законам идеального газа.
при этой температуре? Система подчиняется законам идеального газа.
|
|
|
| Дано: V= 0,05 м3 ν0(А)=10 моль ν0(В)=1 моль ν0(D)=0 моль Робщ = 485 кПа Т=298 К | Решение.
Уравнение процесса: 2A(Г)+B(Г)=D(Г). Если обозначить количество превращенных молей вещества В через х то: Δν(В)=х, Δν(А)=2х, Δν(D)=х (согласно уравнению реакции). Равновесное число молей веществ в системе можно рассчитать: νравн.=ν0 –Δν; νравн.(А)=10–2х моль, νравн.(В)=1–х моль, νравн.(D)=х моль.
Сумма молей в равновесной системе составит:
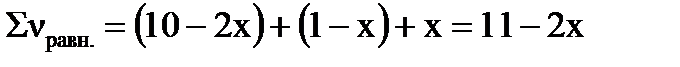 .
По уравнению Менделеева-Клапейрона .
По уравнению Менделеева-Клапейрона 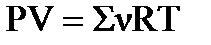 находим значение х: находим значение х: 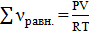 , , 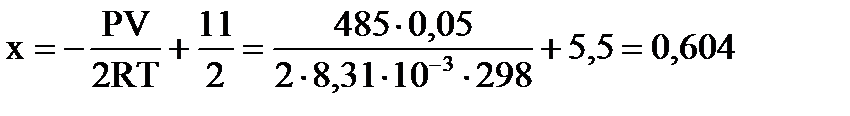 моль.
Равновесные количества веществ в системе составят:
νравн.(А) =10–2∙0,604=8,792 моль, νравн.(В)=1–0,604=0,396 моль, νравн.(D)=0,604 моль.
Константы равновесия рассчитываем по уравнениям: моль.
Равновесные количества веществ в системе составят:
νравн.(А) =10–2∙0,604=8,792 моль, νравн.(В)=1–0,604=0,396 моль, νравн.(D)=0,604 моль.
Константы равновесия рассчитываем по уравнениям:
 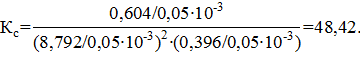 Изменение числа молей газов в результате процесса
Изменение числа молей газов в результате процесса 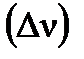 по уравнению составляет Δν = 1–2–1 = –2 моль, по уравнению составляет Δν = 1–2–1 = –2 моль, 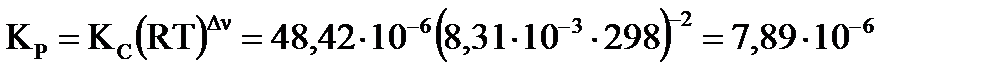 . .
|
| Найти: νравн.(А), νравн.(В), νравн.(D), Кр, Кс ? | Ответ: νравн.(А)=8,792 моль, νравн.(В)= 0,396 моль, νравн.(D)= 0,604 моль, Кс=48,42, Кр=7,89∙10−6. |
Пример 3. Вычислите степень превращения (α) исходных веществ реакции A+4B=D и равновесный выход (ХD) конечного продукта реакции D, если начальные количества исходных веществ: 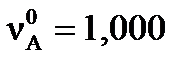 моль,
моль,  моль. При достижении равновесия:
моль. При достижении равновесия: 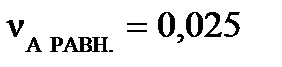 моль,
моль, 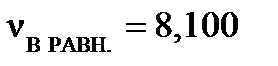 моль,
моль, 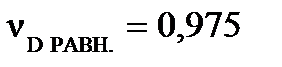 моль. Рассчитайте константу равновесия КС, если объем реакционного сосуда равен 50 л.
моль. Рассчитайте константу равновесия КС, если объем реакционного сосуда равен 50 л.
|
|
|
Дано:
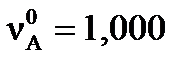 моль моль
 моль моль
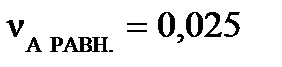 моль моль
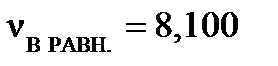 моль моль
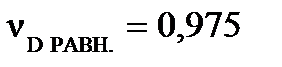 моль
V=50 л моль
V=50 л
| Решение.
Степень превращения исходных веществ можно найти: 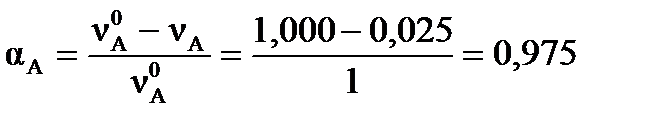 , , 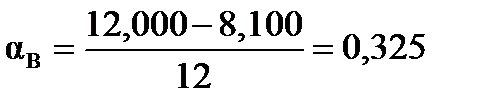 .
Равновесный выход вещества D определим по молярной доле этого вещества в равновесном состоянии системы: .
Равновесный выход вещества D определим по молярной доле этого вещества в равновесном состоянии системы: 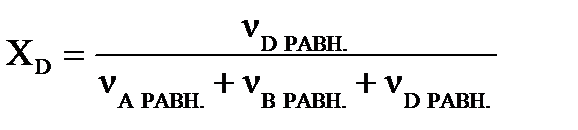 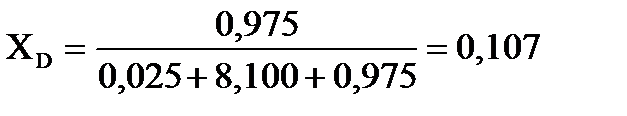 .
Равновесный выход (в %) вещества D (ХD) составит: ХD = 0,107∙100=10,7 %.
Константу равновесия рассчитаем: .
Равновесный выход (в %) вещества D (ХD) составит: ХD = 0,107∙100=10,7 %.
Константу равновесия рассчитаем:
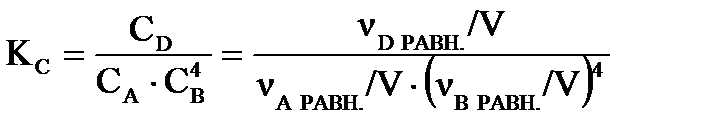
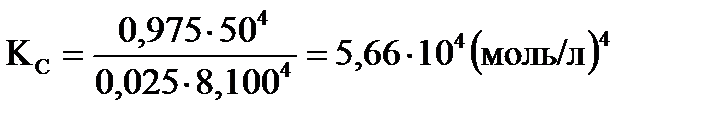 . .
|
| Найти:αА, αВ, ХD, КС? | Ответ: αА =0,975, αВ =0,325, ХD=10,7%, КС =5,66∙104(моль/л)4. |
Контрольные вопросы и задания:
1. Что называют химическим равновесием? Укажите термодинамическое и кинетическое условия равновесия.
2. Что называют константой равновесия, и от каких факторов она зависит? Приведите примеры для гомогенных и гетерогенных систем.
3. Сформулируйте принцип Ле-Шателье. Как влияет изменение внешних условий на состояние равновесия обратимой химической реакции?
СаСО3(т) = СаО(т) + СО2(г); ∆Н0 х.р. = 176,1 кДж/моль.
4. Рассчитайте температуру, при которой равновероятны оба направления реакции синтеза аммиака из азота и водорода.
5. Константа равновесия реакции N2O4 (г) = 2 NO2 (г) при 250 С равна 4,64∙10-3. В каком направлении будет идти реакция при следующих концентрациях веществ: С(N2O4) = 0,046 моль/л; С(NO2) = 0,0095 моль/л.
|
|
|
6. В каком направлении сместится равновесие в системе N2(Г) + 3H2(Г) ↔ 2NH3(Г), при условии, что ΔH0хр <0: а) при увеличении концентрации N2; б) при увеличении концентрации Н2; в) при повышении температуры; г) при уменьшении давления?
7. В системе 2NO(г)+O2 (г)= 2NO2 (г) равновесные концентрации веществ равны [NO]=0,2 моль/дм  , [O2]=0,3 моль/дм
, [O2]=0,3 моль/дм 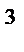 , [NO2]=0,4 моль/дм
, [NO2]=0,4 моль/дм 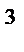 . Укажите преимущественное направление реакции.
. Укажите преимущественное направление реакции.
Экспериментальная часть
Опыт 1. Налейте в пробирку 4 – 5 мл разбавленного раствора роданида аммония (NH4CNS) и добавьте 4 – 5 мл разбавленного раствора хлорида железа (III) (FeCl3). Полученный раствор, характерная красная окраска которого обусловлена образующимся роданидом железа (III), разлейте поровну в четыре пробирки. Затем в первую пробирку добавьте концентрированного раствора роданида аммония, во вторую – концентрированного раствора хлорида железа (III), в третью пробирку –концентрированного раствора хлорида аммония, а раствор в четвертой пробирке оставьте для сравнения. Обратите внимание на изменение окраски растворов.
|
|
|
Приведите уравнение реакции в краткой ионной форме и выражение константы равновесия данной реакции. Объясните изменение окраски раствора с точки зрения закона действующих масс. Сделайте вывод о влиянии концентрации реагирующих веществ на химическое равновесие.
Опыт 2. Соли хромовой кислоты – хроматы окрашены в желтый цвет (цвет иона CrO4-2). Соли двухромовой кислоты – бихроматы окрашены в оранжевый цвет (цвет иона Cr2O7-2). В растворах хрома(VI) имеет место равновесие 2CrO4-2 + 2Н+ ↔ Cr2O7-2 + Н2О, которым можно управлять, изменяя концентрацию ионов водорода.
В пробирку поместите 3 – 4 капли 10% раствора бихромата калия и прибавляйте по каплям 2М раствор едкого кали до перехода оранжевой окраски в желтую. Затем к этому же раствору по каплям прибавляйте 2М раствор серной кислоты до появления вновь оранжевой окраски. Объясните изменение окраски раствора, анализируя уравнение изотермы Вант-Гоффа.
Лабораторная работа №6
Дата добавления: 2018-11-24; просмотров: 674; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
