Опыт 1. Зависимость скорости химической реакции от концентрации реагирующих веществ
Для исследования предлагается реакция:
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O
Реакция в ионно-молекулярном виде:
S2O32- + 2Н+ = SO2↑ + S↓ + Н2О.
Рассмотрите применимость закона действующих масс для данной реакции в ионно-молекулярном виде. Изобразите графически вид зависимости скорости реакции при увеличении концентрации тиосульфата натрия, условно обозначив ее как 1С, 2С, ЗС (при СН+ = const). Обсудите также вид зависимости скорости реакции от концентрации серной кислоты и Изобразите графически вид зависимости скорости реакции от концентрации серной кислоты, если 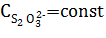 .
.
Методика выполнения опыта
Приготовьте три раствора тиосульфата натрия различной концентрации. Для этого в три пробирки налейте: в первую – 1 мл раствора Na2S2O3 и 2мл Н2О; во вторую – 2 мл Na2S2O3 и 1 мл Н2О; в третью – 3 мл того же раствора Na2S2O3. Затем в каждую пробирку добавьте по 1 мл раствора H2SO4 и измерьте время в секундах от момента добавления кислоты до появления первых признаков появления голубого окрашивания раствора вследствие образования микрокристаллов серы. Результаты опытов занесите в таблицу 1 и постройте график зависимости скорости реакции от концентрации тиосульфата натрия.
Опыт 2. Зависимость скорости реакции от температуры
Исследуется полуэмпирическое правило Вант-Гоффа и уравнение Аррениуса, графическое решение которого позволяет определить величину энергии активации реакции.
|
|
|
Методика выполнения опыта
В три пробирки налейте по 1 мл раствора Na2S2O3 и в каждую добавьте по 2 мл воды. В три конические пробирки налейте по 1 мл раствора H2SO4. В большой стакан налейте горячую воду (водяная баня), поставьте в водяную баню одну пробирку с раствором Na2S2O3 и одну пробирку с раствором H2SO4. Дайте растворам в пробирках прогреться в течение 1,5 мин, измерьте точно температуру водяной бани, запишите ее в таблицу. Далее не вытаскивая пробирку с раствором Na2S2O3, берете прогретую пробирку с раствором H2SO4 и вливаете кислоту в пробирку с раствором Na2S2O3. При сливании растворов включаете секундомер и замеряете время появления голубого окрашивания раствора. Затем, разбавляя горячую воду в водяной бане холодной водой понижаете температуру на 10 градусов. Помещаете в баню следующую пару пробирок (с раствором Na2S2O3 и с раствором H2SO4), прогреваете и проводите те же действия, что и в первом случае. Третью пару пробирок помещаете в водяную баню после понижения температуры (разбавлением холодной водой) еще на 10 градусов, прогреваете и проводите те же действия. Результаты опытов внесите в таблицу 2 и постройте график, откладывая по оси абсцисс – температуру, а по оси ординат относительную скорость (величину, обратную времени).
|
|
|
Рассчитайте средний температурный коэффициент реакции, используя правило Вант-Гоффа в заданном интервале температур.
Расчет температурного коэффициента (коэффициента Вант-Гоффа - γ).
γ1 = ύ3/ ύ2, γ2 = ύ2/ ύ1, γсред = (γ1 + γ2)/2.
Для графического расчета энергии активации постройте зависимость 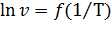 и по тангенсу угла наклона прямой определите энергию активации данной реакции. Щеголихина Н.А., Минаевская Л.В., Ткачева М.В.
и по тангенсу угла наклона прямой определите энергию активации данной реакции. Щеголихина Н.А., Минаевская Л.В., Ткачева М.В.
Пример экспериментального определения энергии активации:
1) во всех системах исследовался раствор тиосульфата натрия с концентрацией равной 1С; 2) в каждую систему добавлялся раствор серной кислоты объемом 1 мл;
2) по соответствующей методике проводился эксперимент, данные которого приведены в таблице 3, интервал температуры между измерениями должен составлять 100C;
Таблица 1
Экспериментальные данные υ = f (Т) или ln(ύ) = f (1/Т)
| № системы | Температура
|
(1/T)∙103 | Время (τ,с) появления голубого окрашивания | Относительная скорость ύ = 1/τ , с-1 |
−ln(ύ) | |
| t,0C | T, K | |||||
| 1 | 70 | 343 | 2,91 | 3 | 0,333 | 1,11 |
| 2 | 60 | 333 | 3,00 | 6 | 0,166 | 1,78 |
| 3 | 50 | 323 | 3,10 | 12 | 10,11 | 2,45 |
3) на основании экспериментальных данных строится графическая зависимость ln(ύ) = f (1/Т) (рис. 1);
|
|
|
| 2,9 3,0 3,1 3,2 |
| (1/T)∙103 |
| 2,5 2,0 1,5 1,0 |
| 2,000 |
| 1,5 |
| 1,0 |
| α |
| а |
| b |
| −ln(ύ) |
| Рис. 1. Экспериментальная графическая зависимость ln(ύ) = f (1/Т) |
| α |
| a |
| b |
| −ln(ύ) |
tgα = − ЕА/R.
R – газовая постоянная равная 8,31∙10-3 кДж/моль.
Тангенс α рассчитываем как отношение противолежащего катета к прилежащему в выделенном на графической зависимости прямоугольном треугольнике: tgα = а/ b, где а и b определяются по координатным осям. В данном примере:
а = −( ln(ύ)max − ln(ύ)min)
а = −(2,45−1,11) = − 1,34.
b = [(1/Т) max − (1/Т) min] = [3,1 – 2,91]∙10-3 = 0,19∙10-3,
tgα = − 1,34/0,19∙10-3 = 7,05∙103, − ЕА/R = − 1,34/0,19∙10-3.
Энергия активации будет равна: ЕА =7,05∙103∙8,31∙10-3=58,58 кДж/моль.
Дата добавления: 2018-11-24; просмотров: 471; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
