Студент: фамилия, и.,о. группа
Отчет к лабораторной работе
Химическая кинетика
Цель работы: исследование зависимости скорости химической реакции:
1) от концентрации реагирующих веществ;
2) от температуры процесса;
3) расчет энергии активации реакции.
Скоростью химической реакции (υ) называется: _______________________
_________________________________________________________________.
Скорость реакции зависит от следующих факторов:
1._____________________________2.______________________________
3.____________________________4. _______________________________
Зависимость скорости химической реакции от концентрации (C) реагирующих веществ описывается Законом…………………………………………………
Кинетическое уравнение (как частный случай Закона действующих масс) это функциональная зависимость:_______________________________________ ___________________________________________________
Константа скорости:_______________________________________________, численное значение константы скорости определяется:____________________.
Влияние температуры на скорость реакции описывается:
1) эмпирическим правилом Вант-Гоффа (формулировка и математическая запись)
__________________________________________________________________;
2) уравнением Аррениуса (логарифмическая и экспоненциальная формы уравнения)_________________________________________________________
Энергия активации (ЕА) это − ____________________________________________________________________________________________________________________________________.
Единицы измерения ЕА: __________________.
Опыт 1. Зависимость скорости химической реакции от концентрации реагирующих веществ.
|
|
|
υ = f (C)
Исследуемая реакция в молекулярном виде: Na2S2O3 + H2SO4 = Na2SO4 + H2SO3 + S
Na2S2O3 + H2SO4 = S + H2O + SO2 + Na2SO4.
Ионный вид уравнения: (S2O3)2- + 2H+ → S + H2O + SO2 + (SO4)2-.
Кинетическое уравнение (закон действующих масс) для данной реакции при переменной концентрации реагирующих веществ имеет вид: ____________________________________________________________ .
Кинетические уравнения и вид теоретических графических зависимостей (рис.2, рис.3) при постоянстве концентрации одного из реагирующих веществ:
а) С(H+) = const, υ = __________; б) С(S2O32-) = const, υ = _________
| υ |
| υ |
| С(H+) |
| Рис.2. υ = f (C(S2O32-)) |
| Рис.3. υ = f (C(H+)) |
| С(S2O32-) |
Таблица 2
Экспериментальные данные υ = f (C)
| № системы | Объём реагентов, мл | С(S2O32-) | Время (τ, с) появления голубого окрашивания | Относительная скорость ύ = 1/τ , с-1 | ||
| А | Б | В | ||||
| 1 | 1 | 2 | 1 | 1С | ||
| 2 | 2 | 1 | 1 | 2С | ||
| 3 | 3 | 0 | 1 | 3С | ||
Реагенты: А- тиосульфат натрия (Na2S2O3), Б- вода (H2O), В – серная кислота (H2SO4)
| ύ∙102, с-1 |
| С(S2O32-) |

| Рис.4. Экспериментальная зависимость скорости реакции от концентрации тиосульфат иона |
Опыт 2. Зависимость скорости реакции от температуры.
|
|
|
υ = f (Т) или ln(ύ) = f (1/Т)
Исходные концентрации реагирующих веществ во всех системах С(Na2S2O3) и С(H2SO4) одинаковы.
Математическая запись правила Вант-Гоффа ___________ ___________.
Уравнение Аррениуса в логарифмическом виде это уравнение прямой линии:
ln(ύ) 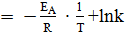 .
.
Таблица 3
Экспериментальные данные: υ = f (Т) или ln(ύ) = f (1/Т)
| № системы | Температура
|
(1/T)∙103 | Время (τ) появления голубого окрашивания, с | Относительная скорость ύ = 1/τ , с-1 |
−ln(ύ) | |
| t,0C | T, K | |||||
| 1 | ||||||
| 2 | ||||||
| 3 | ||||||
а) б)
| Рис.5. Графики экспериментальных зависимостей: а) υ = f (Т); б) ln(ύ) = f (1/Т) )∙103 |
| − ln(ύ) |
| t0, C |
| (1/T)∙103 |
| ύ∙102, с-1 |


Расчет температурного коэффициента (коэффициента Вант-Гоффа - γ).
γ1 = ύ3/ ύ2, γ2 = ύ2/ ύ1, γсред = (γ1 + γ2)/2.
Выводы по работе:
1.__________________________________________________________
__________________________________________________________
2.__________________________________________________________
|
|
|
__________________________________________________________
3.__________________________________________________________
__________________________________________________________
Студент: фамилия, и.,о. группа
Лабораторная работа № 5
Химическое равновесие
Выполняется для бакалавриата)
Цель работы: изучить влияние различных факторов на состояние равновесия, научиться прогнозировать сдвиг равновесия при действии различных факторов.
Рекомендации: при подготовке к работе необходимо повторить разделы «Химическая термодинамика», «Химическая кинетика» и ответить на все контрольные вопросы.
Важнейшие понятия: химическое равновесие, константа равновесия, уравнения изобары и изотермы реакции.
Следует уметь: приводить выражения кинетической и термодинамической констант равновесия; рассчитывать и связывать константу равновесия со свободной энергией Гиббса; определять направления смещения равновесия и оптимальные условия протекания процессов, используя принцип Ле- Шателье; рассчитывать температуру равновесного состояния системы.
Краткая теоретическая часть
Устойчивое равновесное состояние термодинамических систем характеризуется следующими общими условиями:
|
|
|
1) неизменностью равновесного состояния системы при сохранении внешних условий;
2) подвижностью равновесия (самопроизвольным восстановлением равновесия после прекращения внешнего воздействия, вызвавшего незначительное отклонение системы от положения равновесия);
3) динамическим характером равновесия, т.е. установлением и сохранением его вследствие равенства скоростей прямого и обратного процессов;
4) возможностью подхода к состоянию равновесия с двух противоположных сторон;
5) минимальным значением изменения изобарно-изотермического или изохорно-изотермического потенциалов (  ). Выражением этих условий является закон действия масс (константы равновесия).
). Выражением этих условий является закон действия масс (константы равновесия).
Для химической реакции в общем виде 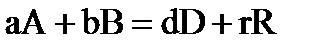 ,
,
протекающей в газовой фазе в изобарно-изотермических условиях, константа равновесия имеет вид:  ;
;  ;
;
где C и P- равновесные значения концентраций веществ (в моль/л), парциальных давлений в кПа, соответственно.
Константа равновесия, выраженная через парциальные давления компонентов газовой смеси, связана с константой Кс соотношением:  , где
, где  - изменение числа молей газа в реакции,
- изменение числа молей газа в реакции,  .
.
В основе термодинамического расчета констант равновесия и равновесных выходов продуктов лежит уравнение изотермы химической реакции Вант-Гоффа:  , где
, где  - произвольные парциальные давления и молярные концентрации начальных веществ и продуктов реакции.
- произвольные парциальные давления и молярные концентрации начальных веществ и продуктов реакции.
Для стандартного состояния системы, уравнения химического сродства имеют вид:  .
.
Для расчета константы равновесия можно применить уравнение изобары Вант-Гоффа  .
.
Дата добавления: 2018-11-24; просмотров: 298; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
