Нанотехнология как наука: определение, задачи, практические аспекты.
На современном этапе развития человеческого общества под нанотехнологией понимается междисциплинарная область фундаментальной и прикладной науки и техники, изучающая теоретические обоснования, практические методы исследования, анализа и синтеза, а также методы производства и применения продуктов с заданной атомной структурой путём контролируемого манипулирования отдельными атомами и молекулами.
Задачами нанотехнологии являются:
− изучение и управление процессами, как правило, в масштабе 1 нм, но не исключающее масштаб менее 100 нм в одном или более измерениях, когда ввод в действие размерного эффекта (явления) приводит к возможности новых применений;
− использование свойств объектов и материалов в нанометровом масштабе, которые отличаются от свойств свободных атомов или молекул, а также от объемных свойств вещества, состоящего из этих атомов или молекул, для создания более совершенных материалов, приборов и систем, реализующих эти свойства.
Таким образом, нанотехнологию можно также определить как совокупность методов и приемов, обеспечивающих возможность контролируемым образом создавать и модифицировать объекты, включающие компоненты с размерами менее 100 нм, хотя бы в одном измерении, и в результате этого приобретающие принципиально новые качества, позволяющие осуществлять их интеграцию в полноценно функционирующие системы большего масштаба.
Как и любую другую современную технологию, развитие наноразмерных технологий сопровождает нанонаука − исследование явлений и объектов на атомарном, молекулярном и макромолекулярном уровнях, характеристики которых существенно отличаются от свойств их макроаналогов.
В частности, нанохимия представляет собой раздел химии, исследующий свойства, строение и особенности химических превращений наночастиц, о которых будет рассказано ниже. Отличительной особенностью нанохимии является наличие размерного эффекта − качественного изменения физико-химических свойств и реакционной способности при изменении числа атомов или молекул в частице. Обычно данный эффект наблюдается для частиц размером меньше 10 нм, хотя данная величина имеет условное значение.
Нанооптика − раздел в оптики и нанотехнологии, в котором используется свет, локализованный в пространстве, много меньшем длины волны l, или объеме много меньшем l3. Основной задачей нанооптики является расширение оптических технологий на масштабы длин, находящихся за дифракционным пределом. Наиболее очевидными возможными технологическими приложениями, возникающими при преодолении дифракционного предела, являются микроскопия сверхразрешения и сверхплотное хранение информации. Однако область нанооптики не ограничивается технологическими приложениями и созданием приборов, а открывает путь к фундаментальным исследованиям структур нанометрового масштаба.
Нанофотоника − небольшой раздел нанооптики, в которой исследуются нанополя с малым количеством фотонов и изучается поведение света в наномаштабах.
Наноэлектроника – область современной электроники, занимающаяся разработкой физических и технологических основ создания интегральных электронных схем и устройств на их основе с размерами элементов менее 100 нм. Основная задача наноэлектроники состоит в разработке новых электронных устройств со сверхмалыми размерами, создании методов их получения и объединения в интегральные схемы. Последовательные технологические переходы от электротехнических компонентов – к электронным лампам, от ламп – к транзисторам, от транзисторов – к интегральным схемам позволили создать современные мобильные телефоны, карманные компьютеры, индивидуальные медицинские аппараты и многие другие продукты электроники, прочно вошедшие в жизнь современного человека. Сегодня техника вплотную приблизилась к теоретической возможности запоминать и передавать 1 бит (состояния логического «0» или «1») информации с помощью одного электрона, положение которого в пространстве может быть задано одним атомом. Таким образом, размеры элементов интегральных схем будут составлять всего несколько атомных слоев. Но при таких размерах элементов (порядка нескольких нанометров) законы классической физики уже перестают действовать, и поведение таких элементов описывается законами квантовой механики.
Наномедицина − слежение, исправление, конструирование и контроль над биологическими системами человека на молекулярном уровне, используя наноустройства и наноструктуры.
Наночастицы
Как уже оговаривалось выше, современная тенденция к миниатюризации показала, что вещество может иметь совершенно новые свойства, если взять очень маленькую частицу этого вещества. Частицы размерами от 1 до 100 нм обычно называют «наночастицами».
Нанообъекты делятся на 3 основных класса: трёхмерные частицы, получаемые взрывом проводников и плазменным синтезом; двумерные объекты − плёнки, получаемые методами молекулярного и ионного наслаивания; одномерные объекты − вискеры, получаемые методом молекулярного наслаивания, введением веществ в цилиндрические микропоры и т. д. Кроме того, существуют нанокомпозиты − материалы, полученные введением наночастиц в какие-либо матрицы.
Один из важнейших вопросов, стоящих перед нанотехнологией − как заставить молекулы группироваться определённым способом, самоорганизовываться, чтобы в итоге получить новые материалы или устройства. Этой проблемой занимается раздел химии − супрамолекулярная химия. Она изучает не отдельные молекулы, а взаимодействия между молекулами, которые способны упорядочить молекулы определённым способом, создавая новые вещества и материалы.
Примеры супрамолекулярных структур, полученные в результате «самосборки» наночастиц, приведены на рис. 9.1.
В широкой трактовке, к наночастицам можно отнести следующие наноразмерные объекты: крупные молекулы органических макроциклических соединений; нековалентные макроциклические структуры; молекулы полимеров и дендримеров; фуллерены, нанотрубки, наносферы, наноцилиндры, нановолокна, нанопроволоки, нанодиски, нанолуковицы и т.п.; графен, лежащий в основе строения углеродных наночастиц; всевозможные комбинации из нанотрубок, фуллеренов и других наночастиц; ансамбли из наночастиц.
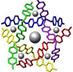
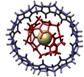
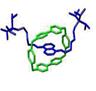
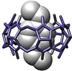
Рис. 9.1. Супрамолекулярные структуры, полученные в результате «самосборки» наночастиц, в том числе − ротаксаны (третий слева фрагмент).
Ротаксаны — один из объектов супрамолекулярной химии. Так называют соединения, в которых кольцевые молекулы (различные краун-эфиры, циклодекстрины и др.) надеты на линейную молекулу. Их характерная черта — кольцо и стержень не соединены ковалентными связями, а удерживаются либо слабыми межмолекулярными взаимодействиями, либо к концам стержня прикреплены объемные молекулы — стопперы, которые механически не дают кольцу соскользнуть. Если позволяет длина линейного фрагмента, то можно получить ротаксан с несколькими кольцами − полиротаксан. Некоторым полиротаксанам уже нашлось применение. При образовании полиротаксана изменяются и координационные свойства краун-эфира, следовательно, таким образом можно влиять на селективность захвата кольцом определенных ионов металлов. Молекулярные ожерелья, например, пытаются использовать для очистки соединений в лабораторных условиях. Полиротаксаны можно использовать в качестве носителей лекарственных средств. Их взаимодействие с клетками крови изучено довольно подробно и установлено, например, что оксипропиленовые полиротаксаны влияют на некоторые свойства мембран. Уже сделаны первые попытки их включения в теофиллин и инсулин.
Чрезвычайно актуальной областью применения ротаксанов являются супрамолекулярные устройства и переключатели. Ротаксаны удобны в этом плане, поскольку можно легко контролировать их молекулярный порядок, то есть пространственное расположение их составляющих. Вводя в молекулы ротаксанов фото-, электро- или ионоактивные группы, можно переносить энергию, электроны или ионы, а также передавать сигналы или хранить информацию
Дендримеры. Благодаря успехам химии высокомолекулярных соединений, наряду с обычными полимерами линейного и разветвлённого строения, получены высокомолекулярные соединения нетрадиционного типа - дендримеры, а также продукты их дальнейшей полимеризации - дендритные полимеры. Дендример по внешнему виду напоминает крону дерева, вырастающего из одного корня. В молекуле дендримера присутствует реакционный центр (корень), от которого отходят всё более разветвляющиеся молекулярные цепочки (ветви или дендроны). Синтез дендримера осуществляют постадийно, из одного реакционного центра путём ступенчатого наращивания разветвлённых цепочек с концевыми функциональными группами. В итоге, через ряд стадий роста, может быть получена молекула дендримера с любой степенью разветвлённости. Если разветвлённость достаточно большая, то такая частица становится похожей на ворсистый шарик или клубок. Именно так построены очень сложные молекулы многих белков и белковых микроорганизмов, например, вирусов (рис.9.2).



Рис. 9.2. Слева – направо: модель вируса и два вида дендримеров.
Внутри дендримера могут образовываться полости, заполненные веществом, в присутствии которого дендримеры были образованы. Если дендример синтезирован в растворе, содержащем какой-либо лекарственный препарат, то этот дендример становится нанокапсулой с данным лекарственным препаратом. Также полости внутри дендримера могут содержать вещества с радиоактивной меткой, применяемые для диагностики различных заболеваний. Кроме того, заполняя полости дендримеров необходимыми веществами, можно, например, собирать из различных дендримеров наноэлектронные схемы. При этом дендример, заполненный медью, может служить проводником и т.п. Многообещающим направлением в применении дендримеров является их возможное использование в качестве нанокапсул, доставляющих лекарственные препараты непосредственно клеткам, нуждающимся в этих препаратах. Подробнее об этих технологиях будет изложено в разделе медицинских приложений нанотехнологий.
Фуллерены. Большим достижением нанохимии стало открытие в 1985 году фуллерена (рис.9.3, Б), который является очередным аллотропным видоизменением углерода (после алмаза, графита и карбина). Своё название фуллерен получил по фамилии американского архитектора Ричарда Фуллера (1895-1983), который сконструировал купол павильона США на выставке в Монреале в 1967 году в виде сочленённых пяти- и шестиугольников. Молекула фуллерена С60 напоминает по форме футбольный мяч, откуда и происходит второе название - «футболлен».

Рис. 9.3. А. Здание Биосферы в Монреале (архитектор Бакминстер Фуллер). Б. Молекула фуллерена С60.
Впервые фуллерен был идентифицирован в результате воздействия мощного лазерного луча на твёрдую графитовую мишень. Будучи непредельным углеводородом, фуллерен способен к реакциям присоединения с органическими и неорганическими молекулами, что открывает широкие возможности для нанотехнологий. В основе биологической активности фуллеренов лежат, в первую очередь, три свойства этих молекул: липофильность, определяющая мембранотропные свойства, электронодефицитность, приводящая к способности взаимодействовать со свободными радикалами, и способность их возбужденного состояния передавать энергию молекуле обычного кислорода и превращать его в синглетный кислород. Свойство фуллерена образовывать активные формы кислорода используется в фотодинамической терапии, являющейся одним из способов лечения рака. Фуллерены обладают способностью встраиваться в поверхности клеточных мембран, проявляют антиоксидантные и транспортные свойства. Было показано, что фуллерен может понижать активность ВИЧ-интегразы – белка, отвечающего за встраивание вирусной кДНК в ДНК человека. Фуллерены, взаимодействуя с этим белком, способны изменять его конформацию, влияя таким образом на его функции.
На сегодняшний день фуллерены являются перспективными и многообещающими объектами нанобиотехнологий. Однако исследования фуллеренов и их свойств находятся лишь на начальной стадии, и до применения их в медицинской практике необходимо детально изучить влияние на живые организмы, механизмы взаимодействия с клеткой и отдельными ее компартментами.
Нанотрубки. Получены и другие углеродные наночастицы, родственные фуллерену, но отличающиеся от него по строению и свойствам. Принято считать, что они образуются путём сворачивания графеновых плоскостей в бесшовные трубки при высоких температурах (о графене речь пойдёт ниже).
Для нанотрубок характерен диаметр от одного до нескольких десятков нанометров и длина до нескольких сантиметров. Нанотрубки могут быть как однослойными, так и многослойными, вставленными одна в другую (рис. 9.4).

Рис. 9.4. Однослойные, двухслойные и трехслойные углеродные нанотрубки.
Углеродные нанотрубки постоянно находятся в фокусе внимания мировой научной и инженерной общественности благодаря целому ряду необычных физических свойств. К числу последних относится, прежде всего, удивительная прочность в сочетании с высокими значениями упругой деформации, позволяющая получать сверхпрочные композиционные материалы. Весьма необычны также электронные свойства нанотрубок. С одной стороны, есть трубки с хорошей электронной проводимостью, превышающей таковую для признанных проводников (Cu, Ag), с другой стороны, большинство трубок — это полупроводники, на основании которых можно создать различные электронные приборы с рекордно малыми размерами. В частности, появляется реальная перспектива разработать запоминающие устройства с плотностью записи до 1014 бит/см2. Одно из самых замечательных свойств нанотрубки — связь между геометрической структурой нанотрубки и её электронными характеристиками, которые можно предсказать на основе квантово-химических расчётов. Угол ориентации графитовой плоскости относительно оси трубки определяет, какой проводимостью она будет обладать: металлической или полупроводниковой.
Способность нанотрубок преодолевать биологические мембраны и проникать через гематоэнцефалический барьер служат основой для проведения исследований по использованию нанотрубок в качестве носителей для адресной доставки лекарств.
По прогнозам через 20-25 лет нанотрубки будут использоваться в качестве проводников, стабилизированные ансамбли наночастиц – в качестве памяти молекулярных компьютеров, которые придут на смену нынешним полупроводниковым кремниевым, а через следующие 10-20 лет прогнозируют приход нового поколения компьютеров — квантовых и ДНК-компьютеров.
Часть супермолекул и супрамолекулярных ансамблей, которые предполагается использовать в молекулярных компьютерах вместо кремниевых чипов, можно с достаточным основанием назвать «интеллектуальными молекулами». Они могут существовать в двух состояниях, одно из которых обладает электрической проводимостью. Перевод из одного состояния в другое можно осуществить под воздействием тепла, света, химических агентов, электрического и магнитного полей. Такие молекулярные переключатели — это, в сущности, будущие транзисторы молекулярных компьютеров. Их размеры будут на два порядка меньше нынешних. Это даст огромное (на десять порядков) повышение производительности.
(Примечание. По прогнозам, будущий молекулярный компьютер может оказаться в несколько миллионов раз эффективнее нынешнего персонального компьютера. Кроме того, рассматриваются такие новые и весьма перспективные разработки, как создание наноразмерных электрических контактов путем нанесения металлических покрытий на белки и биоматериалы.)
Графен представляет собой кристаллическую пленку углерода, толщиной в один атом. Его вес настолько мал, что легко удерживается на цветочных лепестках (рис. 9.5). Графен обладает целой совокупностью интересных свойств, перспективных для различных приложений. Это высокая проводимость, прозрачность для света, способность к механическому растяжению, химическая инертность.


Рис. 9.5. Графен. Его вес настолько мал, что легко удерживается на цветочных лепестках.
Графен является высокопроводящим материалом, почти прозрачен и поглощает около 2% света, причем в широком оптическом диапазоне — от ультрафиолета до инфракрасного. Поэтому графен можно использовать в жидкокристаллических дисплеях, солнечных батареях или фотоэлектронных датчиках в качестве хорошо проводящего и прозрачного внешнего электрода. Довольно ограниченный ряд материалов обладает одновременно и хорошей проводимостью и прозрачностью. Еще одно важное свойство графена состоит в том, что его деформация при растяжении достигает 20%. Это позволит делать гибкую или изогнутую электронику и будет актуально для различных гаджетов. К примеру, экран планшета, можно будет свернуть в трубку диаметром несколько сантиметров. Самое привлекательное приложение, наверное, — это использование графена в быстродействующей микроэлектронике.
ДНК-нанотехнологии.
Основа жизни − ДНК − в будущем, возможно, станет основой электроники, вытеснив традиционный кремний. Действительно, у этой молекулы есть неоспоримые преимущества − малые размер и способность к самоорганизации, что позволяет создавать схемы гораздо более компактные, чем предлагает современная микроэлектронная промышленность. Благодаря химическим связям, нити ДНК могут выступать компонентами микросхем, «собираясь» при смешивании в соответствии с алгоритмом, заданным исследователем. Основная идея технологии состоит в следующем. К одной из комплементарных нитей подсоединяется молекула А, ко второй − молекула Б. Имеем два вещества: ~~~~А и ~~~~Б, где ~~~~ − условное изображение одинарной молекулы ДНК. При смешивании этих двух веществ между двумя одинарными цепочками ДНК образуются водородные связи, которые притянут молекулы А и Б друг к другу. Условно изобразим полученное соединение: »»»»АБ. Молекула ДНК может быть легко удалена после окончания процесса.
Уже разработан простой способ преобразования гибких биомолекул ДНК в жесткие многогранники (рис. 9.6, слева). Нанопирамиды самопроизвольно формируются из фрагментов биомолекул, причем такую конфигурацию ДНК "выбирает" самостоятельно. С этой целью фрагменты молекулы помещались в солевой раствор, который доводили до кипения. После охлаждения раствора, в нем были обнаружены макромолекулы в форме тетраэдра, каждое из шести ребер которого состояла из "скрученной" ДНК. Выход (доля "превратившихся" молекул) составил 95 процентов. Тетраэдры можно рассматривать как "строительные блоки" для более сложных структур, в частности, их можно "склеивать" и получать разнообразные трехмерные наноконструкции. "Скелеты" из тетраэдров собираются использовать в наноэлектронике. Помимо этого, появляется возможность доставлять в "емкостях" из ДНК токсичные лекарственные препараты внутрь пораженных клеток. В отличие от других молекул с полостями, "ДНК-контейнеры" удобны тем, что в организме уже существуют ферменты для их разрушения. Варьируя последовательности нуклеотидов, из которых состоит ДНК, можно добиться максимальной избирательности таких лекарственных форм.
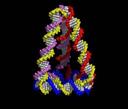

Рис. 9.6. Пирамида из нитей ДНК (слева); упорядоченные структуры из нитей ДНК (справа).
Кроме того, разработана технология, позволяющая 'разматывать' длинные нити ДНК и формировать из них точные заготовки, что создает дополнительные возможности для наноэлектроники будущего. Нити ДНК «вытягиваются» из капель воды с раствором молекул при помощи наноразмерного гребня. Для этого гребень погружается в каплю воды, содержащую скрученные молекулы ДНК. Часть из молекул попадает между зубцами гребня и раскручивается по мере вытаскивания из воды. Полученные нити ДНК удалось упорядочить в сложные структуры (рис. 9.6, справа).
Еще одним примером «ДНК-наноконструктора» являются наноструктуры-сетки. Свойство самосборки молекулы ДНК было запантентовано для массового производства нанометровых структур в форме сетки 4х4. Это достижение является шагом к выпуску электронных или оптических схем с масштабами в 10 раз меньше, чем выпускаются сейчас. Вместо использования кремния как основы для создания схем, были использованы сетки из нитей ДНК. При этом наименьший размер полученных сеток составляет от 5 до 10 нм, в сравнении с 65 нм в современных кремниевых чипах. Для демонстрации заявленных возможностей ученые синтезировали миллиарды отдельных сеток, на которых с помощью белка были организованы буквы – аббревиатура компании ‑ "D," "N" и "A" (рис. 9.7 показывает их изображения, полученные с помощью атомного силового микроскопа).
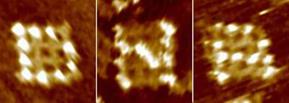
Рис. 9.7. Пример надписи ("D," "N" и "A"), полученной при помощи наноструктур-сеток.
Создание таких сеток стало возможным благодаря связывающим свойствам ДНК, т. е., когда большое количество нитей ДНК могут соединяться друг с другом лишь определенным образом. В описанном процессе возникали сетки, по крайней мере, в 10 раз меньшие, чем в наилучших современных литографических процессах, при этом использование строительных элементов ДНК, способных к самоорганизации, позволяет одновременно производить миллиарды копий требуемой структуры.
Наномедицина
Это новое междисциплинарное направление медицинской науки в настоящее время находится в стадии становления. Её методы только выходят из лабораторий, а большая их часть пока существует только в виде проектов. Однако большинство экспертов полагает, что именно эти методы станут основополагающими в XXI веке. Так, например, национальные институты здравоохранения включили наномедицину в пятёрку самых приоритетных областей развития медицины XXI века, а Национальный институт рака США собирается применять достижения наномедицины при лечении рака. Ряд зарубежных научных центров уже продемонстрировали опытные образцы в областях диагностики, лечения, протезирования и имплантирования.
На сегодня существуют три подхода к наномедицине, посредством которых предполагается осуществлять диагностику и лечение на клеточном, субклеточном и молекулярном уровнях. К ним относятся подходы: «сверху вниз», «мокрая нанотехнология» и «молекулярная нанотехнология».
Подход «сверху вниз» заключается в дальнейшем усовершенствовании существующих микроустройств, в первую очередь - в их дальнейшей миниатюризации. Современные микроэлектронные технологии позволяет изготовлять такие устройства, как микромоторы, акселерометры, гироскопы, разнообразные микродатчики, микроклапаны, микронасосы и шестеренчатые передачи размером менее микрона.
В настоящее время целый ряд ученых во всем мире работает над созданием микроустройств, которые могли бы работать внутри человеческого организма. Такие устройства могут быть стационарно закрепленными в тканях, перемещаться пассивно или активно. В последнем случае они могут "ползти" по поверхностям внутренних полостей человеческого организма, "плавать" во внутрижидкостных средах или, даже, "пробуравливать" себе ходы в тканях.
Так, например, современное устройство, предназначенное для исследования желудочно-кишечного тракта, имеет размер несколько миллиметров, несет на борту миниатюрную видеокамеру и систему освещения. Полученные кадры передаются наружу. Устройства такого рода было бы неправильно относить к области наномедицины. Однако, открываются широкие перспективы их дальнейшей миниатюризации и интеграции с наносенсорами и бортовыми системами управления и связи на основе молекулярной электроники и других нанотехнологий. Источникам энергии таких систем является утилизация веществ, содержащиеся во внутренних средах организма. В дальнейшем такие устройства могут быть снабжены манипуляторами и приспособлениями для автономной локомоции. В этом случае они окажутся способны проникать в нужную точку организма, собирать там локальную диагностическую информацию, доставлять лекарственные средства и, в еще более отдаленной перспективе, осуществлять "нанохирургические операции" ‑ разрушение атеросклеротических бляшек, уничтожение клеток с признаками злокачественного перерождения, восстановление поврежденных нервных волокон и т.д.
Под «мокрой» нанотехнологией понимают изучение биологических систем, которые существуют предпочтительно в водной среде и включают генетический материал, мембраны, ферменты (биокатализаторы) и другие компоненты клеток.
«Мокрая» нанотехнология основана на использовании готовых механизмов, существующих в живой природе и состоит из нескольких направлений.
F Биотехнология подразумеваетиспользование существующих организмов в качестве основы для создания биороботов. В настоящее время уже существуют опыт использования в качестве биороботов определенных микроорганизмов с контролируемыми генетическими модификациями.
F Вирус как робот. В настоящее время вирусы уже активно используются для внесения в клетки нового генетического материала. В перспективе возможно использование разнообразных роботов-вирусов, способных распознавать клетку определенного типа, находящуюся в определенном состоянии. В зависимости от конкретной ситуации такой робот-вирус сможет убить эту клетку (например, возбудителя заболевания) или ввести в нее необходимые молекулы ДНК или РНК - вплоть до полной замены поврежденного генетического материала.
F Клетка-робот. Клетки в организме человека способны целенаправленно перемещаться, иногда на большие расстояния, уничтожать другие клетки или, наоборот, встраиваться в поврежденные ткани на место погибших. Путем искусственных модификаций, клетки возможно заставить разрушать атеросклеротические бляшки, регенерировать поврежденные органы, конечности и т.д. Клетки могут нести метки, позволяющие следить за их перемещением по организму, выделять в окружающую среду вещества, несущие диагностическую информацию.
F Молекулярная биология. В организме человека существует огромное количество разнообразных ферментов ‑ белков или их соединений, обладающих разнообразной и высокоизбирательной активностью. Часть из них, совместно с нуклеиновыми кислотами, обеспечивают работу генетического механизма. Например, молекула фермента ДНК-репаразы, перемещаясь вдоль двойной спирали ДНК, исправляет ошибки в последовательности нуклеотидов, составляющих эту спираль. Такие ошибки неизбежно возникают под действием температуры, различных химических веществ, радиации и т.д. Молекула ДНК-репаразы находит молекулу ДНК, перемещается вдоль нее, распознает нарушения в последовательности нуклеотидов, принимает решение о том, какую из 2-х нитей ДНК считать правильной, "вылавливает" из окружающей среды нужный нуклеотид, удаляет неправильный и вставляет на его место правильный. Практически, она ведет себя как робот, решающий довольно сложную и многовариантную задачу ситуационного поведения. Весьма перспективным является направление, заключающееся в модификации существующих или синтезе новых белков, которые в комплексе с ДНК способны к решению других, более сложных задач, например, лечения поврежденных или состарившихся клеток. Нужно признать, однако, что необходимого уровня понимания работы ферментов наука еще не достигла.
Более простым путем может быть использование способности молекул белков и более коротких полипептидов избирательно связываться друг с другом и с молекулами других веществ в наперед заданную супермолекулярную конструкцию. В частности, в предыдущем разделе была рассмотрена способность к самосборке молекулы ДНК.
Молекулярная нанотехнология представляется наиболее перспективным подходом к наномедицине. Он основан на механосинтезе ‑ конструировании и изготовлении отдельных молекул, обладающих заданными наперед свойствами. Примером тому являются конструкции из атомов углерода – фуллерены и нанотрубки, рассмотренные выше.
По теории Э. Дрекслера из алмазоподобного углерода также могут быть изготовлены молекулы, имеющие форму самых разнообразных «деталей»: шестеренок, штоков, компонентов подшипников, сочленений, роторов молекулярных турбин, подвижных узлов манипуляторов и т.д. (рис. 9.8). В настоящий момент эти молекулы не синтезированы, но расчёты показывают, что они могут существовать, быть устойчивыми и взаимодействовать друг с другом. Предполагается, что с помощью сканирующих зондовых микроскопов, либо путем самосборки молекулы-«детали» смогут собираться в работоспособные наноконструкции. Гипотетические наноконструкции, способные к перемещению в окружающей среде и снабженные бортовой системой управления получили название нанороботов.
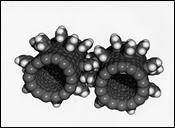
Рис. 9.8.Условная схема зубчатого зацепления (колёса), изготовленного методом нанотехнологии из молекул
Среди проектов будущих медицинских нанороботов уже существует внутренняя классификация по области их использования на микрофагоциты, респироциты, клоттоциты, васкулоиды и другие. Микрофагоциты принадлежат к классу медицинских нанороботов, являющихся искусственными иммунными клетками. Они предназначены для уничтожения патогенных микроорганизмов в крови, потенциально помогая в свертывании крови, транспорте кислорода и углекислого газа, и создании надстройки к естественной иммунной системе. Предполагается, что микрофагоциты будут находить в организме человека чужеродные элементы и перерабатывать их в нейтральные соединения быстрее и «чище», чем собственные фагоциты. Респироциты являются аналогами эритроцитов, которые имеют значительно большую функциональность, чем их природные прототипы. Их внедрение позволит снизить постоянную потребность человека в кислороде, позволяя подолгу обходиться без него, что поможет людям, страдающим астматическими заболеваниями. Предполагается, что эти наномашины будут анализировать сигналы от своих сенсоров для принятия акустических команд от врача. Клоттоциты‑ искусственные аналоги тромбоцитов. Эти машины позволят быстро купировать кровотечения за счет быстрой доставки к месту кровотечения искусственной связывающей сети, которая позволяет задерживать кровяные клетки, останавливая ток крови. Васкулоид ‑ механический протез, создаваемый на основе микрофагоцитов, респироцитов и клоттоцитов, который входит в состав проекта по созданию робототехнической крови ("Roboblood"). Машина представляет собой комплекс медицинских нанороботов, способных жить и функционировать в теле человека, выполняя все функции естественной кровеносной системы. Предполагается, что робототизированная кровь позволит своему владельцу избавляться от микробов, вирусов, атеросклеротических бляшек, а также восстанавливать поврежденные клетки.
Весьма актуальным для наномедицины является создание таких устройств как наноманипуляторы. В настоящее время созданы прототипы нескольких вариантов "нанопинцета". В одном случае использовались две углеродные нанотрубки диаметром 50 нм, расположенные параллельно на сторонах стеклянного волокна диаметром около 2 мкм. При подаче на них напряжения нанотрубки могли расходиться и сходиться наподобие половинок пинцета. В другом случае использовались молекулы ДНК, меняющие свою геометрию при конформационном переходе или разрыве связей между нуклеотидными основаниями на параллельных ветвях молекулы.
К настоящему моменту в мире уже создан ряд действующих технологий для наномедицинской отрасли. К ним относятся: адресная доставка лекарств, диагностика заболеваний с помощью квантовых точек, лаборатории на чипе, новые бактерицидные средства, имплантаты.
Адресная доставка лекарств позволяет доставлять медикаменты к больным органам, избегая здоровых тканей. Например, лучевая терапия и химиотерапевтическое лечение, уничтожая больные клетки, наносят непоправимый вред здоровым тканям. Решение этой проблемы возможно путем создания некоторого "транспорта" для лекарств, варианты которого уже предложены целым рядом институтов и научных организаций.
Применение систем транспорта позволяет пролонгировать действие лекарственного соединения и обеспечить необходимую биосовместимость; защитить лекарственное соединение от преждевременной биодеградации; увеличить его способность по преодолению мембранного и гематоэнцефалического биологических барьеров; осуществлять направленный ткане- и/или мишень-специфический транспорт препарата; обеспечить контролируемое высвобождение лекарственного соединения с поддержанием его оптимальной терапевтической концентрации в крови и тканях с минимизацией побочных эффектов.
Список структур нанометрового диапазона, которые уже применяются или будут применяться в ближайшем будущем для разработки систем транспорта лекарств, достаточно велик. К ним относятся: фуллерены, дендримеры, липочастицы, наночастицы золота, серебра, квантовые точки, магнитные наночастицы, нанопарамагнетики, нанопорошки и нанокристаллы, наночастицы на основе кремния и т.д. В последние годы особое внимание уделяется фосфолипидным наночастицам - коллоидальным переносчикам лекарств, в эффективность которых существенный вклад вносят размеры (менее 100 нм.). Фосфолипидные наночастицы (липосомы, мицеллы) биодеградируемы, биологически инертны, не вызывают аллергических, антигенных или пирогенных реакций. Поверхность липидных наночастиц, в сравнении с другими частицами, легко модифицируется для обеспечения направленности доставки. С их помощью можно транспортировать очень широкий спектр биологически активных веществ ‑ от лекарственных субстанций, до генных конструкций. На сегодня разработаны липосомальные формы противоопухолевых препаратов (доксорубицин, метотрексат, винбластин, актиномицин, L-аспарагиназа), а также ряда пептидов, полиеновых антибиотиков, бычьего инсулина, противовоспалительных и кортикостероидных препаратов (кортизона, гидрокортизона, дексаметазона). Весьма перспективным выглядит использование липосомальных форм препаратов для лечения внутриклеточного паразитизма (лейшманиоз, малярия, токсоплазмоз). Актуальной представляется проблема инкапсулирования в липосомах и внутриклеточного введения нуклеиновых кислот.
К высоким технологиям адресной доставки лекарств относятся также миниатюрные самособирающиеся контейнеры кубической формы. Они являются относительно недорогими, и могут производиться в массовом порядке. Кроме того, благодаря своей металлической структуре, положение контейнеров внутри тела может отслеживаться с помощью магнитного резонанса. Считается, что подобные микроконтейнеры могут оснащаться электронными компонентами, что обеспечит их использование в качестве биосенсоров в теле человека или же позволит высвобождать лекарственные препараты в ответ на поступивший извне радиосигнал.
Квантовые точки (КвТ) ‑ это флуоресцентные полупроводниковые нанокристаллы, обладающие новыми квантовыми свойствами благодаря своему малому размеру. Типичные размеры КвТ варьируют в пределах от 1 до 20 нм в зависимости от типа вещества. КвТ поглощают электромагнитное излучение в широком диапазоне длин волн, а излучают в узком, что делает их эффективным источником света. Цвет флуоресценции, в первую очередь, зависит от размера наночастиц. КвТ являются биомаркерами нового поколения для различных областей клинической диагностики, включая раковые и аутоиммунные заболевания. Как метки или маркеры, присоединенные к биомолекулам и антителам, КвТ могут помочь проследить их движение внутри организма, а биологически связанные квантовые точки можно «настроить» на обнаружение вирусов, клеточных органелл, клеток, тканей in vitro и in vivo (Рис. 9.9).
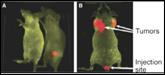
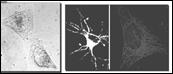
Рис. 9.9. Квантовые точки для выявления очагов опухолей (слева) и мечения живых клеток и визуализация внутриклеточных структур (справа)
Размеры КвТ, с одной стороны, достаточно малы, чтобы были возможны исследования внутри клеток, например нейронов, с другой стороны, достаточно велики (в сравнении с атомами), чтобы их можно было обнаружить и визуализировать с помощью методов высокого пространственного разрешения.
Лаборатории на чипе (ЛНЧ), (англ. а lab-on-a-chip) – устройства для производства биохимических и медицинских анализов.

Рис. 9.10. Портативный интеллектуальный сенсор (лаборатория на чипе) для проведения анализа крови.
Это отдельный чип, как правило, выполненный из кремния или пирекса. Обычно для обнаружения или количественного анализа какого-либо вещества в окружающей среде или в полученном от пациента биологическом материале проводят реакцию с реактивом, который специфически взаимодействует с этим веществом. В результате такой реакции образуется вещество с новыми физическими или химическими свойствами. При условии, что полученное вещество имеет цвет или же может светиться под действием света, количественный и качественный анализ нового соединения проводят с помощью спектрофотометрии или флуориметрии. По такому же принципу работает и ЛНЧ — биологический микрочип, представляющий из себя твердую подложку с небольшими ячейками, в каждой из которых закреплено вещество-реагент, призванный служить зондом для проведения той или иной реакции. Все реагенты расположены в определенном порядке и взаимодействуют с анализируемым образцом. Лаборатории на чипе выполняют функции множества традиционных макроскопических лабораторных процессов, таких как предварительная подготовка, реакция и детектирование. Все это осуществляется на микроуровне. Преимущества заключаются в уменьшении времени анализа и портативности микроустройства. Уменьшение анализируемого образца и объема реагента увеличивает эффективность и уменьшает стоимость микроанализов в аналитической химии и биохимии. Подавая управляющие электрические импульсы, можно смешивать реагенты до нужных концентраций или разделять их. Получаемые при этом реактивы способны реагировать на наличие бактерий или определенных химических загрязнителей.
Биосовместимые наноматериалы Особые свойства наноматериалов могут быть использованы для выращивания искусственных органов и тканей. Так, например, разработана методика восстановления хрящевой ткани без донорских клеток больного. Специальный гель, содержащий хрящевые клетки, с помощью артроскопа вводится через небольшие наружные надрезы. Новая ткань растёт и соединяется с нормальным хрящом, а гель саморазрушается через запрограммированный промежуток времени. Основу геля составляют пептиды, способные формировать нановолокна 10-20 нм в диаметре. Искусственная природа этих наночастиц исключает возможность заражения пациента.
В области стоматологии разрабатывается направление использования наноматериалов для восстановления механических свойств зубной эмали и технологии обработки поверхностей методом
нанонапыления с целью придания им антибактериальных свойств.
На стадии испытаний находится самонастраивающийся имплантант сетчатки – сложнейший результат применения технологии микросистем и нанотехнологий. Его задача – частично восстановить зрение в случае слепоты, вызванной retinitis pigmentosa. В систему входит крошечная камера в оправе очков, передающая изображения окружающего мира на специальное самонастраивающееся устройство обработки сигналов. Посредством беспроводной связи устройство передает информацию об изображении внутрь пораженного глаза, где миниатюрные электроды, нанесенные на гибкую пленку и соединенные с сетчаткой, соответствующим образом стимулируют зрительный нерв. Если эта разработка окажется успешной, она станет первым человеко-машинным интерфейсом для зрения.
Все это ‑ далеко не полный перечень применения нанотехнологий в медицине.
Нельзя обойти молчанием и противоположный аспект влияния нанотехнологий на окружающую среду. Нанотехнологии могут принести огромную пользу, но и причинить огромный вред. Они могут представлять угрозу для окружающей среды и здоровья человека. Полученные нанотехнологичные продукты обладают поистине фантастическими свойствами. Они сверхпрочны, сверхактивны и сверхмалы. Опасность наноматериалов, в первую очередь, заключается в их микроскопических размерах. Благодаря малым размерам, наноматериалы химически более активны, а вследствие большой суммарной площади поверхности даже малотоксичное нановещество может стать очень токсичным. Кроме того, химические свойства «нановещества» могут в значительной степени меняться из-за проявлений квантовых эффектов, что в итоге может сделать безопасное вещество очень опасным. И, наконец, в силу своих малых размеров наночастицы свободно проходят сквозь клеточные мембраны, повреждая клеточные органеллы и нарушая работу клеток.
Наномир дарит человеку бесконечные перспективы, но и большие риски, принуждая к тщательной проверке и анализу новых технологический решений.
Вопросы, вынесенные на практическое занятие:
1. Нанотехнологии. Развитие нанотехнологий. Сканирующий туннельный микроскоп. Сканирующий атомно-силовой микроскоп. Задачи нанотехнологии.
2. Нанохимия, нанооптика, нанофотоника, наноэлектроника.
3. Наночастицы. Три основных класса наночастиц. Нанокомпозиты. Супрамолекулярные структуры, полученные в результате «самосборки» наночастиц.
4. Ротаксаны, дендримеры, фуллерены, нанотрубки, графен.
5. ДНК-нанотехнологии: идеология, предполагаемые сферы применения.
6. Наномедицина как новое междисциплинарное направление медицинской науки.
7. Основные подходы к наномедицине: подход «сверху-вниз»; мокрая» нанотехнология; молекулярная нанотехнология; нанороботы.
8. Наноманипуляторы.
9. Адресная доставка лекарств.
10. Адресная доставка лекарств.
11. Диагностика заболеваний с помощью квантовых точек.
12. Лаборатории на чипе.
13. Биосовместимые наноматериалы, импланты.
14. Возможные риски применения нанотехнологий.
ТЕМА 7
Дата добавления: 2018-11-24; просмотров: 2041; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
