Влияние предварительной обработки 3Т3-клеток факторами роста на срок вхождения в фазу S

4. Молекулярные механизмы действия белковых факторов роста пока неясны, однако отдельные этапы процесса поддаются экспериментальному исследованию. Например, ФРЭ стимулирует пролиферацию эпителиальных клеток многих типов при первом связывании с рецепторами ФРЭ на их поверхности. Роль рецептора ФРЭ в распространении сигнала пролиферации теперь проясняется благодаря изучению самого рецептора. При этом широко используют клеточную линию А-431 мышиных фибробластов, содержащих необычайно большое число рецепторов ФРЭ, что существенно облегчает их исследование. Рассмотрим следующую серию экспериментов.
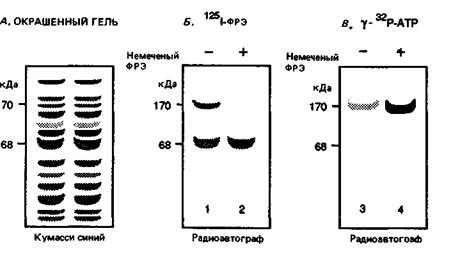
1. Препараты плазматических мембран из клеток А-431 содержат много белков, как показывает их анализ в ДСН-геле (рис. 10-2, А). Однако при добавлении к такому препарату 1251-ФРЭ в присутствии агента, сшивающего белки, метку включают только два белка (рис. 10-2, Б, первая дорожка). При добавлении к среде инкубации избытка немеченого ФРЭ метка в полосе 170 кДа исчезает (рис. 10-2, Б, вторая дорожка).
2. Если препарат мембран инкубировать с γ-32Р-АТР, то некоторые белки, в том числе и белок с мол. массой 170 кДа, фосфорилируются. Включение в состав инкубационной смеси ФРЭ приводит к существенному ускорению этой реакции.
3. Если осадить белок 170 кДа с помощью специфичных к нему антител и затем повторить инкубацию осадка с γ -32Р-АТР, то белок 170 кДа фосфорилируется в ходе ФРЭ-стимулируемой реакции (рис. 10-2, В, дорожка 3 и 4).
|
|
|
4. Если осажденный антителом белок вначале разгоняют в ДСН-геле, а затем ренатурируют в этом геле, то последующая инкубация с γ -32Р-АТР в присутствии и в отсутствие ФРЭ приводит к такому же распределению, как приведенное на рис. 10-2, В.
|
|
Рис. 10-2. Анализ рецептора ФРЭ. А. ДСН-гель препарата мембран из клеток А-431. Б. ДСН-гель препарата мембран из клеток А-431, инкубированных с 1251-ФРЭ и со сшивающим белки агентом в присутствии и в отсутствие избытка меченого ФРЭ. В. ДСН-гель осажденного с помощью антител рецептора ФРЭ, инкубированного с γ -32Р-АТР в присутствии и в отсутствие ФРЭ.
A. Какой из опытов наиболее четко демонстрирует, что белок с мол. массой 170 кДа является рецептором ФРЭ?
Б. Является ли рецептор ФРЭ субстратом для ФРЭ-стимулируемой протеинкиназы? Как это можно определить?
B. Какие опыты показывают, что рецептор ФРЭ представляет собой протеинкиназу?
Г. Можно ли сделать вывод, что рецептор ФРЭ служит субстратом для своей собственной протеинкиназной активности?
5. Среди патогенных организмов довольно распространена способность периодически изменять свои поверхностные структуры с целью защиты от иммунного ответа хозяев. Так, бактерии рода Salmonella (способные вызывать пищевые отравления) могут существовать в двух формах, различающихся своими антигенными детерминантами, или фазами, как они были названы первооткрывателями в 1922 г. Бактерии, находящиеся в двух разных фазах, синтезируют разные типы флагеллина – белка, образующего жгутик. Бактерии, находящиеся в фазе 1, переключаются на фазу 2 примерно один раз на тысячу делений клетки. С такой же частотой происходит и обратный процесс. Изначально были выдвинуты две гипотезы о механизме переключения: перестройка ДНК, например вставка или инверсия, и модификация ДНК, например метилирование.
|
|
|
Два типа флагеллинов, ответственных за фазовую вариацию, кодируются несцепленными генами H 1 и Н2, каждый из которых кодирует полностью функциональный флагеллин. Генетический элемент, ответственный за переключение фаз у бактерий, расположен очень близко к гену Н2. С целью выявить механизм, ответственный за переключение, был проклонирован фрагмент ДНК, содержащий ген Н2. При введении этого гена в Е. coli , не имеющую жгутиков, большинство клеток, включивших плазмиду, приобретали подвижность, т. е. синтезировали флагеллин, кодируемый геном Н2. Однако в немногих колониях Е. coli клетки были неподвижными несмотря на то, что несли плазмиду. Если из клонов таких неподвижных клеток выделяли ДНК и вводили ее в свежие культуры Е. coli , то некоторые из трансформированных бактерий приобретали подвижность, т.е. в них начинается синтез флагеллина Н2.
|
|
|
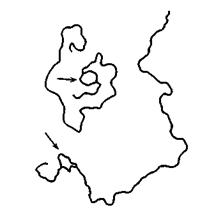
Из культур, в которых произошло переключение, выделяли ДНК, обрабатывали ее рестриктазой, нагревали, чтобы цепи ДНК разделились (плавление), и затем медленно охлаждали, чтобы цепи ДНК опять соединились (гибридизация). Затем молекулы ДНК изучали с помощью электронной микроскопии. Примерно 5% молекул содержали глазок, образованный двумя равными по длине сегментами одноцепочечной ДНК; глазок находился в одном и том же месте вблизи одного из концов. Две такие молекулы показаны на рис. 10-3.
|
|
Рис. 10-3. Результат гибридизации фрагментов ДНК из клеток Е. coli, способных к переключению. Стрелками указаны одноцепочечные глазки.
А. Когда клетки Salmonella переключаются с синтеза флагеллина одного типа на синтез флагеллина другого типа, все клетки сохраняют подвижность. Почему у Е. coli переключение приводит к замене подвижной формы на неподвижную?
Б. Объясните, как с помощью этих результатов можно определить, какой механизм ответственен за переключение: перестройка ДНК или модификация ДНК?
|
|
|
В. Попробуйте с помощью этих результатов определить, с каким типом перестройки ДНК связано переключение: с делецией, вставкой или инверсией ДНК?
6. Расскажите о гипотезе Т. Моргана о влиянии ядерных и цитоплазматических генов на направление развития.
7. Расскажите об опытах Уиттейкера (1973) по регуляции появления у асцидии ацетилхонэстеразы и тирозиназы и их значении.
Занятие 11
Дата добавления: 2018-10-25; просмотров: 379; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!