Тема: Механизмы репарации ДНК
1. Заполните пропуски в следующих утверждениях.
А. Большая часть спонтанных изменений в ДНК быстро ликвидируется за счет процесса исправления, называемого ___________; лишь изредка механизм поддержания постоянства структуры ДНК не срабатывает, и появившееся в последовательности нуклеотидов изменение сохраняется; оно называется ________.
Б. Для генов, которые кодируют _________, участвующие в свертывании крови, характерно накопление мутаций, не подвергающихся давлению отбора.
В. Два наиболее распространенных изменения в ДНК – это _________, возникающая в результате разрыва N-гликозидных связей аденина или гуанина с дезоксирибозой, и ____________, при котором цитозин превращается в урацил.
Г. Репарация ДНК включает три этапа: узнавание и удаление измененной части цепи ДНК ферментами, называемыми ___________; последующий ресинтез удаленного участка ферментом ________ и сшивание разрыва, оставшегося в цепи ДНК, ферментом ___________.
Д. Нехватка основания, обычно соединенного с дезоксирибозой в молекуле ДНК, быстро распознается ферментом _________, которая разрезает фосфодиэфирный остов цепи ДНК в измененном участке.
Е. Каждая ________ узнает в ДНК измененные основания определенного типа и катализирует их гидролитическое отщепление от сахара дезоксирибозы.
Ж. Те повреждения ДНК, которые создают искажения в ее спиральной структуре, удаляются с помощью механизма репарации ________.
З. У Е. со li любая остановка репликации, вызванная повреждением ДНК, служит сигналом для _________, позволяющего преодолеть блок репликации и тем самым дающего клетке шанс на выживание.
|
|
|
2. Укажите, какие из следующих утверждений правильные, а какие – нет. Если утверждение неверно, объясните почему.
А. Оценки частоты мутаций, основанные на различиях в аминокислотном составе между одними и теми же белками у разных видов, всегда будут заниженными, поскольку некоторые мутации могут существенно затрагивать функцию белка и исключаться из популяции под давлением отбора.
Б. Поскольку гистоны Н4 фактически идентичны у всех видов, то следует ожидать, что и гены гистонов Н4 у разных видов тоже идентичны.
В. Наблюдаемые скорости мутирования, хотя они и очень низки, тем не менее определяют число незаменимых генов: в любом организме оно составляет приблизительно 60000.
Г. Существуют разнообразные механизмы репарации, но все они зависят от наличия двух копий генетического материала, по одной в каждой хромосоме диплоидного организма.
Д. Как при спонтанной апуринизации, так и при удалении дезаминированного цитозина урацил-специфической гликозилазой ДНК образуется один и тот же промежуточный продукт, служащий субстратом для АП-эндонуклеазы.
|
|
|
Е. Только начальный этап репарации ДНК катализируется уникальными для процесса репарации ферментами; последующие ее этапы катализируются ферментами, выполняющими более общие функции в метаболизме ДНК.
Ж. Основное назначение экстренного SOS-ответа у Е. c о li – повысить выживаемость клеток за счет внедрения компенсирующих мутаций вблизи участка первоначального повреждения ДНК.
З. Все продукты спонтанного дезаминирования четырех обычных оснований ДНК узнаются как неестественные, когда они возникают в ДНК.
3. Кроме летального действия УФ-свет оказывает также мутагенный эффект. Предположим, что вы измерили частоту мутаций, индуцированных ультрафиолетом, у штамма Е. со li дикого типа и у штамма с дефектами либо по гену uvr А, либо по гену recА. Результаты приведены в табл. 6-1. Неожиданно эти штаммы оказались заметно различающимися по своей мутабильности под действием УФ-света.
Таблица 6-1
Частота УФ- индуци рованных мутаций у разных штаммов Е. со li
| Штамм | Выживаемость | Число мутаций/1010 выживших клеток |
| Дикий тип | 100 | 400 |
| recА | 10 | 1 |
| uvr А | 10 | 40000 |
А. Предполагая, что продукты генов recА и uvr А участвуют в различных механизмах репарации повреждений, вызванных ультрафиолетом, ответьте, какой путь более предрасположен к ошибкам? Какой механизм преобладает в клетках дикого типа?
|
|
|
Б. Путь, подверженный ошибкам, связан, по-видимому, с неправильным включением нуклеотидов против участка с неисправленным повреждением. При необходимости ДНК-полимеразы включают против участка с неясными кодирующими свойствами, например, против пиримидиновых димеров, адениловые нуклеотиды. Представляет ли собой это так называемое «правило А» хорошую стратегию для борьбы с УФ-повреждениями ДНК? Рассчитайте частоту изменений в основаниях (мутации) при действии этого правила и при случайном включении (каждый нуклеотид с равной вероятностью) для Е. со li , у которой пиримидиновыми димерами являются приблизительно 60% ТТ, 30% ТС и СТ и 10% СС.
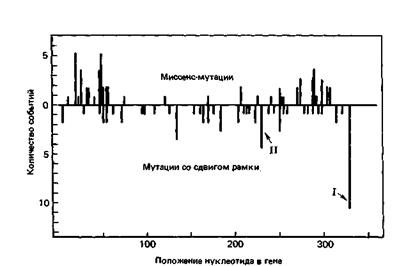
4. Варианты индуцированных ультрафиолетом мутаций в гене 1ас I у Е. со li были подвергнуты тщательному изучению. На рис. 6-1 сверху от линии нуля показано общее число выделенных независимо миссенс-мутаций (несинонимичных замен кодонов аминокислот), а под линией нуля – число мутаций со сдвигом рамки (изменение рамки считывания). Количество мутаций обеих категорий почти одинаково. Миссенс-мутации были идентифицированы по критерию утраты функции белка, кодируемого геном 1ас I (1ас-репрессор); мутации со сдвигом рамки были выявлены с помощью метода слияния генов, которое не зависит от функционирования 1ас-репрессора.
|
|
|
А. Как вы считаете, в чем причина того, что на концах гена миссенс-мутаций возникает гораздо больше, чем в его середине? Почему мутации со сдвигом рамки распределены по гену более или менее равномерно (за исключением одного или двух «горячих мест»)?
Б. Анализ последовательности в одном «горячем месте» ДНК (с пометкой I на рис. 6-1) показал, что у дикого типа это было ТТТТТС, а у мутанта – ТТТТС. Другая наиболее частая мутация (с пометкой II на рис. 6-1) заключается в изменении от GТТТТС к GТТТС. Анализ других мутаций со сдвигом рамки показал, что большинство их связано с потерей одного основания; никаких вставок обнаружено не было. Можете ли вы высказать предположение о молекулярном механизме потери одной пары оснований исходя из того, что вам известно о природе УФ-повреждений ДНК?
|
|
Рис. 6-1. Распределение индуцированных ультрафиолетовым излучением мутаций в гене 1ас I у Е. со li.
5. Кроме эндонуклеазной репарации uvrАВС, рекомбинантной репарации и SOS-репарации у бактерий есть еще более мощная система репарации, предназначенная для ликвидации пиримидиновых димеров (данная система здесь не рассматривается). Этот механизм был открыт в процессе поиска некоего неконтролируемого фактора, играющего роль в действии ультрафиолетового света на бактерии. История открытия похожа на сюжет, описанный ниже.
Представьте, что вы параллельно со своим руководителем пытаетесь выделить мутанты Е. со li , используя ультрафиолетовое облучение в качестве мутагенного воздействия. Для того чтобы получить много различных мутантов, вы применяете такую дозу облучения, от которой гибнет 99,99% бактерий. Полученные вами результаты гораздо более однозначны, чем те, что получил ваш руководитель, использовавший в 10 и 100 раз более высокие дозы облучения, чтобы достичь такого же уровня гибели бактерий. Руководитель сомневается в ваших результатах из-за того, что вы всегда ставите опыты ночью, после его ухода. Когда по настоянию руководителя вы приходите утром и ставите свои опыты параллельно с ним, у вас обоих неожиданно получаются совершенно одинаковые результаты. Вы немного огорчены, потому что полученные данные ближе к результатам вашего руководителя, а ведь вы самоуверенно полагали, что в экспериментальной работе более искусны, чем ваш наставник, которого к тому же редко видели в лабораторном халате в последнее время. Однако когда вы вместе повторяете эксперименты ночью, то, к удивлению руководителя, результаты оказываются точно такими, как те, что вы получили раньше.
Теперь, когда утвердилось доверие к результатам друг друга, быстро появляется ясность. Оказывается, для достижения одного и того же уровня летального повреждения бактерий в дневное время (в полдень) нужна более высокая доза ультрафиолетового света, чем утром. В солнечные дни требуются более высокие дозы, чем в пасмурные. Окна лаборатории выходят на запад. Попробуйте ответить, какой переменный фактор вносил неясность в ваши эксперименты?
6. Такие мутагены, как N-метил-N'-нитро-N-нитрозогуанидин (МННГ) и метилнитрозомочевина (МНМ), являются мощными метилирующими ДНК агентами. Они чрезвычайно токсичны для клеток. Нитрозогуанидины применяются в исследовательской работе в качестве мутагенов, а в клинической практике – как лекарственные средства при химиотерапии рака, поскольку в первую очередь они вызывают гибель клеток, находящихся на стадии репликации.
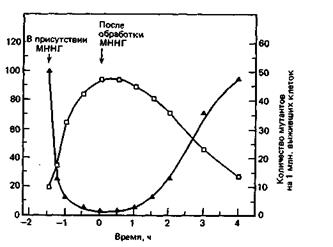
Оригинальный эксперимент, который привел к открытию алкилирующей системы репарации у бактерий, был задуман так, чтобы определить долговременный эффект применения низких доз МННГ (как при химиотерапии) в сопоставлении с эффектом временного воздействия высоких доз МННГ (применяемых для мутагенеза). Бактерии помещали сначала в среду с низкой концентрацией МННГ (1 мкг/мл) на 1,5 ч, а затем переводили в свежую среду без МННГ. В разные моменты инкубации при низкой концентрации МННГ и после нее пробы из суспензии бактерий подвергали воздействию МННГ в высокой концентрации (100 мкг/мл) в течение 5 мин, а затем проверяли на жизнеспособность и частоту мутаций. На рис. 6-2 хорошо видно, что во время инкубации в среде с низкой концентрацией МННГ количество выживших клеток временно увеличивалось и частота мутаций у выживших бактерий уменьшалась. Как показано на рис. 6-3, этой приспособительной реакции на низкие дозы МННГ не наблюдалось, если в инкубационную среду был добавлен хлорамфеникол (ингибитор синтеза белка).
|
|
Рис. 6-2. Адаптационный ответ Е. со li на низкие дозы мутагена МННГ. Мутаген в концентрации 1 мкг/мл присутствовал в среде в период от 1,5 до 0 ч. Пробы отбирали в различные моменты инкубации и кратковременно обрабатывали их мутагеном в высокой концентрации (100 мкг/мл), после чего оценивали количество выживших клеток и частоту образования мутантов.
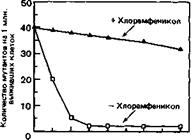
Рис. 6-3. Действие хлорамфеникола на адаптационный ответ при низких дозах мутагена МННГ. После инкубации бактерий в течение разных периодов времени в присутствии МННГ (1 мкг/мл) отбирали пробы и обрабатывали их мутагеном в концентрации 100 мкг/мл для определения чувствительности к мутагену.
А. Связана ли приспособительная реакция Е. соli на низкие уровни МННГ с активацией уже существующего белка или для нее необходим синтез нового белка?
Б. Как вы полагаете, почему приспособительная реакция Е. со li на низкую дозу МННГ является кратковременной?
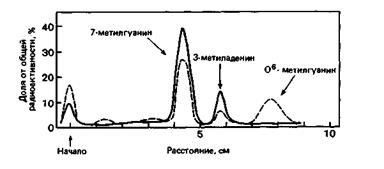
7. Природа мутаций, вызываемых МННГ, а также механизм их удаления из ДНК были определены в следующих экспериментах. Чтобы выяснить характер мутагенного повреждения, интактные, а также обработанные низкими дозами МННГ бактерии инкубировали 10 мин в среде, содержащей меченый мутаген-3Н-МННГ, в концентрации 50 мкг/мл. Затем из бактерий выделяли ДНК, гидролизовали ее до нуклеотидов и определяли радиоактивные пурины с помощью хроматографии на бумаге, как показано на рис. 6-4.
|
|
Рис. 6-4. Хроматографическое разделение меченых метилированных пуринов из ДНК необработанных бактерий и из ДНК бактерий, обработанных мутагеном МННГ в низкой концентрации. Сплошная линия – спектр метилированных пуринов из ДНК необработанных бактерий; штриховая – спектр метилированных пуринов из ДНК бактерий, обработанных мутагеном.
Чтобы выяснить механизм ликвидации мутагенного повреждения, был сначала выделен и очищен фермент, ответственный за удаление места повреждения. Кинетику репарации изучали путем инкубации различных количеств фермента (мол. масса 19000) с ДНК, содержащей 0,26 пмоль мутагенного основания, меченного тритием. В разные моменты инкубации отбирали пробы и анализировали в них ДНК на остаточное содержание мутагенного основания (рис. 6-5). Когда опыт повторили при 5°С вместо 37°С, начальные скорости репарации были более низкими, а конечные теми же самыми.
А. Какой метилированный пурин ответствен за мутагенное действие МННГ?
Б. В чем состоит особенность кинетики удаления метильной группы из мутагенного основания? Связана ли эта особенность с нестабильностью фермента?
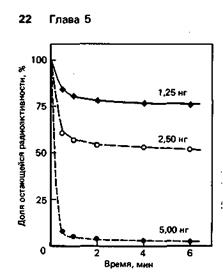
Рис. 6-5. Удаление меченных тритием метальных групп из ДНК с помощью очищенного фермента метилтрансферазы. Количество очищенного фермента указано над каждой кривой.
Таблица 6-2
Дата добавления: 2018-10-25; просмотров: 1197; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!