Тема: Процессинг РНК и биосинтез белка
1. Заполните пропуски в следующих утверждениях.
A. Транскрипция начинается, когда молекула _________ связывается с промоторной последовательностью ДНК.
Б. Сигма-субъединица РНК-полимеразы Е. coli играет особую роль в транскрипции, являясь __________: она позволяет ферменту находить обобщенную последовательность промотора Е. coli .
B. После того как синтезируются первые восемь нуклеотидов молекулы РНК, сигма-субъединица отделяется, и вместо нее с ферментом соединяется несколько _________.
Г. __________ транскрибирует гены, которые впоследствии будут
транслироваться в белок, __________ синтезирует крупные молекулы рибосомных РНК, а ___________ продуцирует разнообразные очень мелкие стабильные РНК.
Д. Для образования активного промотора с ДНК должны связаться один или более сайт-специфических белков, которые называются _________.
Е. TFIID, необходимый для многих промоторов РНК-полимеразы II, представляет собой крупный белковый комплекс, который обычно называют ________, так как он может связываться с консервативной АТ-богатой последовательностью, называемой ________.
Ж. У эукариот молекулы РНК-полимеразы начинают и заканчивают транскрипцию в определенных сайтах хромосомы. Область между этими сайтами называется _______.
З. Транскрипты, образуемые в ядре РНК-полимеразой II, известны под названием ________, поскольку самой первой характеристикой, позволившей отличить их от других молекул РНК в ядре, было именно разнообразие их размеров.
|
|
|
И. Транскрипты, образуемые РНК-полимеразой II, выходят из ядра в виде молекул _________.
К. При добавлении к 5'-концу первичного транскрипта метилированного нуклеотида G образуется ___________, который, по-видимому, защищает растущую РНК от деградации и играет важную роль в инициации синтеза белка.
Л. 3'-Конец большинства транскриптов, синтезируемых РНК-полимеразой II, определяется после модификации, в ходе которой растущий синтезируемый транскрипт расщепляется в определенном сайте и к образовавшемуся 3'-концу особой полимеразой добавляется _________.
М. Модификации на 5'- и 3'-концах цепи РНК завершают формирование _________.
Н. После удаления интронной последовательности кодирующие последовательности РНК по обеим сторонам интрона соединяются друг с другом в ходе реакции, известной под названием _________.
О. У эукариот новосинтезированная РНК, по-видимому, сразу же конденсируется с образованием расположенных близко друг от друга белок-содержащих частиц, называемых частицами _________.
П. Небольшие U-PHK в клеточном ядре соединяются с белками с образованием ___________.
Р. Консервативные последовательности на границах интрона называют _________ (донорный сайт) и _________ (акцепторный сайт).
|
|
|
С. Крупный многокомпонентный рибонуклеопротеиновый комплекс, осуществляющий сплайсинг первичного транскрипта, называется _________.
Т. У больных с _________ наблюдается аномально низкий уровень гемоглобина – белка, входящего в состав эритроцитов и переносящего кислород.
У. Соединение молекул рРНК с рибосомными белками происходит в ядре, в крупной, хорошо различимой структуре, называемой _________.
Ф. Каждый кластер генов рРНК образует область _________.
2. Укажите, какие из следующих утверждений правильные, а какие – нет. Если утверждение неверно, объясните почему.
А. В составе РНК-полимеразы Е. coli всегда есть факторы инициации и элонгации, что позволяет ей узнавать обобщенные последовательности промотора и наращивать цепь РНК.
Б. РНК-полимеразы I, II и III состоят из многих субъединиц, ни одна из которых не содержится во всех трех полимеразах сразу.
В. Бактериальные РНК-полимеразы могут связываться непосредственно с промотором, а эукариотические РНК-полимеразы могут связаться со своим промотором только в присутствии дополнительных белковых факторов, которые предварительно присоединились к ДНК.
Г. Разные сайты начала синтеза у РНК-полимеразы II сильно отличаются друг от друга по эффективности действия, и, таким образом, некоторые гены транскрибируются с гораздо более высокими скоростями, чем остальные.
|
|
|
Д. 3'-Конец большинства транскриптов, образуемых РНК-полимеразой II, формируется при терминации транскрипции, когда к освободившемуся 3-'концу быстро присоединяется последовательность poly(A).
Е. Лишь около 5% РНК, синтезируемой РНК-полимеразой II, достигает цитоплазмы: вся остальная распадается в ядре.
Ж. Сплайсинг РНК происходит в ядре, где рибосомы отсутствуют, и РНК экспортируется в цитоплазму только по завершении процессинга.
З. Частицы гяРНП и мяРНП похожи на рибосомы, так как каждая из них содержит много полипептидных цепей, образующих комплекс со стабильной молекулой РНК.
И. Поскольку интроны представляют собой главным образом «связку» между генами, то совсем необязательно, чтобы в ходе сплайсинга они были вырезаны из первичного транскрипта с большой точностью.
К. Сплайсинг РНК дает возможность получать из одного и того же первичного транскрипта РНК несколько разных мРНК и соответственно несколько разных белков.
Л. Главное различие между самосплайсирующимися нитронами групп I и II состоит в том, что у нитронов группы I атакующий нуклеотид свободен, а у нитронов группы II он входит в состав интронной последовательности.
|
|
|
М. В клетках большинства позвоночных кластер генов, кодирующих 28S-pPHK, транскрибируется независимо от кластера генов, кодирующих 18S- и 5,8S-рРНК.
Н. Рибосомные РНК образуются в ядрышке – специализированной области ядра, а затем переносятся в цитоплазму, где они связываются с рибосомными белками и образуют рибосомы.
О. В отличие от цитоплазматических органелл ядрышко не ограничено мембраной.
П. В клетках, находящихся на стадии метафазы, ядрышко отсутствует.
Р. Полагают, что деконденсированные хромосомы в интерфазных клетках в значительной степени переплетены между собой.
3. Вы измучились с определением факторов специфической транскрипции: все процедуры довольно длительны, а факторы часто оказываются нестабильными. К тому моменту, когда вам наконец удается идентифицировать искомую фракцию, фактор уже теряет свою активность. И вот в один прекрасный день вам в голову приходит блестящая идея по поводу того, как ускорить определение. Вы придумали, что можно получить последовательность ДНК, не содержащую С, встроить ее рядом с промотором и проинкубировать такую конструкцию в соответствующей реакционной смеси. В этом случае с промотора будут синтезироваться транскрипты, не содержащие G. В отсутствие GTP на сконструированной вами последовательности ДНК будет синтезироваться единственный длинный транскрипт РНК. Если это удастся показать, то вы сможете легко определять специфическую транскрипцию, просто измеряя включение меченого нуклеотида.
Для проверки своей идеи вы конструируете две плазмиды, несущие такие тест-последовательности ДНК: одну плазмиду с промотором из аденовируса (pMLl) и другую без него (рС1). Вы смешиваете каждую из этих двух плазмид с очищенной РНК-полимеразой II, вашими лучшими препаратами факторов транскрипции и 32Р-СТР. Кроме того, вы добавляете в разных сочетаниях GTP, РНКазу Т1, разрезающую РНК рядом с каждым G, и 3'-О-метил-GTP, который при включении в растущую цепь РНК терминирует транскрипцию. Вы определяете продукты реакции с помощью гель-электрофореза, результаты которого показаны на рис. 8-1.
A. Почему транскрипт размером 400 нуклеотидов, отсутствующий на дорожке 4, присутствует на дорожках 2, 6, и 8?
Б. Можете ли вы определить, почему происходит синтез в образце, нанесенном на дорожку 3, где взята плазмида, не несущая промотора?
B. Почему транскрипт размером 400 нуклеотидов присутствует на дорожке 5, а на дорожке 7 отсутствует?
Г. Вы разработали этот хитроумный метод, чтобы определить факторы транскрипции. Один из ваших коллег замечает, что идентификацию нужно проводить сначала в грубых экстрактах, которые содержат GTP. Сможете ли вы определить специфическую транскрипцию в грубых экстрактах? Как это сделать?
Рис. 8-1. Строение тест-плазмид (А) и результаты определения транскрипции при разных условиях (Б). Во все реакционные смеси добавляли РНК-полимеразу II, факторы транскрипции и 32Р-СТР. Наличие других компонентов отмечено над каждой дорожкой: (+) означает, что компонент присутствует в реакционной смеси, (—) означает, что компонент отсутствует
|
|
4. Как упаковка ДНК в хроматине влияет на транскрипцию у эукариот? Вы предполагаете решить эту задачу в лоб, используя не содержащую С транскрипционную единицу (полученную в задаче 3) и четырех факторов транскрипции-TFIIА, TFIIB, TFIID и TFIIE.
Для изучения влияния хроматина на транскрипцию вы сначала упаковываете матрицу в нуклеосомы (используя экстракт из ооцитов лягушки), выделяете хроматиновую матрицу и затем добавляете компоненты, необходимые для транскрипции. Транскрипция не идет (рис. 8-2, дорожка 2). Тогда вы пытаетесь проделать все это в ином порядке. Сначала вы инкубируете матрицу с компонентами, необходимыми для транскрипции, но в отсутствие нуклеозидтрифосфатов (NTP), затем упаковываете матрицу в нуклеосомы и выделяете хроматиновую матрицу. Когда вы теперь добавляете компоненты, необходимые для транскрипции (в присутствии NTP), транскрипция идет так хорошо, как будто вы проводите ее с очищенной ДНК (дорожки 1 и 3). Отсюда вы делаете вывод, что с матрицей должны связаться один или более компонентов транскрипции, которые и обеспечивают доступ к промотору.
Для более подробного анализа этого явления вы проводите два дополнительных опыта. В ходе одного из них вы не добавляете отдельные компоненты, необходимые для транскрипции, в течение предварительной инкубации (дорожки 4-8). Во втором опыте вы не добавляете отдельные компоненты, необходимые для транскрипции, в ходе самой транскрипции (дорожки 9-13).
A. Какой из компонентов, необходимых для транскрипции, должен присутствовать во время предварительной инкубации, чтобы матрица сохраняла свою активность при сборке хроматина?
Б. Какой из компонентов, необходимых для транскрипции, образует с матрицей комплекс, оказывающийся устойчивым при сборке хроматина и последующей очистке?
B. Какой из компонентов, необходимых для транскрипции, следует добавить в ходе реакции, чтобы получить транскрипт?
|
|
Рис. 8-2. Влияние сборки хроматина на транскрипцию. Матрицы для транскрипции предынкубировали в разных условиях: в отсутствие всех компонентов, необходимых для транскрипции; добавив все, кроме какого-либо одного компонента (например, — А означает, что отсутствует TFIIA, и — II означает, что отсутствует РНК-полимераза II); в присутствии всех компонентов. Определение транскрипции проводили в присутствии всех или всех за исключением одного компонентов транскрипции.
5. Трипаносома – микроорганизм, вызывающий сонную болезнь – может изменять состав своей гликопротеиновой оболочки и таким образом защищаться от иммунного ответа хозяина. Вы изучаете синтез вариабельного гликопротеина оболочки (VSG- variable surface glycoprotein) и уже картировали ген, кодирующий этот белок и расположенный вблизи теломеры одной из хромосом. Однако вам не удалось локализовать промотор. Из ваших данных следует, что его может отделять от гена VSG много тысяч нуклеотидов.
Ваш друг уже давно предлагал использовать для картирования промотора облучение ультрафиолетом – метод, который уже хорошо зарекомендовал себя при картировании транскрипционной единицы аденовируса. РНК-полимераза не может продолжать транскрипцию через пиримидиновые димеры, возникающие в результате облучения ультрафиолетом, поэтому чувствительность транскрипции к облучению ультрафиолетом можно использовать как меру расстояния между началом транскрипции и той точкой, в которой вы определяете транскрипцию. Потерпев неудачу с другими методами, вы решаете испробовать этот подход.
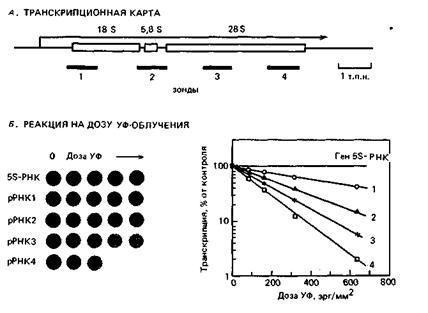
Для калибровки системы вы определяете транскрипцию генов рибосомной РНК. Транскрипционная единица 5S-pPHK содержит немногим более 100 нуклеотидов, тогда как гены 18S-, 5,8S-и 28S-pPHK составляют часть одной транскрипционной единицы длиной 8 т. п. н. (рис. 8-3, А). Вы облучаете трипаносом ультрафиолетом в возрастающих дозах, выделяете ядра и инкубируете их с 32P-dNTP. Затем выделяете из ядер РНК и гибридизуете ее с клонированной ДНК, кодирующей ген 5S-PHK и различные фрагменты транскрипционной единицы рибосомной РНК (рис. 8-3, Б). Если на графике откладывать логарифм значения радиоактивности в зависимости от дозы ультрафиолетового облучения, то получится прямая линия (рис. 8-3, Б). Угол наклона такой линии пропорционален расстоянию от промотора до области гибридизации зонда.
Если вы повторите этот эксперимент с зондом, комплементарным началу гена VSG, то обнаружите, что транскрипция инактивируется примерно в 7 раз быстрее, чем в случае зонда 4 транскрипционной единицы рибосомной РНК.
|
|
Рис. 8-3. Строение транскрипционной единицы рибосомной РНК (А) и чувствительность к ультрафиолету транскрипционных единиц 5S-PHK и других рибосомных РНК (Б). А. Указано расположение гибридизационных зондов относительно промотора (левый конец стрелки) в транскрипционной единице. Б. Транскрипция в зависимости от дозы облучения ультрафиолетом, выявленная при дот-гибридизации (слева) и представленная в виде графика (справа).
A. Почему чувствительность транскрипции РНК к ультрафиолетовому облучению увеличивается по мере увеличения расстояния от промотора?
Б. Сделайте приблизительную оценку того, на каком расстоянии находится ген VSG от своего промотора. Какое допущение следует сделать, чтобы определить это расстояние?
B. Вы обнаружили другой ген, расположенный перед геном VSG на расстоянии примерно 10 т. п. н. Транскрипция этого гена приблизительно на 20% менее чувствительна к инактивации ультрафиолетом, чем транскрипция гена VSG. Могут ли эти гены транскрибироваться с одного промотора?
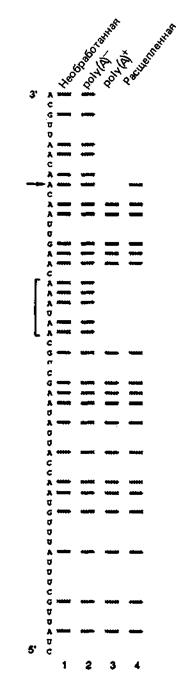
6. 3'-Концы эукариотических мРНК в большинстве случаев определяют путем расщепления РНК-предшественника и последующего присоединения роlу(А)-хвоста длиной от 200 до 300 нуклеотидов. Главным сигналом для полиаденилирования служит последовательность AAUAAA, расположенная непосредственно на 5'-конце сайта полиаденилирования. Значение этого сигнала определяли разными способами. Один элегантный подход заключался в использовании химической модификации, которая препятствует специфическому взаимодействию с белком. Этот метод состоит в том, что РНК, содержащую сигнальную последовательность, обрабатывают диэтилпирокарбонатом, который взаимодействует с А и G с образованием карбоксиэтилированных производных. Такая обработка делает модифицированные сайты крайне чувствительными к разрушению анилином в соответствующих условиях. Если исходные молекулы РНК пометить с одного конца и обработать так, чтобы в среднем на одну молекулу РНК приходилась одна модификация, то при расщеплении анилином образуется серия фрагментов, длина которых будет соответствовать расположению А и G в РНК (рис. 8-4, дорожка 1). (Этот метод полностью аналогичен методу определения последовательности нуклеотидов ДНК.)
Для определения искомых остатков А и G модифицированные, но еще целые молекулы РНК инкубируют с экстрактом, обеспечивающим расщепление и полиаденилирование. Молекулы РНК затем разделяют на poly(A)+- и poly(A)–-PHK, обрабатывают анилином и фрагменты анализируют в геле (дорожки 2 и 3). Во второй пробе к экстракту добавляют ЭДТА, что препятствует полиаденилированию, но не влияет на расщепление. Расщепленные молекулы затем выделяют, обрабатывают анилином и также наносят на гель (дорожка 4).
|
|
Рис. 8-4. Радиоавтографическое определение пуринов, важных для расщепления и полиаденилирования. Последовательность РНК-предшественника указана слева, причем 5'-конец расположен внизу, а 3'-конец – вверху. Все молекулы РНК были модифицированы в реакции с диэтилпирокарбонатом. Дорожка 1 – РНК, не обработанная экстрактом (Необработанная). Дорожка 2 – РНК, обработанная экстрактом, но не полиаденилированная [poly(A)–]. Дорожка 3 – полиаденилированная РНК [poly(A) +]. Дорожка 4 – расщепленная, но не полиаденилированная РНК (Расщепленная).
A. Какие концы исходных молекул РНК были помечены?
Б. Объясните, почему полосы, соответствующие сигналу AAUAAA (отмечены на рис. 8-4 квадратной скобкой), отсутствуют в случае poly(A)+-PHK и расщепленной РНК?
B. Объясните, почему полоса, помеченная стрелкой [нуклеотид, к которому в норме добавляется poly(A)+], отсутствует в случае poly(A)+-PHK и присутствует в случае расщепленной РНК.
Г. Какие нуклеотиды А и G важны для расщепления и какие для полиаденилирования?
Д. Какую информацию можно получить, пометив молекулы РНК с другого конца?
7. В отличие от большинства информационных РНК гистоновые мРНК не содержат poly(A) на своих 3'-концах. Вместо этого они содержат другие дополнительные нуклеотиды за счет того, что отщепляются от своего длинного предшественника на несколько нуклеотидов ближе к 3'-концу шпилечной структуры. Кроме того, правильный процессинг предшественника гистоновой мРНК зависит от консервативной последовательности, расположенной непосредственно за участком расщепления. Судя по данным, полученным на морских ежах, эта консервативная последовательность взаимодействует с РНК, входящей в состав U7-мяРНП.
Вы изучаете процессинг гистоновых мРНК в клетках млекопитающих и хотите узнать, зависит ли формирование их 3'-конца от тех же взаимодействий. Как показано на рис. 8-5, А, между 3'-концами гистоновых мРНК морского ежа и человека наблюдается поразительное сходство. Вы показали, что ядерные экстракты клеток человека «правильно» расщепляют меченый синтетический предшественник гистоновой мРНК. Более того, если экстракт предварительно обработан нуклеазой для разрушения в нем РНК, он теряет способность расщеплять добавленный после этого предшественник гистоновой мРНК. Можно восстановить активность обработанного экстракта, добавив к нему частично очищенную фракцию, содержащую мяРНП.
Для более детального изучения процессинга вы синтезируете олигонуклеотиды ДНК, соответствующие области вокруг предполагаемого участка взаимодействия гистонового предшественника с мяРНП. Один олигонуклеотид содержит консервативную последовательность человека, другой олигонуклеотид – эту же последовательность мыши и третий – обобщенную последовательность, полученную на основе сравнения всех известных подобных консервативных последовательностей у млекопитающих (рис. 8-5, Б). Когда вы предынкубируете эти олигонуклеотиды с экстрактом в присутствии РНКазы Н (она разрезает РНК в гибридах ДНК-РНК), то процессинг предшественника полностью блокируется консервативными последовательностями мыши и обобщенной последовательностью, тогда как олигонуклеотиды, несущие консервативную последовательность человека, не оказывают никакого влияния. Два олигонуклеотида, проявляющие ингибирующее действие, также вызывали исчезновение из экстракта молекул мяРНК, состоящих из 63 нуклеотидов. Вам удалось выделить эту мяРНК и определить последовательность на ее 5'-конце (рис. 8-5, В).
|
|
Рис. 8-5. Последовательность нуклеотидов гистоновых РНК-предшественников (А), олиго-нуклеотиды ДНК (Б) и мяРНК (В). А. Последовательности инвертированных повторов, способных образовать в молекуле предшественника шпилечную структуру, подчеркнуты стрелками. Участок расщепления указан вертикальной стрелкой. Консервативный участок подчеркнут линией на (А) и (Б). В. m3G-триметил-кэп, характерный для U-PHK. Буквой N обозначен неизвестный нуклеотид.
А. Объясните смысл эксперимента с олигонуклеотидами. Что вы пытались узнать, инкубируя экстракт с олигонуклеотидами ДНК в присутствии РНКазы Н?
Б. В опыте был использован экстракт из клеток человека, поэтому вас удивило, что олигонуклеотид, содержащий консервативную последовательность человека, не подавлял процессинг, а олигонуклеотиды, содержащие консервативную последовательность мыши и обобщенную последовательность, ингибировали его. Какое объяснение вы можете предложить?
8. Вы только что распечатали на компьютере все последовательности ДНК для семейства генов β-глобина и берете эту кипу листов с собой на дачу, чтобы заняться ею в выходные дни. При просмотре распечатки вы обнаруживаете, что забыли указать, с каким участком гена имеете дело. Вам известно, что последовательности, представленные на рис. 8-6, расположены на одной из границ-экзон/интрон или интрон/экзон, и что эта граница проходит по пунктирной линии. Вы знаете также, что интроны всегда начинаются динуклеотидами GT и заканчиваются AG, но понимаете, что эти специфические последовательности могут быть расположены либо в начале, либо в конце интрона (рис. 8-6).
Если вы не сможете определить, с какой стороны от пунктирной линии расположен интрон, вам придется, несмотря на выходные дни, вернуться в город. От отчаяния вы пытаетесь разрешить задачу с эволюционной точки зрения. Вы знаете, что интроны меняются быстрее (в них чаще происходят нуклеотидные замены), чем экзоны, так как изменения последовательностей нитронов не затрагивают функцию. Поможет ли такой подход идентифицировать интрон или вам придется собираться в дорогу?
|
|
Рис. 8-6. Нуклеотидные последовательности генов β -глобина у разных видов как области экзонов и интронов.
9. Многие гены высших эукариот содержат большое число экзонов. Для правильного сплайсинга таких генов необходимо, чтобы соседние экзоны соединялись друг с другом. Если этого не произойдет, экзоны выпадут. Поскольку все 5'- и все 3'-сайты сплайсирования выглядят одинаково, то кажется удивительным, что при сплайсинге пропуски экзонов происходят весьма редко. Очевидно, должен существовать какой-то механизм, который хранит отпечатки соседних экзонов и обеспечивает их правильное соединение. Одно из предположений, объясняющих механизм сохранения определенного порядка экзонов при сплайсинге, состоит в том, что структуры, осуществляющие сплайсинг, связываются с сайтом сплайсинга на одном конце интрона и сканируют весь интрон в поисках второго сайта сплайсинга на другом конце. Подобный механизм мог бы гарантировать, что экзон никогда не будет пропущен. Вы очень заинтересовались этим предположением и решили его проверить. Для этого вы конструируете два мини-гена: один с дуплицированным 5'-сайтом и другой с дуплицированным 3'-сайтом сплайсинга (рис. 8-7). Вы вводите эти гены в клетки и анализируете образовавшиеся на них РНК, чтобы определить, какой из 5'- и 3'-сайтов отобран при сплайсинге.
|
|
Рис. 8-7. Мини-гены, сконструированные для изучения сканирования нитронов при сплайсинге РНК. Мини-ген 1 (А) содержит два 3'-сайта сплайсинга; мини-ген 2 (Б) содержит два 5'-сайта сплайсинга; прямоугольниками изображены целые экзоны; заштрихованными фигурами – части экзонов. Указаны 5'- и 3'-сайты соединения при сплайсинге.
А. Изобразите схематически, какие продукты вы ожидаете получить на каждом из мини-генов, в случае, если осуществляющие сплайсинг структуры связываются с 5'-сайтом сплайсинга и проверяют последовательность в направлении к 3'-сайту сплайсинга, и в случае, если они работают в противоположном направлении.
Б. При анализе РНК, образуемой с ваших трансфицированных мини-генов, вы обнаруживаете, что на каждом из них синтезируется смесь продуктов. Соединяются ли в результате сканирования интрона соседние экзоны?
10. Заполните пропуски в следующих утверждениях.
А. Преждевременная терминация транскрипции молекулы РНК, используемая как способ контроля экспрессии гена, называется _________.
Б. Многие гены высших эукариот образуют несколько по-разному сплайсированных молекул РНК из одного первичного транскрипта за счет ___________.
В. Различные белки, имеющие сходные функции и синтезируемые на молекулах мРНК, образованных из одного и того же первичного транскрипта РНК в результате альтернативного сплайсинга, называются __________.
Г. ___________ – это любая последовательность ДНК, транскрибируемая как отдельная единица и кодирующая одну или несколько близкородственных полипептидных цепей или молекул структурных РНК.
Д. Трансляцию молекул мРНК, кодирующих ферритин, блокируют белки, которые связываются с 5'-концами этих молекул в отсутствие железа. Это пример _________ контроля на уровне._________.
Е. В _________ контроле на уровне ________ могут участвовать определенные последовательности мРНК, которые обладают преимущественным сродством к рибосомам.
Ж. _________ – явление, обычное для ретровирусов – приводит к тому, что с одной молекулы мРНК могут синтезироваться два или более белка в различных количествах.
3. В некоторых случаях нуклеотидная последовательность первичного транскрипта РНК может изменяться в ходе процесса, называемого ________.
Занятие 9
Дата добавления: 2018-10-25; просмотров: 2104; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!